前列地尔对脓毒性休克患者复苏达标后微循环的影响
朱磊,刘健,李斌,靳修,帅佃奎,邓园园,刘丽平
脓毒症(sepsis)是引起患者死亡的重要因素,它以氧耗增加、外周血管阻力下降、组织血流分布不均和微循环障碍为特征,随着人口老龄化、抗生素的滥用、肿瘤发病率升高以及侵入性医疗手段的增加,脓毒症的发病率不断上升[1]。脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍[2],可发展为严重脓毒症(severe sepsis)和脓毒性休克(septic shock)。当其发展为脓毒性休克时,病死率高达50%以上。尽管脓毒性休克在目标导向治疗之后,全身血流动力学和氧代谢指标可被纠正,但微循环障碍仍持续存在且与病死率密切相关[3]。因此,脓毒性休克患者的治疗正由稳定大循环向改善微循环转换。对于脓毒性休克患者而言,在大循环稳定的前提下给予扩张血管药物解除小动脉和小静脉痉挛,能否改善微循环灌注意义重大[4]。本研究观察前列地尔对脓毒性休克患者大循环稳定后微循环的影响。
1 资料与方法
1.1 研究对象 选取兰州大学第一医院重症医学科2015年3月-2016年9月住院治疗的符合脓毒性休克诊断的患者。入选标准:①年龄≥18岁,性别不限;②符合脓毒性休克诊断标准[5-6]:脓毒症伴由其所致低血压,虽经液体治疗后仍无法逆转。本研究经兰州大学第一医院伦理委员会审查并通过(伦理号LDYYLL2016-0015),患者家属签署知情同意书。排除标准:①年龄<18岁,妊娠;②合并神经源性休克、脑血管意外、颅脑外伤患者;③入选24h内应用前列环素衍生物;④存在静脉应用硝酸甘油的绝对适应证(不稳定冠状动脉综合征等);⑤存在治疗禁忌证(疾病终末期,预计24h内死亡的患者);⑥有前列地尔过敏史患者。终止标准:①治疗未超出24h死亡或出院者;②未能坚持系统治疗者;③在给予血管活性药物过程中平均动脉压持续<65mmHg。
1.2 方法
1.2.1 分组及治疗 123例感染性休克患者,符合条件者71例。凡符合入选标准的感染性休克患者按早期目标导向治疗(early goal-directed therapy,EGDT)进行液体复苏,即应在第1个6h内达标:①中心静脉压(CVP)8~12mmHg;②平均动脉压(MAP)≥65mmHg;③尿量≥0.5ml/(kg·h);④上腔静脉血氧饱和度(ScvO2)≥70%或混合静脉血氧饱和度(SvO2)≥65%;⑤血乳酸下降至正常值;⑥输注红细胞使红细胞比容(HCT)达到30%。达标后由SPSS统计软件采用分层随机化法产生随机数字表并进行分组。对照组给予抗感染、增强免疫力、营养支持等治疗,此时升压药物根据MAP调整,使MAP>65mmHg,并给予相同剂量的安慰剂。治疗组除给予对照组相同治疗外,增加前列地尔10μg/d,根据MAP进行调整,使MAP>65mmHg。本实验采用双盲双模拟方法,即每位患者所用药品的外观及剂量在实验结束或紧急破盲时才能知晓。
1.2.2 监测指标 记录两组年龄、性别、APACHEⅡ评分、SOFA评分;分别于0、6、24、72h选取舌下3~4个点录制微循环图像,由操作熟练经验丰富的工作人员操作,录制稳定、清晰的微循环视频6段,时间为20s,并采用AVA 3.0软件进行图像数据分析处理,最终结果取平均值。记录两组患者0、1、3、7d的心率、MAP、CVP、乳酸(Lac)、尿量变化。记录两组患者机械通气(MV)的时间、ICU住院时间、总住院时间、住院病死率及28d病死率。相关分析指标为:舌下小血管总密度(total small vessel density,TVDs)、灌注小血管密度(perfused small vessel density,PVDs)、灌注小血管比例(proportion of perfused small vessels,PPVs)、微血管流量指数(microvascular flow index,MFI)、异质性指数(heterogeneity index,HI)。微循环定义参照文献[7]。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。所有数据进行正态性检验,正态分布的计量资料以表示,两组比较采用t检验;有时间因素影响的两组比较采用析因分析;计数资料以百分数表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 本研究共71例符合纳入条件,随机分为对照组(n=35)和治疗组(n=36),治疗2周时治疗组脱落率为11/36,6例因死亡脱落,5例因违反试验方案脱落,对照组脱落率为12/35,8例因死亡脱落,4例因违反试验方案脱落;最后共入组48例,对照组23例,治疗组25例。对照组男11例,女12例,年龄45.0±5.1岁;APACHE Ⅱ评分16.24±2.18,SOFA评分4.34±1.36。治疗组男13例,女12例,年龄45.0±8.9岁;APACHE Ⅱ评分16.56±1.72,SOFA评分4.67±1.43。两组性别、年龄差异均无统计学意义(P>0.05),用药前两组APACHE Ⅱ评分、SOFA评分差异亦无统计学意义(P>0.05,图1)
2.2 两组患者循环指标比较 与对照组比较,前列地尔组治疗0、1、3、7d患者心率、MAP未见明显变化(P>0.05),MVP明显降低(P<0.05),治疗1、3、7d时,尿量较入组时增多,治疗3、7d时与第1天比较明显增多(P<0.05,表1)。

图1 研究流程图Fig.1 Flow chart of research
表1 两组患者循环指标变化(±s)Tab.1 The changes of circulation indexes in the two groups of patients (±s)

表1 两组患者循环指标变化(±s)Tab.1 The changes of circulation indexes in the two groups of patients (±s)
HR. Heart rate; MAP. Mean arterial pressure; CVP. Central venous pressure; (1)P<0.05 compared with control group, (2)P<0.05 compared with 1d, (3)P<0.05 compared with 3d
Item 0d 1d 3d 7d HR (/min)Control 146.32±6.24 112.53±5.32 84.25±7.61 82.31±3.22 Treatment 148.28±5.30 108.34±4.81(1) 86.37±5.21(1)(2) 83.72±6 .21(1)(2)(3)MAP (mmHg)Control 61.32±5.21 67.45±7.34 73.34±3.33 84.52±5.21 Treatment 60.22±7.14 67.21±3.24(1) 74.22±3.42(1)(2) 84.13±6.67(1)(2)(3)CVP (mmHg)Control 5.21±1.23 16.32±3.27 12.02±3.16 7.36±3.14 Treatment 5.94±1.14 17.31±2.52(1) 12.52±2.82(1)(2) 7.03±2.91(1)(2)(3)Urine volume [ml/(kg.d)]Control 2.27±0.33 13.24±2.22 24.92±3.36 27.35±4.37 Treatment 3.44±0.15 14.51±3.35(1) 27.54±4.42(1)(2) 29.66±5.46(1)(2)(3)
2.3 两组患者微循环指标比较 治疗6、24、72h监测两组患者的舌下TvDs、PvDs、PPVs、MFI均较入组时(0h)上升,而且在治疗72h后前列地尔组监测上述各指标均较对照组明显升高(P<0.05);两组HI在治疗6、24、72h时均较入组时明显下降,且在治疗6、24、72h时前列地尔组明显低于对照组(P<0.05,表2)。
2.4 两组患者住院病死率、28d病死率、MV时间、ICU住院时间及总住院时间比较 治疗组住院病死率及28d病死率均低于对照组(P<0.05);治疗组MV时间为4.3±0.6d,明显低于对照组(P<0.05);治疗组ICU住院时间及总住院时间分别为7.8±0.8d、9.3±0.6d,明显短于对照组(P<0.05,图2、3)。
表2 两组患者微循环指标变化(±s)Tab.2 Comparison of microcirculation indexes between control group and treatment group (±s)

表2 两组患者微循环指标变化(±s)Tab.2 Comparison of microcirculation indexes between control group and treatment group (±s)
TVDs. Total small vessel density; PVDs. Perfused small vessel density; PPVs. Proportion of perfused small vessels; MFI. Microvascular flow index; HI. Heterogeneity index; (1)P<0.05 compared with 0h; (2)P<0.05 compared with 6h; (3)P<0.05 compared with 24h; (4)P<0.05 compared with control group
Item 0h 6h 24h 72h TVDs(mm/mm2)Control 25.37±0.62 25.77±0.62 26.74±0.76(1)(2) 27.71±0.64(1)(2)(3)Treatment 25.62±0.53 26.31±0.78(1)(4) 27.03±0.62(1)(2)(4) 30.31±0.51(1)(2)(3)(4)PVDs(mm/mm2)Control 33.14±0.57 33.12±0.67 34.07±0.36(1)(2) 34.47 ±0.52(1)(2)(3)Treatment 33.23±0.39 35.12±0.38(1)(4) 37.22±0.42(1)(2)(4) 39.13±0.67(1)(2)(3)(4)PPVs (%)Control 26.24±5.23 26.44±4.27 27.52±4.31(1)(2) 27.96±4.83(1)(2)(3)Treatment 25.98±5.37 26.71±4.19(1)(4) 27.82±5.04(1)(2)(4) 28.33±4.59(1)(2)(3)(4)MFI Control 3.31±0.24 3.42±0.26 4.02±0.32(1)(2) 5.22±0.38(1)(2)(3)Treatment 3.44±0.21 3.91±0.32(1)(4) 4.64±0.42(1)(2)(4) 5.78±0.46(1)(2)(3)(4)HI Control 0.0533±0.0642 0.0523±0.0154 0.0507±0.0211(1)(2) 0.0487±0.0261(1)(2)(3)Treatment 0.0603±0.0633 0.0514±0.0142(1)(4) 0.0487±0.0110(1)(2)(4) 0.0466±0.0243(1)(2)(3)(4)

图2 两组患者住院病死率及28d病死率比较Fig.2 Comparisons of in-hospital mortality and 28d mortality between the two groups
3 讨 论
脓毒性休克是指由微生物及其毒素等产物所引起的全身炎症反应伴休克,脓毒性休克感染灶中的微生物及其毒素、胞壁产物等侵入血循环,激活宿主的各种细胞和体液系统,产生细胞因子和内源性介质,作用于机体各种器官、系统,影响其灌注,导致组织细胞缺血缺氧、代谢紊乱、功能障碍,甚至多器官功能衰竭。脓毒性休克的根本原因在于血流的重新分布,使微循环血液减少,组织交换力下降,尤其是氧交换能力下降,使组织缺氧,从而引起各脏器功能衰竭。微循环是输送氧到局部组织并调节氧输送满足氧需求的重要器官,脓毒性休克时微循环障碍,血流下降,毛细血管分布不均一,导致氧输送不足、氧供需严重失衡,影响临床治疗疗效,最终可能导致多器官功能衰竭[8-9]甚至死亡等严重后果。因此如何改善脓毒性休克患者的微循环成为目前的研究热点。
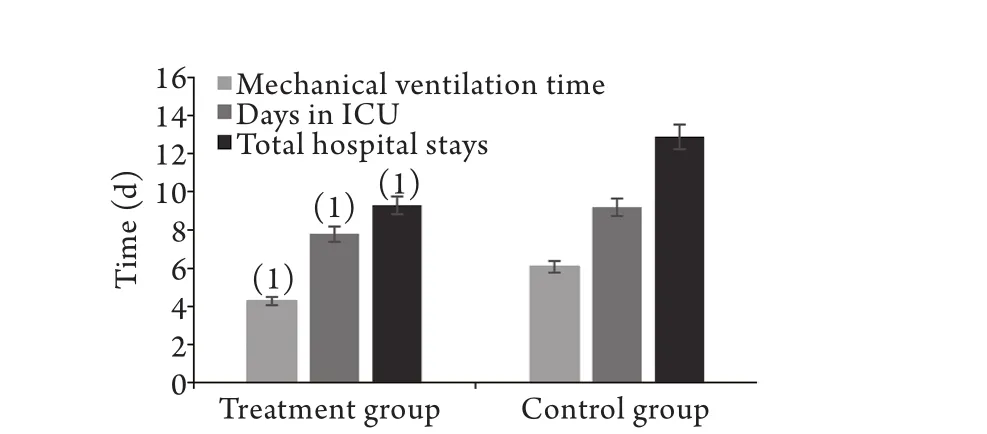
图3 两组患者MV时间、ICU住院时间及总住院时间Fig.3 Comparisons of mechanical ventilation time, days in ICU and total hospital stays between the two groups
前列地尔的主要成分为前列腺素E1(PGE1),后者是广泛存在于体内的生物活性物质,可改善血液动力学,通过增加血管平滑肌细胞内的CAMP含量,发挥其扩血管作用,降低外周阻力,扩张血管和提高血流量,改善微循环的灌注,并能扩张肾血管,增加肾血流量[10],具有利尿和保护肾脏功能的作用[11]。研究表明,前列地尔可以明显改善动脉波形,且并不影响心输出量和全身血管阻力[12]。前列地尔可使静脉扩张,因此降低了心脏充盈压,提高心肌灌注压,降低心肌氧耗[13]。本研究发现,前列地尔组患者在治疗24、72h时TvDs没有明显增加,而PvDs、PPVs、MFI、HI在治疗24、72h时较入组时及6h时明显升高,而且72h时前列地尔组明显高于对照组(P<0.05)。而对于大循环,前列地尔在治疗1、3、7d患者心率、MAP与对照组相比未见明显变化(P>0.05),CVP与对照组相比明显降低(P<0.05),而尿量在治疗1、3、7d较入组时提高,而治疗3、7d较1d明显升高(P<0.05)。
既往对于感染性休克的治疗研究主要集中于大循环的稳定,而关于改善微循环是否可以改善感染性休克患者预后的研究少见,本研究认为前列地尔可以使感染性休克患者的微循环得到很大改善,从而增加组织灌注,降低前列地尔组MV时间、入住ICU时间、总住院时间及病死率。
感染性休克患者给予前列地尔可以有效改善患者微循环,降低了MV时间、ICU停留时间及总住院时间,降低了病死率,改善了全身氧输送/氧耗平衡,使得大循环更易维持,这可能与前列地尔通过改善微循环,提高组织灌注有关。所以,临床上可尝试给予此类患者小剂量前列地尔维持辅助治疗。考虑到本研究为小样本研究,需要通过进一步更大规模的临床研究数据支持证实,同时需要进一步深入的研究探讨其具体机制。
【参考文献】
[1]Li WQ, Li JS. Developing the PLA critical care medicine is critical for advancing the level of battle wound treatment in the new er[J]. Med J Chin PLA, 2017, 42(2): 91-94. [李维勤, 黎介寿. 发展我军重症医学,提高新时期战伤救治水平[J]. 解放军医学杂志, 2017, 42(2): 91-94.]
[2]Singer M, Deutsehman CS, Seymour CW,et al. The third international consensus definitions for sepsis and septic shock(Sepsis 3)[J]. JAMA, 2016, 315(8): 801-810.
[3]Vincent JL, Sakr Y, Sprung CL,et al. Sepsis in European intensive care units:Resultsof the SOAP study[J]. Crit Care Med, 2006,334(2): 344-353.
[4]Liu LP, Hu SW, Shuai DK,et al. Clinical effect of alprostadil in patients with septic shock associated with acute respiratory distress syndrome[J]. Med J Chin PLA, 2017, 42(9): 805-809.[刘丽平, 胡生文, 帅佃奎, 等. 前列地尔对感染性休克合并急性呼吸窘迫综合征患者的临床疗效观察[J]. 解放军医学杂志, 2017, 42(9): 805-809.]
[5]Seymour CW, Liu VX, Washyna TJ,et al. Assessment of clinical criteria for sepsis for the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis 3)[J]. JAMA,2016, 315(8): 762-774.
[6]Bone RC, Balk RA, Cerra FB,et al. American College of Chest Physicians Society of Critical Care Medicine Consensus Conference: Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J]. Crit Care Med, 1992, 20(6): 864-874.
[7]Thooft A, Favory R, Salgado DR,et al. Effects of changes in arterial pressure on organ perfusion during septic shock[J]. Crit Care, 2011, 15(5): 222.
[8]Blanco J, Muriel-Bombín A, Sagredo V,et al. Incidence, organ dysfunction and mortality in severe sepsis: A Spanish multicenter study[J]. Crit Care, 2008, 12(6): R158.
[9]Rivers E, Nguyen B, Havstad S,et al. Early good-directed therapy in the treatment of severe sepsis and septic shook[J]. N Engl J Med, 2001, 345(1): 41-42.
[10]Nicholls K. Diabetic nephropathy--how might we prevent, retard,or cope with it[J]. Aust Fam Physician, 2005, 34(11): 933-936.
[11]Dolegowska B, Pikula E, Safranow K,et al. Metabolism of eicosanoids and their action on renal function during ischaemia and reperfusion:the effect of alprostadil[J]. Prostaglandins Leukot Essent Fatty Acids, 2006, 75(6): 403-411.
[12]Rauch H, Motsch J, Bottiger BW. Newer approaches to the pharmacological management of heart failure[J]. Curr Opin Anaesthesiol, 2006, 19(1): 75-81.
[13]Newman JH, Fanburg BL, Archer SL,et al. Pulmonary arterial hypertension[J]. Circulation, 2004, 109(24): 2947-2952.

