下咽部鳞状细胞癌患者人乳头瘤病毒感染及p53蛋白表达的检测分析
魏炜 宋蕴韬 徐国辉 肖康 石琦
100142北京大学肿瘤医院暨北京市肿瘤防治研究所头颈外科恶性肿瘤发病机制及转化研究教育部重点实验室(魏炜、宋蕴韬、徐国辉);102206北京,中国疾病预防控制中心病毒病预防控制所传染病预防控制国家重点实验室(肖康、石琦)
头颈部肿瘤(head and neck cancer,HNC)是世界上最常见的第六大肿瘤,每年大约有600 000例新确诊病例。90%以上HNC为鳞状细胞癌,主要包括唇、口腔、鼻咽、口咽、下咽和喉癌。传统观念认为HNC发病与吸烟及饮酒有关。最近研究发现人乳头状瘤病毒(human papillomavirus,HPV)感染与HNC发病密切相关[1]。下咽鳞状细胞癌(hypopharynx squamous cell carcinoma),是原发于下咽部的恶性肿瘤,其以鳞状细胞癌为主(95%以上),易发部位从高到低依次为梨状窝、环后区、咽后壁[2]。下咽癌发病率较低,虽然各国存在较大差异,但总体年发病率仅约为0.17~0.80/10万,占头颈部恶性肿瘤的1.4%~5.0%,占全身恶性肿瘤的0.2%~0.3%。虽然其发病率并不高,但早期发病往往没有明显症状,待症状明显时往往已经进入中晚期,且浸润性较强,恶性程度较高,半数下咽癌确诊时已有淋巴结转移,是头颈外科中预后差的恶性肿瘤之一。而且下咽癌死亡率较高,5年生存率仅有30% ~50%[3]。本研究采用Luminex及PCR杂交技术以及免疫组织化学方法检测下咽部鳞状细胞癌组织中的HPV的感染率以及类型,同时检测p53蛋白表达及突变的情况,为进一步阐明下咽癌的发病机制提供依据。
1 材料方法
1.1 资料来源15例病例均来自北京肿瘤医院头颈外科2008—2011年收集的下咽癌患者标本。
1.2 样本DNA提取参照文献从肿瘤组织的石蜡包埋标本中切取5片10μm厚的切片,放入管中加入1 ml的二甲苯,室温振荡浸泡2 h。之后将溶解的样品放入带有滤膜的离心管中,离心后再加入1 ml的乙醇震荡混匀洗去杂质,离心后按照试剂盒(德国Qiagen公司)的操作说明进行样本DNA的提取,最终将样品DNA溶解于50μl的体积中,-20℃备用[4]。
1.3 HPV DNA Luminex检测应用HPV DNA分型测定试剂盒(TellgenplexTMHPV DNA检测试剂盒)检测样本组织中提取的DNA是否存在HPV的感染。此试剂盒应用Luminex技术,可以检测样本中19 种高危型 HPV 类型(HPV-16、18、26、31、33、35、39、45、51、52、53、55、56、58、59、66、68、82 及 83)及7 种低危型 HPV 类型(HPV-6、11、40、42、44、61及73)的存在。具体步骤如下,取2μg提取的DNA进行PCR杂交反应,条件为95℃ 30 s,58℃ 30 s及72℃ 30 s进行最初的5个循环,之后95℃ 30 s,55℃ 30 s及72℃ 30 s进行第二轮的35个循环。以此PCR产物进行快速杂交反应后应用Bio-Plex200系统进行Lunimex结果的检测,对HPV的感染类型进行检测,并且应用TellgenplexTM公司相应的试剂盒数据分析软件进行数据分析[5]。
1.4 高危型HPV16/18 PCR检测以及p53基因检测及测序分析以样本提取的DNA为模板对HPV16、18型进行两轮PCR检测。引物序列分别为HPV16-1(5’-GCAAGCAACAGTTACTGCGA-3’)及P16-2 (5 ’-CAACAAGACATACATCGACC-3 ’);HPV18-1(5’-CACTTCACTGCAAGACATAGA-3’)及P18-2(5’-GTTGTGAAATCGTCGTTTTTCA-3’)。 第一轮PCR条件:1.0μg DNA作为模板,1μmol/L的上下游引物及1.25 U Pfu DNA聚合酶,共25μl体系;反应条件:94℃ 60 s,57℃ 60 s及72℃ 60 s,共30个循环,之后72℃ 延伸10 min。第二轮PCR条件:第一轮产物取5μl作为模板,10μmol/L的上下游引物及1.25 U Pfu DNA聚合酶,共25μl体系;反应条件:94℃ 60 s,52℃ 60 s,72℃ 60 s,共40个循环,之后72℃ 延伸10 min。PCR反应严格在PCR实验室分区操作,以240 bp大小的actin作为参照。HPV DNA的PCR产物以2%的琼脂糖凝胶进行分析并且用凝胶回收试剂盒对目的片段进行回收。以相同的引物,应用ABI PRISMTM3730XL大型DNA测序仪进行序列测定分析。
p53的5-8外显子应用传统的PCR方法进行扩增。在50μl扩增体系中包括1μl的DNA模板、20pmol的上下游引物、25μl的PCR Mix以及21μl无RNA酶的水。PCR的反应条件如下:95℃ 30 s,65℃ 退火45 s,之后每循环降低1℃,55℃进行35个循环,最后72℃延伸45 s。所有的PCR实验都在专用的PCR实验室中进行,避免DNA的污染[6]。
1.5 HPV16/18E6蛋白及p53蛋白免疫组织化学检测石蜡包埋的病变部位组织块切成5μm厚的切片,按下列步骤处理:切片在二甲苯中脱蜡5 min并逐渐进行水化,3%H2O2-甲醇处理15 min以除去内源性过氧化物酶。在酶消化进行抗原暴露和修复后切片用1%正常羊血清封闭20 min,然后将HPV16/18E6单克隆抗体(Abcam公司)或者p53非磷酸化单克隆抗体(Novus公司)按1∶500稀释在4℃作用过夜,然后与1∶1000稀释的辣根过氧化物酶结合的羊抗鼠二抗室温作用1 h,DAB显色。切片用苏木素复染、脱水以及用封片剂进行封片观察。
2 结果
2.1 患者HPV DNA的检测结果经过26种型别HPV基因Luminex检测,发现2例同时出现HPV16/18感染阳性的病例,未发现低危型HPV病毒的感染。通过二轮PCR的检测,1例病例出现HPV18感染阳性,3例病例出现HPV16感染阳性,经测序比对分析序列正确,基因检测的阳性率为40.0%(6/15)。
2.2 患者HPV蛋白表达的检测结果经HPV16/18E6蛋白抗体进行免疫组织化学检测,在15例病例中发现2例HPV感染阳性,检测阳性率为13.3%(2/15)。在免疫组织化学的检测中可以观察到病变组织的鳞状上皮中有棕色的阳性颗粒出现,为表达的HPV16/18E6蛋白(见图1)。综合HPV基因及蛋白检测结果,15例下咽癌患者中HPV基因及蛋白检测总阳性率达到46.7%(7/15)。
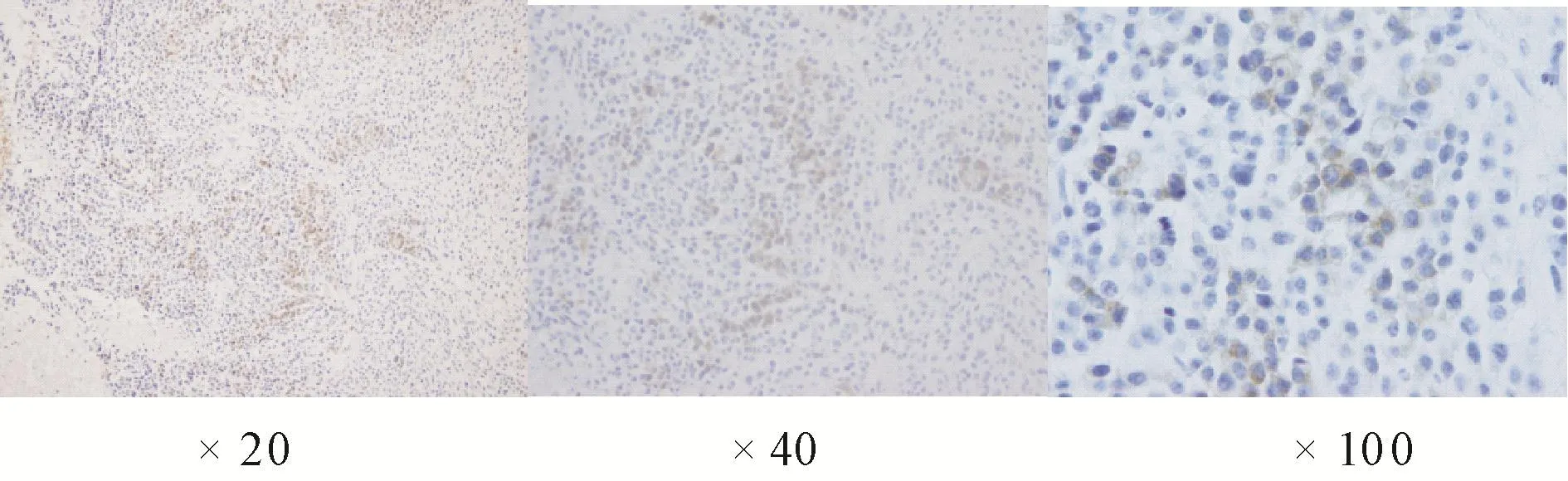
图1 下咽部鳞状细胞癌组织HPV16/18E6抗原蛋白的免疫组织化学染色(×20/×40/×100)Fig.1 Immunohistochemistry assays of HPV16/18E6 proteins in the tissues from patients with hypopharynx squamous cell carcinoma(×20/×40/×100)
2.3 患者病理分级及HPV感染阳性率在15例下咽癌病例中,高分化的病例有4例,其中2例为HPV阳性,阳性率50.0%;中分化的病例有7例,其中5例为HPV阳性,阳性率71.4%;低分化的病例有4例,未发现HPV检测阳性病例。
2.4 患者临床分级及HPV感染阳性率在15例下咽癌病例中,1例为临床分级I级,为HPV感染阳性病例;7例为临床分级II级,其中3例为HPV感染阳性,占到42.9%;6例为临床分级III级,其中2例为HPV感染阳性,占到33.3%;1例为临床分级IV级,为HPV感染阳性病例。
2.5 患者的性别、年龄分布,是否吸烟、喝酒及淋巴结转移情况在15例下咽癌病例全部都是男性,其中HPV阳性患者及全部病例的年龄中位数分别为58岁/60岁;在7例HPV阳性的下咽癌患者中,全部具有吸烟史,占到100%(7/7);5例具有饮酒史,占到71.4%(5/7);3例具有淋巴结转移,4例没有淋巴结转移。
2.6 患者p53蛋白表达及其基因突变情况p53蛋白在肿瘤组织中的表达通过免疫组织化学的方法来检测,棕色的阳性颗粒主要分布在恶性细胞的细胞核(见图2)。在下咽癌的15份标本中,6份为阳性标本,占到病例数的40.0%(6/15)。另外,在15例下咽癌患者中通过PCR的方法发现9例患者存在p53基因突变,占到60.0%(9/15),其中在外显子5出现突变的有2例病例,在外显子6出现突变的有1例病例,在外显子7出现突变的有2例病例,在外显子8出现突变的有3例病例,另外有1例病例在外显子6和7同时出现突变。
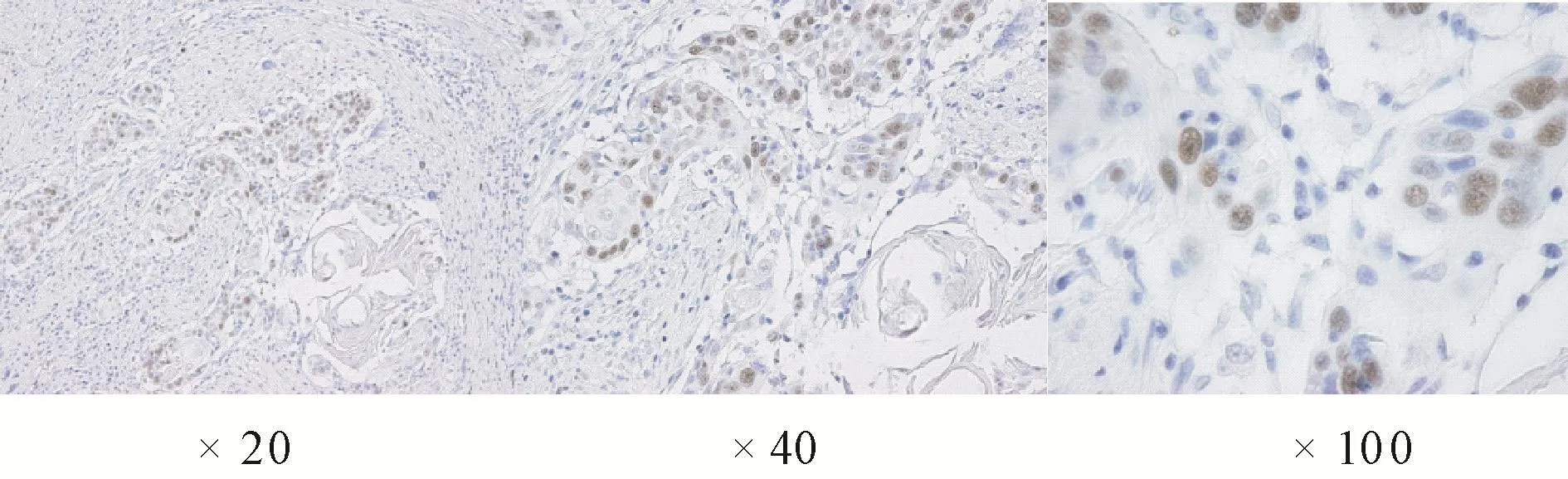
图2 下咽部鳞状细胞癌组织p53蛋白的免疫组织化学染色(×20/×40/×100)Fig.2 Immunohistochemical assays of p53 suppressor proteins in the tissues from patients with hypopharynx squamous cell carcinoma(× 20/×40/×100)
3 讨论
HPV是一种具有高度组织亲嗜性,主要侵犯人类皮肤及黏膜鳞状上皮的病毒,迄今共发现有200多种病毒亚型,根据致病力划分为低危型和高危型两大类。其中高危型HPV能使鳞状细胞无限增殖进而癌变,所致肿瘤有宫颈癌、外阴癌、头颈部肿瘤等,代表亚型有 HPV16、18、31、33 等[7]。 目前还没有一种被认为是HPV检测的标准方法,但PCR方法是应用最多的HPV检测方法,它是通过扩增标本中的HPV DNA片段来达到检测目的,具有非常高的灵敏性,最少能检测到1拷贝HPV DNA细胞水平,然而一般PCR不能判断HPV DNA是来自标本中的肿瘤组织还是肿瘤周围的间质组织,也不能判断HPV DNA在宿主细胞中的部位和状态,由于PCR对HPV DNA部位和状态判断的低特异性以及假阳性限制了PCR为HPV检测的标准方法[8]。因此在本研究中,同时应用PCR方法对HPV基因以及免疫组织化学方法对HPV表达的蛋白进行检测,提高HPV病毒检出率。
p53基因,一种肿瘤抑制基因,在细胞面对各种外界刺激包括凋亡、周期变化、衰老、DNA修复、细胞代谢及自噬过程中都起着重要的作用。p53功能的丧失及突变在很多肿瘤的发生中都导致了p53活性及增殖活性的下降以及无限制的生长。人类肿瘤中大多数p53的突变都是错义突变,并且集中在5~8外显子上。在很多病例中,这些突变可以引起抑癌功能的丧失或者引起癌基因功能的获得。本课题组之前对喉癌病例的研究中发现了p53蛋白的过表达,因此,在本研究中也通过PCR的方法对p53的突变进行了检测,同时应用免疫组化的方法对p53蛋白的表达进行检测[9],出现了40%的蛋白阳性率以及60%的基因突变率。
在头颈部肿瘤中,HPV不同的暴露机会可能会导致感染率的不同。HPV通过口腔黏膜进行传播的确切机制还不清楚,但是皮肤与皮肤之间的直接接触被认为是必须的条件[10]。同时,头颈部肿瘤发生的部位和HPV的感染率可能也有一定的关系[11]。国外学者报告下咽鳞状细胞癌中也有一定的HPV检出率,但研究不多,结果差异大,目前缺乏统一的结论,且有效病例较少[12]。而我国人群的大样本量报道很少,报道病例研究资料不足。在协和医院对14例下咽癌患者HPV检测结果中,HPV的感染率为57.1%[12-13],与本研究组的结果相近。在本研究的15例下咽癌病例中,HPV感染阳性率为46.7%,阳性率较高,与本实验中应用了3种方法对HPV的感染进行检测有关,不同的方法敏感性不同,对HPV病毒的基因和表达蛋白同时检测提高了检测的灵敏性。但由于样本量较少,也未发现HPV的感染与是否具有淋巴结转移有关。在应用PCR方法以及Luminex方法对HPV感染的类型进行检测的结果发现,HPV感染的类型均为高危型的HPV16或者HPV18,有2例病例同时出现了HPV16及HPV18的感染,与近期的报道结果相一致。在本研究中,未发现下咽癌的发生与患者的临床分级、病理分级、是否吸烟饮酒以及是否具有淋巴结转移具有相关性。有待于在下一步的研究中,继续扩大样本量,进一步研究HPV感染与非感染的下咽癌患者之间的生存率的差异。
利益冲突无

