柯萨奇病毒A6型VP1和VP2基因的原核表达及多克隆抗体制备
陈静 李鹏飞 吴杰 孟胜利 申硕 王泽鋆
443002宜昌,三峡大学医学院(陈静);430207武汉生物制品研究所病毒性疫苗研究一室(陈静、李鹏飞、吴杰、孟胜利、申硕、王泽鋆)
手足口病(hand,foot and mouth disease,HFMD)是全球性传染病,以婴幼儿发病为主。根据中国疾病预防控制中心数据显示,自2009年以来,每年HFMD报告病例数均在100万以上,发病数和死亡人数在丙类传染病中一直居第一,严重威胁儿童生命健康。引起HFMD的病毒属于小RNA病毒科(Picornaviridae)肠道病毒属,包括柯萨奇病毒(Coxsackie virus)A 组的 2、4、5、6、7、9、10、16 型等,B 组的1、2、3、4、5、13 型等,肠道病毒71 型(human enterovirus 71,EV71),埃可病毒(echo viruses)等[1-2]。2013年以前,EV71和CVA16是 HFMD的主要病原体[3]。近几年,CVA6感染病例数急速上升,甚至在我国多地替代EV71或CVA16成为引起HFMD暴发的主要病原体[4-8]。因此,CVA6已成为继EV71和CVA16后,最值得关注的引起HFMD的肠道病毒病原体,但是目前关于CVA6的研究报道较EV71和CVA16少,用于CVA6抗原检测的抗体等试剂缺乏。
CVA6为无包膜,正二十面体衣壳,单股正链RNA病毒,基因全长约7.4 Kb,两端为保守的非编码区,中间为编码区。编码区编码的病毒结构蛋白有4种,即VP1~VP4,VP4位于病毒粒子外壳的内侧与病毒核心紧密连接,VP1、VP2和VP3裸露于病毒颗粒的表面,包含了主要的抗原决定簇。本研究选择了CVA6的VP1和VP2片段,将CVA6-VP1和CVA6-VP2基因分别整合入pGEX-6p-1载体,然后导入大肠埃希菌BL21(DE3)菌株,IPTG诱导表达出GST融合蛋白,用作抗原免疫家兔后,获得兔抗血清,并进行了鉴定,为进一步研究CVA6提供抗原检测试剂和方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂:限制性内切酶、T4 DNA连接酶等购自NEB公司;蛋白预染Marker、FITC标记羊抗兔IgG购自Thermo公司;硝酸纤维素膜购自Pall公司;完全弗氏佐剂、不完全弗氏佐剂购自Sigma公司;HRP标记的羊抗兔IgG购自博士德公司;HRPDAB显色试剂盒,逆转录试剂盒、质粒提取试剂盒、DNA分子量标准品购自TaKaRa公司;RNA提取试剂盒、琼脂糖凝胶回收试剂盒购自Qiagen公司;PrimeScriptTMII 1st Strand cDNA Synthesis Kit,购自TaKaRa公司;Premix TaqTM(LA TaqTMVersion 2.0 plus dye)购自TaKaRa公司;其他常规试剂均为进口或国产分析纯试剂。
1.1.2 菌株、质粒与毒株:感受态细胞E.coliDH5α和表达菌株E.coliBL21(DE3)由本实验室保存;质粒pGEX-6p-1为本实验室保存;CVA6病毒样颗粒(virus-like particles,VLPs)由本课题组制备纯化(数据未发表);CVA6原型株Gdula购自ATCC。
1.1.3 实验动物:新西兰大白兔,雄性,2.0~2.2 Kg,由武汉生物制品研究所有限责任公司动物室提供。
1.1.4 细胞:人恶性胚胎横纹肌瘤细胞(human Rhabdomyosarcoma,RD)由本实验室保存。
1.2 方法
1.2.1 目的片段的扩增:以CVA6中国湖北分离株(序列未发表)VP1和VP2片段序列设计上下游扩增引物,并委托生工生物工程(上海)股份有限公司合成,引物序列如下:VP1上游引物 F:5′-CCGGAA TTCAATGATCCCATTACAAATGCAG-3′,VP1 下游引物 R:5′-CCGCTCGAGTTAAGATGTCCTTTGTGGGTT TGC-3′;VP2 上游引物 F:5′-CCGGAATTCTCCCCTTC TGTTGAGGCGTGC-3′,VP2 下游引物 R:5′-CCGC TCGAGTTATTGTTTTATTGCTTGTCGGAG-3′。 其 中上游引物含EcoRI酶切位点,下游引物含XhoI酶切位点。按照试剂盒步骤操作,提取CVA6病毒核酸RNA,按照PrimeScriptTMII 1st Strand cDNA Synthesis Kit说明,以RNA为模板合成第一链cDNA。然后以cDNA为模板,F、R为引物进行 PCR扩增,50μl PCR 反应体系为:dd H2O 22μl、2×Premix LA Taq 25 μl、引物 F 1 μl、引物R 1 μl、cDNA(≥50 ng/μl)1μl。反应条件为:94℃ 预变性4 min,94℃ 30 s、50℃30 s、72℃ 1 min,共35个循环,最后延伸72℃7 min。获得目的片段后,将条带大小正确的PCR回收产物及测序引物送至生工生物工程(上海)股份有限公司进行测序鉴定。
1.2.2 重组表达载体的构建和鉴定:PCR产物和pGEX-6p-1载体分别经EcoRI和XhoI限制性内切酶进行双酶切,产物经1%琼脂糖凝胶电泳分离条带后切胶回收,回收的目的基因与pGEX-6p-1载体连接后转化感受态细胞E.ColiDH5α,获得的重组质粒pGEX-6p-1-CVA6-VP1和pGEX-6p-1-CVA6-VP2经双酶切和PCR鉴定后,送生工生物工程(上海)有限公司测序。
1.2.3 融合蛋白的诱导表达:将重组质粒转化感受态细胞E.ColiBL21(DE3),菌落PCR挑选阳性克隆,提取质粒测序鉴定。将含重组质粒的菌株E.ColiBL21(DE3)接种至5 ml含100μg/ml Ampicillin的液体LB培养基中,于37℃,200 rpm的恒温摇床上振荡培养至A450值为0.6~0.8(约2 h),取1 ml菌液作为诱导前对照,其余4 ml菌液中加入IPTG至其终浓度为0.5 mmol/L,继续培养4~5 h,取0.5 ml菌液做诱导后分析。5 000×g,室温离心1 min收集诱导前后菌体,加入ddH2O重悬菌体,与SDSloading buffer混匀,在100℃恒温金属浴中加热10 min,短暂离心,进行SDS-PAGE,判断融合蛋白表达情况。
1.2.4 融合蛋白的纯化及鉴定:将阳性表达菌株扩大培养,6 000×g离心15 min收集诱导表达后的菌体沉淀,加入预冷的0.01 mol/L PBS重悬后放置于超声细胞破碎机进行超声裂解。裂解液于6000×g离心分离上清和沉淀,分别取样分析目的蛋白的表达量及表达形式。判断GST-VP1和GST-VP2融合蛋白为非可溶性蛋白后,采用蛋白电泳,切胶回收目的蛋白,以恒流10mA/管,电洗脱纯化目的融合蛋白,SDS-PAGE电泳,染色,脱色后通过灰度扫描软件Quantity One对目的蛋白作初步定量分析和纯度分析。蛋白洗脱液在1~2 L 0.01 mol/L PBS中4℃透析24 h,去除SDS等杂质,PBS更换至少3次,透析后的蛋白用作免疫抗原。
1.2.5 多克隆抗体的制备:将纯化后的GST-VP1和GST-VP2以0.6 mg/只抗原量分别免疫家兔,通过皮下多点注射方式进行免疫。免疫前通过耳动脉采血5 ml,37℃放置2 h,2 000×g,4℃离心20 min之后分离血清,作为阴性对照。抗原辅以等体积弗氏完全佐剂(FCA)混合乳化后进行初免,7 d后辅以弗氏不完全佐剂(FICA)加强免疫,之后每隔14 d辅以FICA加强,一共免疫5针。第4针结束后以Western blot(WB)对血清效果进行鉴定。最后一次加强免疫10 d后对家兔进行颈动脉采血,离心分离血清,分装后于-20或-80℃保存。
1.2.6 WB检测:将菌株 BL21(DE3)表达产物、CVA6病毒收获液或CVA6 VLPs经12%SDS-PAGE电泳后,通过电转印仪将蛋白条带转至硝酸纤维素膜上,用 PBST洗膜3次,将膜置于含1%BSA的PBST缓冲液,室温1 h封闭,加入抗CVA6-VP1或抗CVA6-VP2兔抗血清,室温温和振荡1 h,PBST洗膜3次,加入HRP标记羊抗兔IgG抗体(1∶2000稀释),室温孵育1 h,PBST洗膜3次,DAB显色液显色。
1.2.7 间接免疫荧光试验(indirect immunofluorescence assay,IFA):以1×105/ml的密度在6孔板中加入细胞,2 ml/孔。37℃,5%CO2培养24 h。移除旧培养基,加入1 ml的0.01 mol/L PBS漂洗2次,每孔加入2 ml细胞维持液。取适量病毒收获液上清接种于6孔板,保留未接种病毒的细胞孔作为阴性对照,37℃,5%CO2培养48 h。移除旧的培养基,每孔加入PBS-4%多聚甲醛,室温固定30 min;移除多聚甲醛,以0.01 mol/L PBS漂洗3次。加入透化封闭液,室温反应30 min;移除透化封闭液,PBS洗3次,加入稀释的抗CVA6-VP1或抗CVA6-VP2兔抗血清,室温孵育1 h;移除一抗,PBS洗3次,加入G488-驴抗兔二抗(1∶500),37℃避光孵育1 h;移除二抗,PBS洗3次,以荧光倒置显微镜观察结果并拍照保存结果。
2 结果
2.1 pGEX-6p-1表达载体的构建通过逆转录PCR扩增CVA6-VP1全长基因编码区(915 bp)和CVA6-VP2全长基因编码区(789 bp)),分别将其插入表达载体 pGEX-6p-1。重组质粒经 PCR和EcoRI、XhoI双酶切鉴定正确。将鉴定正确的质粒进行测序,序列正确的重组质粒命名为pGEX-6p-1-CVA6-VP1和pGEX-6p-1-CVA6-VP2,以上载体质粒表达后,GST蛋白融合在各个病毒目的蛋白的N末端。
2.2 GST-VP1和GST-VP2融合蛋白的表达与纯化将表达CVA6-VP1或CVA6-VP2的pGEX-6p-1载体转化至E.ColiBL21(DE3),挑取单个菌落培养,以IPTG诱导,分别收集诱导前后菌体并制备细菌裂解液。以SDS-PAGE对蛋白表达情况进行分析。由于GST蛋白标签本身相对分子质量约25×103,因此融合蛋白GST-VP1和GST-VP2相对分子质量约55×103。如图1A所示,诱导后样品在预期位置可观察到清晰的条带,而未诱导的样品在相应位置没有大量的蛋白表达。超声波破碎菌体后,分别收获裂解液上清及沉淀进行SDS-PAGE电泳(图1B),分析结果表明重组蛋白主要存在于破菌沉淀中,以包涵体形式存在。通过大型SDS-PAGE制备电泳分离目的蛋白并进行切胶回收纯化,最终获得用于抗体制备的重组VP1和VP2蛋白。
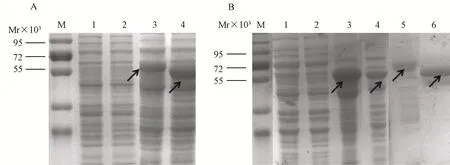
注:M:蛋白质markers;(A)1-2:含重组质粒的未诱导菌液(1:GST-VP1,2:GST-VP2);3-4:含重组质粒的IPTG诱导菌液(3:GST-VP1,4:GST-VP2);(B)1-2:诱导菌液超声破碎离心后的上清(1:GST-VP1,2:GST-VP2);3-4:诱导菌液超声破碎后离心的沉淀(3: GST-VP1,4:GST-VP2);5-6:纯化后的融合蛋白(5: GST-VP1,6:GST-VP2)图1 GST-VP1和GST-VP2表达产物的SDS-PAGE分析Note:M: protein markers;(A)Medium of BL-21(DE3)with pGEX-6p-1-CVA6-VP1 and pGEX-6p-1-CVA6-VP2 before(1,2)and after(3,4)induction,respectively;(B)1-2: The supernatants of cell lysates withpGEX-6p-1-CVA6-VP1 and pGEX-6p-1-CVA6-VP2 induced,respectively;3-4: The pellets of cell lysates with pGEX-6p-1-CVA6-VP1 and pGEX-6p-1-CVA6-VP2 induced,respectively; 5-6: the purified fusion protein: GST-VP1 and GST-VP2,respectivelyFig.1 Analysis of GST-VP1 and GST-VP2 fusion proteins by SDS-PAGE
2.3 WB鉴定多克隆抗体将抗CVA6 VP1或CVA6 VP2 抗血清分别以1∶1 000、1∶2 000、1∶4 000及1∶8 000倍比稀释作为一抗,每泳道以2μg纯化的融合蛋白为检测对象,进行 WB分析。结果表明抗血清在相对分子质量55×103附近能检测到符合预期大小的条带,抗血清稀释度达到1∶8 000时检测结果仍为阳性。
为了检测制备的抗CVA6 VP1和CVA6 VP2抗血清的特异性,首先以CVA6原型株Gdula在RD细胞上培养后的病毒收获液为抗原,未感染病毒的RD细胞培养上清为阴性对照抗原。抗CVA6 VP1和抗CVA6-VP2兔抗血清均按1∶3 000稀释进行WB。结果表明,抗CVA6 VP1兔抗血清与CVA6病毒蛋白能反应,在VP1蛋白相应位置(相对分子质量35×103)附近有明显条带;同样抗CVA6-VP2兔抗血清也能与CVA6病毒蛋白反应,在VP0蛋白(VP2+VP4)相应位置(相对分子质量38×103)和VP2蛋白相应位置(相对分子质量28×103)附近均有明显条带,而未感染细胞的泳道未出现相应条带。
进一步将实验室纯化后的CVA6 VLPs通过SDS-PAGE电泳和WB进行分析,SDS-PAGE电泳结果可见3条清晰条带,和VP0、VP1、VP3位置相当,相对分子质量分别约为38×103、35×103、26×103(图2A)。同时通过WB检测VLPs的蛋白表达情况,用抗CVA6-VP1和抗CVA6-VP2兔抗血清作为一抗,图2B结果显示,表达蛋白和多抗均有特异性反应,抗CVA6-VP1兔抗血清与CVA6 VLPs在VP1蛋白相应位置(相对分子质量35×103)附近有明显条带;抗CVA6-VP2兔抗血清与CVA6 VLPs在VP0蛋白(VP2+VP4)相应位置(相对分子质量38×103)有明显条带。以上结果表明所制备的多克隆抗体具有良好的特异性。
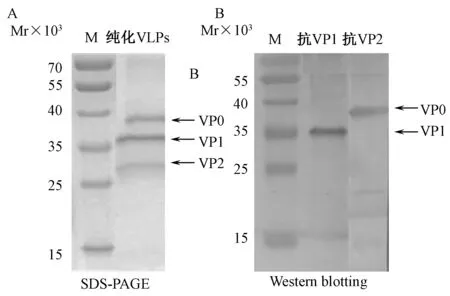
注:M. 蛋白质 markers;A.SDS-PAGE 结果;B.Western blot结果,一抗:抗CVA6-VP1或抗CVA6-VP2兔抗血清1∶3000稀释图2 纯化CVA6 VLPs病毒蛋白的SDS-PAGE和Western blot检测Note:M.Protein markers; A.SDS-PAGE profile; B.Western blot results,Rabbit anti-CVA6-VP1 or anti-CVA6-VP2 antiserum was used at a dilution of 1∶3000,respectively.Fig.2 Detection of viral proteins in purified CVA6 VLPs by SDS-PAGE and Western blot
2.4 IFA鉴定多克隆抗体CVA6(Gdula株)接种RD细胞,培养48 h后固定细胞,将抗CVA6 VP1和CVA6 VP2抗血清作为一抗进行IFA,抗血清分别以1:50、1∶100、1∶200 及 1∶400 倍比稀释,结果感染CVA6的RD细胞有明显的绿色荧光信号,抗血清稀释度达到1∶400时检测结果仍为阳性,而未感染CVA6的RD细胞则没有绿色荧光信号(图3为抗血清稀释1∶100时,为适宜的IFA使用效价)。IFA结果表明抗CVA6-VP1和抗CVA6-VP2多克隆抗体均可特异性识别天然的CVA6抗原。
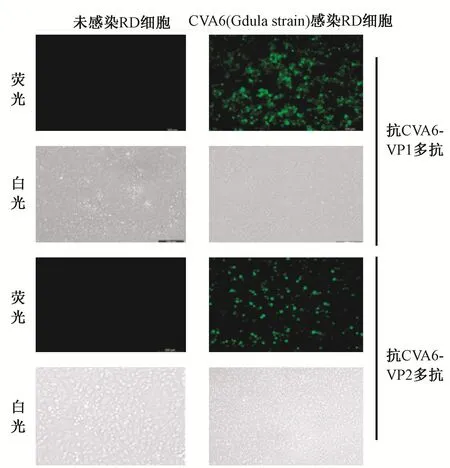
注:对感染或未感染CVA6 48 h后的RD细胞进行IFA;一抗:兔抗CVA6-VP1和CVA6-VP2多抗,1∶100稀释图3 抗CVA6-VP1和抗CVA6-VP2多克隆抗体的间接免疫荧光试验鉴定Note:Indirect immunofluorescence assay using rabbit anti-CVA6-VP1 or VP2 antiserum against mock-infected and infected RD cells(rabbit antiserum at a dilution of 1∶100).Fig.3 Analysis of anti-CVA6-VP1 and anti-CVA6-VP2 polyclonal antibody by indirect immunofluorescence assay
3 讨论
近年来CVA6引起的HFMD发病率正逐年持续升高。自2008年芬兰开始,在欧洲、美洲、亚洲多个国家和地区都有CVA6相关HFMD的暴发流行[9-14]。尤其值得关注的是,CVA6引起的HFMD易发生非典型性皮疹和脱甲症,且呈现成人发病率高和冬季发病的特点[15-17],称为非典型HFMD。成熟CVA6感染性病毒颗粒由VP1、VP2、VP3和VP4蛋白组成,在病毒的装配过程中,VP2和VP4由前体蛋白VP0裂解而来。CVA6病毒颗粒主要存在两种形态,空心颗粒(empty particle,EP)由蛋白VP0、VP1、VP3组成,实心颗粒(full particle,FP)由结构蛋白VP1、VP2、VP3和VP4组成,所以VP2是区别EP和FP的重要蛋白。而VP1是肠道病毒重要的衣壳蛋白,含有细胞受体分子结合位点,可能存在多个中和抗原表位区域,是药物作用、免疫诊断和疫苗研制的靶蛋白。但目前关于CVA6的研究较少,市场上也没有CVA6抗体,因而本研究制备VP1和VP2多克隆抗体为CVA6的相关研究提供工具和方法。
本研究将CVA6 VP1和VP2基因分别整合入pGEX-6p-1载体,然后导入大肠杆菌BL21-DE3菌株,IPTG诱导表达出GST融合蛋白,其主要以包涵体形式存在于细胞内,纯化后获得的高纯度蛋白作为抗原免疫家兔后,制备的抗 CVA6-VP1和抗CVA6-VP2兔抗血清经WB和IFA鉴定,证明可以检测到CVA6-VP1或CVA6-VP2蛋白,并且兔抗血清WB的效价达1∶8000以上,IFA的效价达1∶400以上。
WB鉴定抗血清时,本研究首先用CVA6原型株Gdula在RD细胞上培养后的病毒收获液为抗原,以未感染病毒的RD细胞培养上清为阴性对照抗原,结果发现抗CVA6 VP1和抗CVA6 VP2兔抗血清均能与CVA6病毒收获液的蛋白反应,分别在VP1、VP0(VP2+VP4)和VP2蛋白相应位置有明显条带,而未感染细胞泳道未出现相应条带,初步表明制备的抗血清能检测到CVA6 VP1或VP2、VP0蛋白。但病毒收获液中的蛋白成分复杂,为了进一步确认抗血清识别的蛋白,本研究将实验室纯化后的CVA6 VLPs同时进行SDS-PAGE和WB分析,本实验用到的CVA6 VLPs是利用Bac-to-Bac昆虫杆状病毒表达系统,将含有CVA6病毒结构蛋白基因P1和蛋白酶基因3CD的重组杆状病毒质粒pBacmid-P1-3CD转染sf9昆虫细胞,获得重组杆状病毒rBac-CVA6-P1-3CD,再利用重组杆状病毒感染sf9昆虫细胞,收获上清,鉴定后对其进行纯化,最终获得CVA6 VLPs,其SDS-PAGE结果说明P1前体蛋白被3CD作用切割产生了 VP0(VP2+VP4)、VP1和VP3,同时结合WB检测进一步证明本研究制备的抗CVA6-VP1抗血清能检测到CVA6-VP1蛋白,抗CVA6-VP2兔抗血清能检测到CVA6-VP0(VP2+VP4)蛋白。这两个实验表明本实验所制备的抗CVA6-VP1和抗CVA6-VP2多克隆抗体适用于WB分析。IFA鉴定抗血清时,结果发现感染CVA6的细胞有明显的绿色荧光信号,而未感染CVA6的细胞则没有绿色荧光信号,表明抗CVA6 VP1和抗CVA6 VP2多克隆抗体可特异性识别天然的CVA6抗原,可用于IFA分析。
综上所述,该实验制备了特异性较高的CVA6-VP1和CVA6-VP2兔多克隆抗体,可以用于WB和IFA法检定CVA6的VP1和VP2抗原,为进一步研究CVA6奠定了基础。同时本实验成功构建了重组质粒pGEX-6p-1-CVA6-VP1和pGEX-6p-1-CVA6-VP2,获得了重组的CVA6 VP1和VP2蛋白,还可进一步研究CVA6的免疫原性及抗原表位,亦可为研究CVA6的致病机制、检测试剂等提供参考。
利益冲突无
——一道江苏高考题的奥秘解读和拓展

