利多卡因、布比卡因对关节软骨细胞活性的对比研究*
雷昌斌 王 东 曹锡文 唐新文 陈占昆
(1 湘南学院附属医院骨科,郴州 423000;2 Ferguson Lab University of Pittsburgh,Pittsburgh 15213;3 北京大学人民医院关节病研究所,北京100044)
骨性关节炎 (osteoarthritis, OA) 指由多种因素引起关节软骨纤维化、皲裂、溃疡、脱失而导致的关节疾病[1]。随着人口老龄化,骨性关节炎严重影响人们日常生活。据统计在美国OA是导致50岁以上老年人丧失劳动力的第二主要病因,仅次于心血管疾病[2]。OA早期的治疗方式包括非甾类抗炎药、局部理疗、玻璃酸钠关节腔注射及局麻药物注射治疗[3]。目前较为前沿的研究包括使用间充质干细胞 (mesechymal stem cells, MSCs)[4]及富血小板血浆(platelet-rich plasma, PRP)[5]治疗骨性关节炎。局麻药物关节腔内注射被广泛用于骨性关节炎及关节镜手术后的疼痛缓解,常用的局麻药有利多卡因及布比卡因[6]。有些体外研究显示,局部麻醉药物对动物和人类的关节软骨细胞有毒性作用[7,8];Hansen[9]认为膝关节镜术后使用关节内镇痛泵与术后关节软骨变性破坏及骨质松质有关。但是Iwasaki[10]的研究却表示0.5%布比卡因连续关节腔内注射对小鼠正常关节软骨细胞损伤很小。目前局麻药物的软骨细胞毒性机制仍未得到很好的阐述。
本研究在前期已经建立类似于体内生理环境的关节软骨体外培养模型的基础上,继续进行利多卡因及布比卡因对关节软骨细胞的浓度及时间依赖性毒性作用,以及局麻药对正常及损伤关节软骨细胞毒性作用的对比研究。
方 法
1.一般资料
本实验通过伦理委员会审查,标本取自骨性关节炎膝关节置换女性病人关节软骨,病人术前签署同意书。纳入标准:①女性;②年龄:55~65岁;③骨性关节炎;④股骨外侧髁关节软骨完整。
排除标准:①股骨外侧髁关节软骨磨损;②其它类型引起的膝关节退变;③合并其它基础疾病。病人接受膝关节表面置换术后,从手术室取回膝关节置换切除股骨外髁关节软骨部分,离体后立即放置在磷酸缓冲盐溶液 (phosphate buffer saline, PBS)液中浸泡,反复冲洗后,30分钟内在超净工作台上用环钻取直径4 mm的圆形新鲜全层厚度的正常软骨,膝关节软骨表面损伤组(后文简称损伤组)切除关节软骨表面1mm厚度制作损伤模型,将其分别培养在2.5 ml含 90%DMEM (dulbecco' s modified eagle medium) / F12(1:1),10%FBS (fetal bovine serum),1%P/S (Penicillin/Streptomycin) 的24孔板中,置放于37℃ 和5% CO2的培养箱。
2.仪器设备
5% CO2,37 ℃培养箱、清洁操作台、病理切片机及荧光显微镜。
3.试剂
培养基:90% DMEM /F-12 (1X) 购买来自美国Life Technologies公司,10% FBS购买来自美国ATLANTA 公司,1%P/S。
MTT (Methyl Thiazolyl Tetrazolium, MTT),全称为3- (4,5-二甲基噻唑-2) -2,5二苯基四氮唑溴盐。规格:1 g;型号:M-5655;生产商: SIGMA。
DAPI:(4',6-diamidino-2-phenylindole)即 4',6-二脒基-2-苯基吲哚. 规格:2 ml;型号:P36935;生产商:Invitrogen。
4. 实验分组(每组3例)
(1)利多卡因、布比卡因对正常关节软骨毒性的浓度效应:吸出培养基后,浓度效应组将体外正常关节软骨分别浸泡在2.5 ml的浓度为1%和2%利多卡因、0.25%和0.5%布比卡因溶液中1 h,两组的阴性对照均为0.9%生理盐水,评估不同作用浓度的局麻药物对关节软骨细胞活性的影响。
(2)利多卡因、布比卡因对正常及损伤关节软骨毒性的时间效应:时间效应组将正常关节软骨和表膜损伤关节软骨分别浸泡在2.5 ml的浓度为1%利多卡因及0.25%布比卡因溶液中30、60和120 min,两组的阴性对照均为0.9%生理盐水。评估利多卡因及布比卡因对软骨细胞活性的时间效应,评估局麻药物对正常及损伤关节软骨的细胞毒性差异性。
(3)关节软骨细胞活性测定:将经过不同浓度和时间局麻药作用过的关节软骨,吸出局麻药,加入2.5 ml浓度为1 mg/ml的MTT试剂中培养箱放置2 h染色,然后用OCT (Tissue OCT-Freeze Medium)包埋软骨组织,将关节软骨在冰冻切片机上制作成7 μm厚的冰冻切片,最后进行DAPI染色。通过MTT方法检测活细胞数,核荧光DAPI染色法确定总细胞数。活性细胞可将MTT转化成蓝紫色颗粒而死亡细胞无转化能力,仅表现为淡黄色颗粒,同一显微镜光镜下确定活细胞数,荧光镜下确定总细胞数,并定量计算活细胞数百分比(活细胞数/总细胞数),以评估不同局麻药对关节软骨细胞活性的影响以及关节软骨表膜对软骨细胞的保护作用。每个独立的样本MTT染色后切三张冰冻切片,DAPI染色后读片。
5. 统计方法
实验结果的统计学分析采用三次独立实验数据的平均值,将所有回收的资料统一编号后,采用Graphpad Prism 7.0统计软件对数据进行统计描述和统计分析。以α = 0.05为检验水准,P值取双侧概率,P < 0.05为差异有统计学意义,进行统计描述和统计推断。评估利多卡因、布比卡因在不同浓度和作用时间对关节软骨细胞活性的影响是否有统计学差异,评估局麻药对正常组及损伤组关节软骨细胞毒性的差异性。
结 果
1.利多卡因、布比卡因对关节软骨细胞活性的浓度效应
浓度效应组中药物作用时间固定为1 h,1%和2%利多卡因作用下的软骨细胞活性分别为80.9 ± 1.3%和72.1±1.0%;0.25%和0.5%布比卡因细胞活性分别为78.4±2.5%、70.4±1.0%(见图1)。关节软骨的细胞活性随着利多卡因及布比卡因的浓度增加而下降,并且1%利多卡因组与0.25%布比卡因组、2%利多卡因组与0.5%布比卡因组比较存在显著性差异(P < 0.05),结果表明局麻药对膝关节软骨细胞毒性作用有浓度效应。并且1%利多卡因对软骨细胞毒性小于0.25%布比卡因,2%利多卡因对细胞毒性小于0.5%布比卡因。
2. 1%利多卡因对体外正常及损伤关节软骨细胞活性的时间效应
将模型分别浸泡在含有1%利多卡因溶液中30、60和120 min后,正常组软骨细胞活性在下 降 为 79.1±1.5%、69.8±3.1%、56±10.7%; 损伤关节软骨组则下降为76.5±1.5%、66.9±3.9%、52.2±10.7%;对照组为0.9%生理盐水处理后细胞活性分别为92.0 ± 1.7%、90.0±2.3%、89.6±3.1%(见表1)。随着局麻药作用时间延长,软骨细胞活性降低,不同浓度之间各组统计学有显著差异(P < 0.05)。浸泡30 min后,正常组比损伤组的软骨细胞活性高,差异有显著性(P < 0.05)。但浸泡在60 min及120 min时,两组对比差异无统计学意义(P > 0.05)。
3. 0.25%布比卡因对正常及损伤关节软骨细胞活性的时间效应
将模型分别浸泡在含有0.25%布比卡因溶液中培养30、60、120 min后,正常组软骨细胞活性为88.2±4.7%、78.7±3.6%、63.7±3.7%;损伤组为79.7±2.2%、71.4±4.1%、56.5±6.5%(见表2)。随着布比卡因暴露时间的延长,软骨细胞活性下降。在正常组与损伤组对比中,暴露30、60 min时比较存在显著性差异(P < 0.05)。但正常组与损伤组暴露在局麻药120 min时,两组差异无统计学意义 (P > 0.05)。

图1 不同浓度利多卡因和布比卡因对体外培养关节软骨细胞活性的影响阴性对照组为0.9%生理盐水,* P < 0.05,** P < 0.01Fig.1 The dose-dependent effects of lidocaine and bupivacaine on the cell viability of articular cartilage Negative control: 0.9% saline,*P < 0.05,**P < 0.01.
讨 论
近年来随着我国进入老年社会,骨性关节炎已经成为骨科门诊常见病。在欧洲有7 000多万OA病人,每年直接医疗成本超过20亿欧元[3]。骨性关节炎的特点是关节软骨渐进性的侵蚀、退化、变性以及继发性的骨赘形成,包括软骨、滑膜、半月板及周围韧带和肌肉的综合退变。关节软骨没有神经支配,也没有血管和淋巴管,因此损伤的软骨细胞溶解是不可逆并且无法完全医治[11]。
骨性关节炎产生的炎症因子可破坏关节软骨的合成及分解代谢,早期的骨性关节炎传统治疗除了功能锻炼及控制体重外还包括非甾类抗炎药、玻璃酸钠、局麻药注射治疗及关节镜手术[3]。Borakti[4]通过对MSCs治疗文献的Mate分析,发现MSCs较对照组疼痛明显改善,并且无严重并发症。Legndre[12]则指出通过重组人骨形态发生蛋白-2(Recombinant Human Bone Morphogenetic protein-2,BMP-2) 和转化生长因子-β1(transforming growth factor-β1, TGF-β1)可在胶原支架中诱导MSCs的软骨形成和分化。在美国有大量的运动员通过血小板血浆(Platelet-rich plasma, PRP)关节腔内注射治疗早期膝关节退变[5]。但目前这两种方式尚处在研究阶段,局麻药注射治疗仍广泛应用于临床。
表1 1%利多卡因30、60、120 min组对正常和损伤关节软骨活性影响,阴性对照组为0.9%生理盐水 (n = 3,±SD)Table 1 The effects of 1% lidocaine for different durations (30, 60 and120 min) in normal and injury Articular cartilage, Negative control: 0.9% saline (n = 3,±SD)
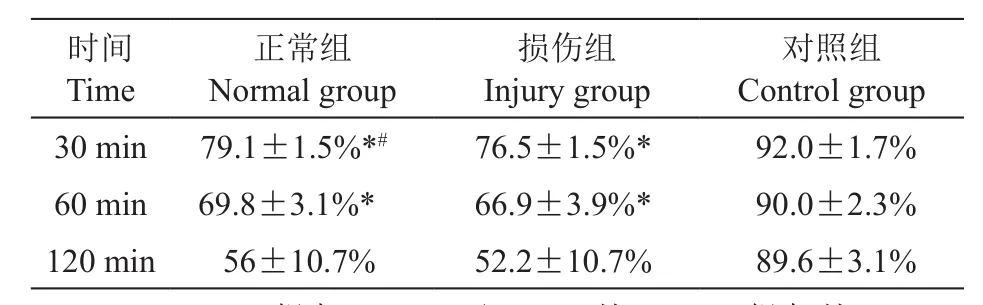
表1 1%利多卡因30、60、120 min组对正常和损伤关节软骨活性影响,阴性对照组为0.9%生理盐水 (n = 3,±SD)Table 1 The effects of 1% lidocaine for different durations (30, 60 and120 min) in normal and injury Articular cartilage, Negative control: 0.9% saline (n = 3,±SD)
*P < 0.05,30 min组与60 min ,及60 min比120 min组相比, 30 min group compared with 60 min, and 60 min group compared with 120 min;#P < 0.05,正常组与损伤组比较,Normal group compared with Injury group.
时间Time正常组Normal group损伤组Injury group对照组Control group 30 min 79.1±1.5%*# 76.5±1.5%* 92.0±1.7%60 min 69.8±3.1%* 66.9±3.9%* 90.0±2.3%120 min 56±10.7% 52.2±10.7% 89.6±3.1%
表2 0.25%布比卡因30 、60 、120 min组对正常和损伤关节软骨活性影响,阴性对照组为0.9%生理盐水 (n = 3,±SD)Table 2 The effects of 0.25% bupivacaine on normal and injury Articular cartilage in (30, 60 and 120 min) (n = 3,±SD)

表2 0.25%布比卡因30 、60 、120 min组对正常和损伤关节软骨活性影响,阴性对照组为0.9%生理盐水 (n = 3,±SD)Table 2 The effects of 0.25% bupivacaine on normal and injury Articular cartilage in (30, 60 and 120 min) (n = 3,±SD)
*P < 0.05, 30 min组与60 min ,及60 min比120 min组相比, 30 min group compared with 60 min, and 60 min group compared with 120 min;#P < 0.05,正常组与损伤组比较,Normal group compared with Injury group.
时间Time正常组Normal group损伤组Injury group对照组Control group 30 min 88.2±4.7%*# 79.7±2.2%* 92.0±1.7%60 min 78.7±3.6%*# 71.4±4.1%* 90.0±2.3%120 min 63.7±3.7% 56.5±6.5% 89.6±3.1%
本研究实验数据表明,局麻药对体外关节软骨培养模型处理后,关节软骨细胞活性下降,并随着利多卡因及布比卡因浓度的增高,关节软骨细胞活性下降更显著。Buchko[13]研究显示,46例行前交叉韧带重建术后病人使用布比卡因和激素后13例 (23%) 病人出现软骨溶解。其中0.5%布比卡因处理软骨细胞溶解占37.5%,0.25%布比卡因处理软骨细胞溶解约占7.1%,与本实验结果一致。Breu[14]通过局部麻醉剂对软骨细胞分化前后人间质干细胞(MSC)的细胞毒性效应的调查显示,局麻药对软骨细胞的毒性效应具有时间和浓度依赖性,并指出关节损伤、骨性关节炎或外科手术引起氧化应激损害MSC细胞功能,甚至可能增加MSC对局部麻醉剂的脆弱性。Piat及Lo在动物体内及体外实验证实局麻药对软骨细胞具有毒性作用[15,16]。Dong[17]在大鼠髓鞘注射模型中证实,布比卡因相对于利多卡因的半衰期长,并且神经毒性低,因此目前布比卡因比利多卡因更常用于慢性腰背部疼痛的封闭治疗。关节腔内没有血管组织,代谢较慢,延长了布比卡因的半衰期从而增加了细胞毒性。本研究也发现布比卡因较利多卡因对关节软骨毒性作用强。
局麻药除了对神经系统作用外,对炎症反应及凝血系统均有影响[18]。关于局麻药物对关节软骨的毒性作用机制主要包括以下四点。首先,局部麻醉药会破坏细胞膜,引起软骨急性坏死。第二,它们可以通过破坏线粒体跨膜电位并使氧消耗阻止ADP转化为ATP而减缓线粒体呼吸[11]。第三,局麻药还可以阻断钾和钙离子通道,诱导线粒体生产活性氧引起脂类、蛋白质和核酸的损害,这种恶性循环随着时间的推移,导致线粒体DNA损伤和突变,使细胞功能衰竭和细胞死亡[19,20]。第四,关节软骨的凋亡程序启动后,将不可逆,因为关节软骨没有巨噬细胞,坏死和凋亡残余物可能不会被清除,并且导致再生组织的损伤、凋亡[21]。
本研究显示随着体外关节软骨在局麻药暴露时间的延长,关节软骨细胞的活性随之下降。并且在暴露30 min组,损伤关节组软骨细胞较正常组软骨细胞下降更明显。因此相对正常软骨,膝关节炎的退变软骨更容易受到局麻药物的侵蚀。但是软骨暴露在60 min及120 min组,正常软组组与损伤组差异无统计学意义。考虑关节软骨细胞膜对高浓度局麻药抵抗力差,局麻药更容易浸润到深层软骨,故长时间浸泡差异性不显著。Chu[22]发现用0.5%布比卡因作用膝关节关节软骨45%软骨细胞死亡,当切除关节软骨表明保护膜死亡细胞甚至达75%。进一步证实关节表面软骨损伤后,局麻药可更直接和深入破坏软骨细胞。退变骨性关节炎引起关节表面破坏,使细胞外基质及数量减少,提高了局麻药物的扩散及浸润能力。使局麻药物能进入更深及更广泛的软骨区域引起软骨细胞坏死。
本研究采用老年病人膝关节置换软骨建立体外培养器官模型,较以往的动物模型或软骨细胞体外培养,可以更好的模拟组织在体内的内环境状态和正常营养物质的弥散交换,但是与人体关节系统的新陈代谢仍有较大差距。下一步拟继续通过Wosternblot检测不同局麻药及浓度处理后关节软骨聚集蛋白聚糖及I型胶原的改变,及通过ATP检测软骨细胞能量代谢的改变。根据本研究及以往研究结果,局麻药在临床上广泛应用于治疗关节炎和膝关节镜术后镇痛的同时,其对关节软骨的毒副作用应当受到重视。由于局麻药的毒性作用具有浓度和时间依赖性,临床上应谨慎使用大剂量和长疗程局麻药物。
[1] Cooper BG, Stewart RC, Burstein D, et al. A Tissue-Penetrating Double Network Restores the Mechanical Properties of Degenerated Articular Cartilage. Angew Chem Int Ed Eng, 2016, 55(13):4226 ~ 4230.
[2] Arden N, Nevitt MC. Osteoarthritis: epidemiology.Best Pract Res Clin Rheumatol, 2006, 20(1):3 ~ 25.
[3] Cucchiarini M, de Girolamo L, Filardo G, et al. Basic science of osteoarthritis. J Exp Orthop, 2016, 3(1):1 ~ 18.
[4] Borakati A, Mafi R, Mafi P, et al. A systematic review and meta-analysis of clinical trials of mesenchymal stem cell therapy for cartilage repair. Curr Stem Cell Res Ther, 2017, 12(8)601 ~ 610.
[5] Dhillon MS, Patel S, John R. PRP in OA knee - update, current confusions and future options. sicot J, 2017, 3:27 ~ 33.
[6] Sun QB, Liu SD, Meng QJ, et al. Single administration of intra-articular bupivacaine in arthroscopic knee surgery: a systematic review and meta-analysis. BMC Musculoskelet Disord, 2015,16:21 ~ 34.
[7] Miyazaki T, Kobayashi S, Takeno K, et al. Lidocaine cytotoxicity to the bovine articular chondrocytes in vitro: changes in cell viability and proteoglycan metabolism. Knee Surg Sports Traumatol Arthrosc,2011, 19(7):1198 ~ 1205.
[8] Grishko V, Xu M, Wilson G, et al. Apoptosis and mitochondrial dysfunction in human chondrocytes following exposure to lidocaine, bupivacaine, and ropivacaine. J Bone Joint Surg Am, 2010, 92(3):609 ~ 618.
[9] Hansen BP, Beck CL, Beck EP, et al. Postarthroscopic glenohumeral chondrolysis. Am J Sports Med, 2007,35(10):1628 ~ 1634.
[10] Iwasaki K, Sudo H, Kasahara Y, et al. Effects of Multiple Intra-articular Injections of 0.5% Bupivacaine on Normal and Osteoarthritic Joints in Rats. Arthroscopy:The Journal of Arthroscopic & Related Surgery, 2016,32(10):2026 ~ 2036.
[11] Matsen FA, Papadonikolakis A. Published Evidence Demonstrating the Causation of Glenohumeral Chondrolysis by Postoperative Infusion of Local Anesthetic Via a Pain Pump. The Journal of Bone and Joint Surgery-American Volume, 2013, 95(12):1126 ~ 1134.
[12] Legendre F, Ollitrault D, Gomez-Leduc T, et al.Enhanced chondrogenesis of bone marrow-derived stem cells by using a combinatory cell therapy strategy with BMP-2/TGF-beta1, hypoxia, and COL1A1/HtrA1 siRNAs. Sci Rep, 2017, 7(1):3406.
[13] Buchko JZ, Gurney-Dunlop T, Shin JJ. Knee Chondrolysis by Infusion of Bupivacaine With Epinephrine Through an Intra-Articular Pain Pump Catheter After Arthroscopic ACL Reconstruction. Am J Sport Med, 2015, 43(2):337 ~ 344.
[14] Breu A, Eckl S, Zink W, et al. Cytotoxicity of Local Anesthetics on Human Mesenchymal Stem Cells in Vitro. Arthroscopy: The Journal of Arthroscopic &Related Surgery, 2013, 29(10):1676 ~ 1684.
[15] Piat P, Richard H, Beauchamp G, et al. In vivo effects of a single intra-articular injection of 2% lidocaine or 0.5% bupivacaine on articular cartilage of normal horses. Vet Surg, 2012, 41(8):1002 ~ 1010.
[16] Lo IKY, Sciore P, Chung M, et al. Local Anesthetics Induce Chondrocyte Death in Bovine Articular Cartilage Disks in a Dose- and Duration-Dependent Manner. Arthroscopy: The Journal of Arthroscopic &Related Surgery, 2009, 25(7):707 ~ 715.
[17] Wang D, Vo NV, Sowa GA, et al. Bupivacaine decreases cell viability and matrix protein synthesis in an intervertebral disc organ model system. Spine J,2011, 11(2):139 ~ 146.
[18] Hollmann MW, Herroeder S, Kurz KS, et al. Timedependent inhibition of G protein-coupled receptor signaling by local anesthetics. Anesthesiology, 2004,100(4):852 ~ 860.
[19] Scholz A. Mechanisms of (local) anaesthetics on voltage-gated sodium and other ion channels. Br J Anaesth, 2002, 89(1):52 ~ 61.
[20] Mandavilli BS, Santos JH, Van Houten B.Mitochondrial DNA repair and aging. Mutat Res, 2002,509(1-2):127 ~ 151.
[21] D' Lima DD, Hashimoto S, Chen PC, et al. Human chondrocyte apoptosis in response to mechanical injury.Osteoarthritis Cartilage, 2001, 9(8):712 ~ 719.
[22] Chu CR, Izzo NJ, Papas NE, et al. In Vitro Exposure to 0.5% Bupivacaine Is Cytotoxic to Bovine Articular Chondrocytes. Arthroscopy: The Journal of Arthroscopic & Related Surgery, 2006, 22(7):693 ~ 699.

