物质结构与性质方面的竞赛知识归纳
■郑州外国语学校 陈 宁
物质结构与性质知识涉及三个模块:原子结构与性质、分子结构与性质、晶体结构与性质。下面以自主招生真题和部分竞赛试题为例,将可能需要储备的知识点和思维方法加以介绍。通过这些介绍,希望同学们不仅可以对高考中的一些难点重新突破,同时也可以掌握一些自主招生考试解题方法。
一、原子结构与性质
问题1:一般情况下,电子离核越远能量越高,但为什么按照构造原理图,离核较远的第四个能层的4s能级却比离核较近的第三个能层的3d能级能量更低?
问题2:为什么周期表中有的原子核外电子排布不符合核外电子填充的三个规律(构造原理、洪特规则、泡利原理)?例如Pd、Pt、Ru等。
问题3:Fe原子价电子构型是3d64s2,为什么Fe2+价电子构型是3d6而非3d44s2?
要解决这些问题必须具有以下知识储备。
1.屏蔽效应。
在多电子的中性原子中,每个电子除了受原子核(核电荷数Z)的吸引外,同时还受其他Z-1个电子的排斥。如不考虑电子间的相互作用,多电子原子中的电子仅受核电荷的吸引,那么此电子离核越远能量越高;当考虑其他电子排斥作用时,其他电子对此电子的排斥作用相当于部分抵消(或削弱)了原子核对此电子的吸引,其他Z-1个电子的电子云分散在核周围,像一个“罩”屏蔽掉了一部分原子核的正电荷吸引,使此电子离核距离有所增加,能量升高。
电子的屏蔽效应有以下几个规则:(1)n+1层电子对n层及n层以内电子无屏蔽效应;(2)同层电子间屏蔽效应比内层电子对其屏蔽效应弱;(3)n能层上的电子受到n-2层电子屏蔽效果比n-1层电子屏蔽效果更强;(4)相邻两组电子,内层电子对外层s和p电子的屏蔽效应弱于对d和f电子的屏蔽效应。
2.钻穿效应。
由于不同能级电子云形状不同,电子穿过内层钻穿到核附近回避其他电子屏蔽的能力不同,从而使其能量不同的现象称为钻穿效应。钻穿能力一般是ns>np>nd>nf。钻穿能力越强表示电子回避其他电子屏蔽能量越强,受核吸引越强,离核越近,能量越低。钻穿与屏蔽效应是相互联系的,二者共同作用决定了核外电子的能量以及原子半径的大小。
问题1解答:以19K和20Ca元素为例,E4s<E3d。因为4s和3d电子云形状不同,虽然4s电子最大概率密度距核比3d电子远,但由于4s钻穿效应比3d强,其上电子钻穿到核附近回避其他电子的能力大,大大降低了4s电子的平均能量,使得4s比3d电子能量还低。
问题3解答:21Sc以后的元素,以26Fe为例,其E4s>E3d。原因是4s电子云从整体看比3d离核远得多,与Ca相比,当6个电子填入以后,核电荷同时增加了6个单位,作用于3d的核电荷增加使3d能量降低。此时内层3d上的电子对4s的屏蔽又起作用,相比之下4s钻穿作用不再突出,4s电子能量又高于3d。因此Fe→Fe2+,失去的是4s上的2个电子。
问题2解答:由上面两个问题可以看出,决定基态中性原子或离子的核外电子排布时,最根本的是考虑整个原子或离子在哪一种状态能量最低,而不是任何情况下只看轨道的能量高低。周期表中原子的核外电子排布是光谱实验的测定结果。
例1镧系元素从左向右,原子半径减小的幅度减小,这种现象称为镧系收缩,说说出现这一现象的原因。
解答:对比短周期,从左向右电子都增加在同一外层,电子在同一层内的相互屏蔽作用比较小,所以随原子序数增大,核电荷对电子吸引力增强,导致原子收缩,半径减小;第四周期过渡元素从左到右,电子逐一填入(n-1)d层,d电子处于次外层,对核的屏蔽作用较大,所以随着核电荷增大,半径减小的幅度不如主族元素那么大;镧系元素电子填入再次外层,即(n-2)f层,其对核的屏蔽作用更大,原子半径从左到右收缩的平均幅度更小。
二、分子结构与性质
例2写出NH3、NF3、PF3分子的构型,键角顺序。
解答:均为三角锥形。键角:NH3>NF3>PF3。
点拨:分子构型的推断依据是选修3中介绍的价层电子对互斥理论(VSEPR)(杂化轨道理论无法预测分子构型),而如何比较键角的大小,高中教材并未讲解。但若能理解VSEPR理论的基本思想:在共价分子或共价型离子中,中心原子周围所占空间尽可能采用使其本身受到静电排斥最小的理想几何构型,即尽可能使中心原子周围的各电子对距离达到最大,便可将此思想迁移到键角大小的比较上来。
在相同的杂化类型和孤电子对的条件下,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离变小,排斥力增大,键角变大。N原子电负性大于P,因此NF3中键角大于PF3中键角。与其相反,中心原子相同,端位原子的电负性越大,键角越小。F电负性大于H,因此NF3中键角小于NH3的键角。
影响键角的因素很多,除了上面提到的两点以外,还有以下几个方面。
a.共价分子中双键、叁键的影响:由于叁键与叁键之间的排斥力>双键与双键之间的排斥力>双键与单键之间的排斥力>单键与单键之间的排斥力。例如乙烯分子中,∠HCC>∠HCH。
b.不同杂化类型,键角不同。
c.在相同的杂化类型条件下,中心原子上孤对电子越多,成键电子对之间的键角越小。例如CH4、NH3、H2O,因为中心原子上孤对电子越多,成键电子对受到的排斥力越大,所以键角依次减小。孤对电子与孤对电子之间的排斥力>孤对电子与成键电子之间的排斥力>成键电子与成键电子之间的排斥力。
三、晶体结构中的多面体
晶体结构中涉及的问题多种多样,本文无法全部分析。但笔者对晶体类试题研究发现,晶胞中包含的多面体模型是众多高考、自主招生、竞赛出题频率最高的题型,因此我将选择这个问题作为重点突破。
(一)四面体。
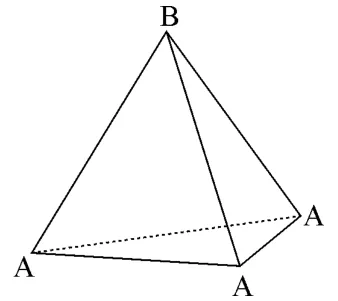
图1
图1为正四面体的几何图形,几何结构上可看作四个正三角形面两两共棱的组合或者任意两条异面直线的组合,若考虑晶体中原子堆积则可看作A、B两层:A层正三角形和正对A层三角形中心的B。
密堆积的原子单层排列如图2,A球密堆积,将该层称为A层,留下两种三角形空隙B和C。

图2
若要紧密堆积,第二层的球只能填入B空隙或C空隙,一旦有一个球入B空隙,剩余的球只能入B空隙,可将该层称为B层,若一开始球入C空隙,该层称为C层(B、C取向只是相对而言的,假设第二层为B层)。则A层三个相邻的构成正三角形方位的原子与其上方填入B空隙的1个原子构成一个正四面体,如图3,其体心即四面体空隙中心;同样,若A层取一个原子与其正上方B层成正三角形方位的三个原子也可形成一个正四面体,如图4,其体心也是四面体空隙中心。

图3

图4
倘若把三原子所在三角形当作底面,单原子中心称作顶点,那么顶点到底面中心的距离即此四面体的高,此高线方向与密置层所在面垂直,四面体空隙的中心O在此高线上。
以图3所示四面体为例,其构型如图5所示,A所在面为密置层面,X为三角形中心,B为四面体顶点,BX垂直于A面,O为四面体空隙中心,O在B X上,且d(BO)=d(BX)。

图5
例3图6为六方ZnS的晶胞图,顶点与晶胞内为S原子,请写出Zn原子的坐标。
注:箭头所指S原子坐标为(1,1,1)。

图6
解答:S按照六方最密堆积ABABA……,六方晶胞共三层S原子。

图7
从图7中比较容易看出来B层一个S原子与相邻A层三个S原子构成的四面体,此四面体高线与z轴平行,长度等于相邻层间距(晶胞z轴方向棱长的一半)。1号Zn填在此四面体空隙中,它距离顶点B的距离为四面体高的(晶胞z轴方向棱长的),因此坐标为(,1-),即(,)。
还有一种四面体,B层三个相邻呈三角形位置的S原子与相邻密置A层的一个S构成的四面体,虽然这种四面体底面三个原子并未都在此晶胞中出现,但能确定的是AB层距为这个四面体的高,四面体空隙中心一定在A的正下方,距A高度为四面体高的。2,3,4,5号Zn原子中z轴方向坐标为1,完整坐标分别为(1,0,),(0,0),(0,1),(1,1)。
(二)八面体。
正八面体的观察有三种不同方式,最常规的如图8所示,四个B组成正方形与过该正方形中心并垂直于该平面的轴(两个A的连线)。

图8

图9
第二种如图9所示,可看作由三个A和3个B构成的正三角形组成,两个三角形所在面互相平行。若将顶点处六个原子沿着两个平行三角形中心连线投影,所得投影图如图10所示,投影图为六芒星形状。
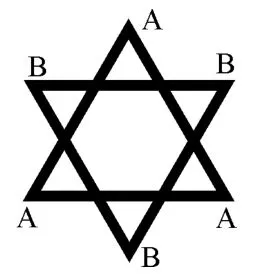
图10
第三种如图11所示,相互交叉的两个三角形,三个A构成的三角形底边与三个B构成的三角形底边垂直相交,交点为正八面体体心。

图11
例4图12为Mg的晶胞图,请写出其中八面体空隙中心的坐标。其中O(0,0,0)。

图12
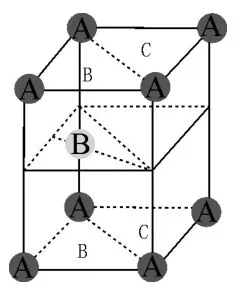
图13
解答:如图13所示,一个六方最密晶胞共由ABA三个密置层构成,层在水平面上。A密置层共有两种三角形空穴B和C(字体不加粗,分别已标注于图13A层相应位置),第二层填充了对应的B空穴,则B层三个原子与A层三个原子必然在对应C空穴的位置存在一个八面体空隙,如图14所示。

图14
图14中双向箭头所连接的三个A构成的三角形与下面B层三个原子构成的三角形所在面平行,大小相等,取向相反,正好构成一个正八面体,其中心即为八面体空隙中心。该中心沿着堆积方向投影刚好与C空穴位置重合,其纵向位置恰好在相邻两个A、B层中间,因此坐标为,同理在B层与下面一个A层之间也存在一个八面体空隙中心,其坐标为。
(三)六元环。
图15为金刚石的结构图,其中灰色小球代表碳原子,每个碳原子均为sp3杂化,价层电子对呈正四面体构型,每六个碳原子构成一个六元环,这六个碳原子并不在同一个平面内,而是呈现一个椅形的状态。

图15

图16
例5金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称(如图16所示)。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是( )。
A.4B.6 C.8 D.10
解答:金刚烷中的碳可分为两类,一类是(CH—)结构中的C,共有4个,相互之间呈四面体构型,记为1号碳;一类是(CH2—)中的C,共有6个,呈八面体构型,记为2号碳。此题的同分异构可分为三类来解决问题。第一类,将Cl连在1号碳上,然后在同一个六元环上连Br,有邻、间、对三种情况;第二类,将Cl连在2号碳上,然后在同一个六元环上连Br,有同一碳原子和邻、间、对四种情况;第三类,将Cl连在2号碳上,然后在不同的六元环上连Br,只有一种情况。若将Cl连在1号碳上,找不到与其在不同的六元环上的碳,故没有此类型的同分异构体。
如图17所示,共8种。答案为C。

图17
【晶体中的多面体问题小结】由于自然界中晶体的广泛存在,从晶体结构与性质出发,可引申出形式各样的题目,但目前高考与自主招生在这一模块出题常常会从晶体中蕴含的经典多面体角度出题,笔者认为要想突破此难点,需要先将经典多面体本身从多个角度(结合其对称性)深入认识并剖析,然后从原子堆积层中找寻经典多面体基本模型,进而将较为复杂的题目转变为解决经典多面体模型的基本问题上来,最终顺利解决问题。

