利用放射性同位素氢-3测定水体环境微生物生物量碳周转速率
路 璐
(西华师范大学 环境科学与工程学院,四川 南充 637009)
自然环境微生物群落是与其它生物及自然环境长期互相作用的结果,脱离了原位环境代谢功能预测,都不能真实地反映微生物群落在原位复杂环境中的代谢活性。因此,在整体水平上清楚认知复杂环境中的微生物群落总体活性和某一代谢过程的效率具有较大难度。放射性同位素示踪技术,是将复杂环境中的微生物类群及其生理代谢功能活性耦合分析的有力工具。研究水体微生物生物量碳周转速率主要是测定微生物代谢碳为其生长繁殖的快慢。目前,国外用放射性同位素3H来探究微生物生物量碳周转速率主要用于海洋微生物的研究[1],而国内则主要报道了在土壤环境中采用同位素14C来测定土壤微生物生物量碳周转,用于探究土壤微生物参与的有机质的矿化和转化[2-3]。而用3H来测定水体微生物生物量碳周转速率目前国内仍无报道。本文重点探讨3H同位素示踪技术在测定环境样品微生物生物量碳周转速率的应用,阐述其技术原理和实验步骤。并以嘉陵江(南充段)为例,研究其不同河流段中微生物生物量碳周转速率的变化规律及其影响因素。
1 放射性同位素3H用于测定环境微生物生物量碳周转速率方法
1.1 以3H-亮氨酸为基础的环境微生物生物量碳周转速率测定背景介绍
微生物不断繁殖利用碳源形成新的微生物生物量碳的一部分,同时微生物自身碳元素也在不断更新替代[2],这部分成为微生物生物量碳的周转。一般情况下,环境微生物生物量碳周转处于相对平衡的转台,即单位时间内合成的微生物量和分解的微生物量相等,即基础微生物量状态[4]。当外部有机物质或其他营养物质进入水体环境中,这种平衡状态将受到影响。因此,微生物生物量碳可以说明微生物量的大小,则微生物生物量碳的周转速率则可反映水体微生物的活性,其也是衡量环境微生物活性和生长速率的基本指标之一。总体微生物的生物量碳周转速率往往和其参与的很多物质代谢过程相关,因此,能在群落水平精确测定该指标对探究一个环境生态系统的有机污染物代谢水平有重要参考价值。
微生物生物量碳周转速率常常以单位时间内一定体积/重量环境样品生物量的代谢速率,以μg C-1h-1或nM C-1h-1为单位[5],生物量碳周转速率通常以总体微生物的蛋白质含量变化为衡量依据。虽然环境样品中,微生物细胞的大小差异显著,但不同微生物细胞中蛋白质的比例较为恒定,平均占总细胞质量的60%[6]。而不同的蛋白质中,亮氨酸的质量比是相对稳定的,约占总体蛋白质质量的7.3%[7]。同时,合成代谢是所有生命的基本特征之一,亮氨酸也是蛋白质的必需氨基酸。因此,早在1985年Kirchman教授提出用亮氨酸作为底物培养环境样品,环境微生物细胞不断分裂,生长、繁殖消耗亮氨酸,通过亮氨酸的消耗量来估算微生物群落的生物量碳变化[7]。然而,由于针对不同的环境样品,不同的亮氨酸提取和测定方法所测出的浓度差异显著,使得不同的研究间难以进行定量的比较[7]。于2001年Kirchman教授对微生物生物量碳的周转速率的测定进行了改进,利用放射性同位素3H标记的亮氨酸作为环境样品的培养底物,通过测定合成于微生物细胞生物量中的3H亮氨酸的放射性,进而计算微生物生物量碳的周转速率(如图1),开拓了3H同位素在示踪环境微生物活性测定中的应用。
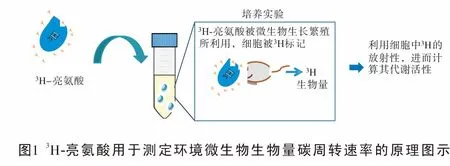
1.2 以3H-亮氨酸为基础的环境微生物生物量碳周转速率测定方法
1.2.1 实验材料和试剂
该实验中需要的耗材有2 mL的离心管,移液枪枪头(20~200 μL,1mL,5 mL)。试剂需要配置100%和5%的三氯乙酸(trichloroacetic acid,TCA),80%的乙醇,放射性每分钟衰变数(disintegrations per minute,dpm)为5×104dpm的3H-亮氨酸溶液(每nM的3H-亮氨酸的放射性为1.33×108dpm)以及用于测定放射性的荧光剂Ultima Gold。放射性测定用液体闪烁计数器(Liquid scintillation counter,2500TR)测定。
1.2.2 实验步骤
(1)针对环境水体样品,取1.5 mL水样至2 mL离心管中,加入20 μL放射性为5×104dpm的3H-亮氨酸溶液(根据放射性和亮氨酸浓度的换算关系,相当于加入20 nM的亮氨酸),置于和原位采样环境相同的温度条件下培养2 h。对照处理为非生物对照,同样取1.5 mL水样至2 mL离心管中,立即加入100 μL的100% TCA溶液使微生物失活,再加入20 μL放射性为5×104dpm的3H-亮氨酸溶液,置于4 ℃冰箱中待测放射性。对照处理用于测定亮氨酸吸附于细胞表面或者离心管管壁等带来的非微生物合成的放射性来源(该培养实验中,加入的3H-亮氨酸的浓度远远高于水体环境中的浓度,因此可以忽略原位环境中的亮氨酸所带来的稀释效应[8])。
(2)水样培养2h,加入100 μL的100% TCA溶液终止微生物活性。
(3)将培养后的离心管置于离心机中,以10 300 rpm的转速离心15min,使得水样中的微生物细胞沉降至离心管底部。随后,弃上清液。
(4)向(3)中的离心管中,加入1 mL的5%的TCA溶液,混匀,10 300 rpm的转速离心5min,弃上清液。此步用于洗涤微生物细胞,尽量将吸附于细胞表面的3H-亮氨酸洗出。
(5)向(4)中的离心管中,加入1 mL的80%的乙醇,混匀,10 300 rpm的转速离心5min,弃上清液,将离心管盖子打开,置于通风厨中过夜,风干残留的乙醇。
(6)向(5)中的离心管中加入1.75 mL 荧光剂Ultima Gold,充分混匀,并将离心管置于液体闪烁计数器中进行放射性测定。
1.2.3 微生物生物量碳周转速率计算
微生物生物量代谢速率的测定基础是以蛋白质的合成代谢速率为衡量标准,亮氨酸作为蛋白质的标记物作为中间换算量来进行计算,基于此计算公式为[8]:

其中,3H-亮氨酸在细胞中的量,可以根据所测得的细胞放射性(dpm)和亮氨酸量的换算关系来计算(每nM的3H-亮氨酸的放射性为1.33×108dpm)。131.2为亮氨酸的分子质量。0.015L为该实验中取0.015 L的水样作为培养单位,2 h为培养时间,24 h为换算为以天为单位的系数。公式中亮氨酸在微生物蛋白质中的平均比例为7.3%,公式中即为0.073;微生物蛋白质中碳的平均比例为0.86[6]。因此,该公式还可简化为如下:
2 探究河流水体微生物生物量碳周转速率(嘉陵江南充段)
2.1 研究对象背景

我国城市淡水河流生态系统普遍受到生活污水和工业废水的污染,据统计受污染的河流约占46.5%[9]。这些污染源常常含有高浓度的氮、磷、有机碳等营养物,显著改变水体的理化性质。研究表明,微生物的新陈代谢活性显著受氮浓度[10]、pH[11]、溶解氧[12]、温度[13]和有机碳[14]等环境因子的影响。嘉陵江属于长江水系,是长江第二大支流,也是南充市境内最长的河流,由于水量充沛成为南充市主城区工农业生产及人民生活用水的主要供应水源。在流经城市的过程中,大量的生活污水排放到嘉陵江中,河流中的氨氮化物含量严重超标,水体中含有大量的氮、磷等营养物质[15],河道中沉积物大量淤积,由于其沉降和吸附功能,也会导致大量污染物的积累。最近Wang等的研究也证实嘉陵江(南充段)水体中的总磷和硝态氮是影响微生物群落结构和功能的主导原因[10]。水体理化性质的改变,将可能会导致流域不同区段水体中微生物代谢活性的差异。该研究于2016年10月采集嘉陵江(南充市段)流域8个不同位置的表层水体样品,如图2所示,分别涵盖了嘉陵江(南充市段)的上(1-2W)、中(3W,4W,6W)、下游(8W),以及城市支流(5BW,7BW)。研究采用3H-亮氨酸为基础的放射性同位素示踪法,揭示嘉陵江(南充市段)流经南充市区微生物生物量碳周转速率的变化规律。
2.2 嘉陵江(南充市段)表层水体微生物生物量碳周转速率变化规律
水体微生物代谢活性通过测定其生物量碳代谢速率来表征。如图3所示,嘉陵江(南充市段)表层水体的微生物生物量碳周转速率在577.89至2 091.70 nM C L-1d-1之间。上游水体1W处微生物生物量碳的周转速率为847.81 nM C L-1d-1,与2W,3W之间没有显著差异。 而4W和城市支流5BW水体中的微生物生物量碳周转速率分别为681.15和577.89 nM C L-1d-1,显著低于该流域区段其他表层水体中微生物的代谢活性(P<0.05),这可能由于该两处水体采样点处的底部被水泥固封(见图2),导致底泥和水体的营养物质交互作用减弱,使得微生物数量减少(见表1),由人工干扰,如河床硬化等,所带来的微生物数量减少在Ibekwe等的研究结果中也有所体现[16],揭示了河内和岸边建设对其微生物生物量代谢也有负面影响。
在流经城区的城市支流西河7BW水体中微生物生物量碳周转速率最高,为2091.70 nM C L-1d-1,显著高于其他水体中微生物的活性(P<0.05)。如表1中所示,西河7BW中的微生物数量也同样显著高于其他水体(P<0.05)。该采样点处有多处生活污水排放(见图2),从水体的理化性质也可得出,总磷、溶解性有机碳和铵态氮都显著高于嘉陵江(南充市段)其他水体(见表1),Wang等研究也发现该处水体中有大量粪便指示微生物的存在,如黄杆菌和拟杆菌[10],说明该处还受到生活污水带来的微生物污染。微生物活性与环境中的营养物质浓度也有直接关系,Xu等研究发现微生物的酶活性与营养物质,如总磷和硝态氮都有显著相关性[17]。因此,该处较高的微生物生物量碳代谢速率与微生物丰度高和营养物质丰富相关。

在表2中,嘉陵江(南充市段)微生物生物量碳周转速率与水体的环境因子相关性分析表明,微生物生物量碳周转速率与水体的铵态氮浓度和微生物数量成显著正相关 (P<0.05),而与水体的硝酸根浓度成显著负相关 (P<0.05)。氮的生物可利用量是影响微生物生长和活性的主要环境因子之一,Zaman等研究发现升高铵态氮浓度显著促进微生物生物量的增加速度和积累量[18],与该研究中,铵态氮浓度和微生物数量与微生物生物量碳周转速率成正比结论一致。然而,以往的研究中也发现,氮元素的增加出现抑制微生物生长的现象。如Treseder研究发现,环境样品中硝酸根浓度的增加导致了微生物生物量的减少[19]。在嘉陵江(南充市段)水体中微生物生物量碳周转速率与硝酸根浓度成反比可能是源于硝酸根对微生物生物量的抑制作用。

表1 嘉陵江(南充市段)不同采样点表层水体理化性质和微生物总量[10]

表2 微生物生物量碳周转速率与环境因子的Pearson相关性分析
*代表有显著相关性
3 结 论
(1)以3H-亮氨酸作为示踪物质测定环境微生物生物量碳周转速率有效地提高了测定效率和精度,极大地降低了测定环境微生物群落代谢活性的复杂度。
(2)嘉陵江(南充市段)表层水样中的微生物生物量碳周转速率在不同采样点间有显著差异,城市支流西河中的微生物生物碳周转速率(7BW)显著高于嘉陵江干流,可能由于其受生活污水的影响所致。
(3)嘉陵江(南充市段)表层水样中的微生物生物量碳周转速率与水样中铵态氮浓度和微生物丰度成显著正相关(P<0.05),与水样中硝态氮浓度成显著负相关(P<0.05)。
参考文献:
[1] KLEINDIENST S,SEIDEL M,ZIERVOGEL K,etal.Chemical dispersants can suppress the activity of natural oil-degrading microorganisms [J].Proceedings of the National Academy of Sciences,2015,112(48):14900-14905.
[2] 陈国潮,何振立,黄昌勇.红壤微生物生物量C周转及其研究 [J].土壤学报,2002,39(2):152-160.
[3] 贾御夫.利用放射性碳同位素和生物标志物技术研究温度对土壤有机碳动态的影响 [D].北京:中国农业大学,2017.
[4] JENKINSON D.Determination of microbial biomass carbon and nitrogen in soil [J].Advances in nitrogen cycling,1988,368-86.
[5] DUCKLOW H.Bacterial production and biomass in the oceans [J].Microbial ecology of the oceans,2000(1):85-120.
[6] SIMON M,AZAM F.Protein content and protein synthesis rates of planktonic marine bacteria [J].Marine Ecology Progress Series,1989,51(3):201-213.
[7] KIRCHMAN D,K’NEES E,HODSON R.Leucine incorporation and its potential as a measure of protein synthesis by bacteria in natural aquatic systems [J].Applied and environmental microbiology,1985,49(3):599-607.
[8] KIRCHMAN D.Measuring bacterial biomass production and growth rates from leucine incorporation in natural aquatic environments [J].Methods in microbiology,2001(30):227-237.
[9] 许叶新,张永国,李玉山.河流水污染问题及治理对策探讨 [J].甘肃水利水电技术,2003,39(1):70-71.
[10] WANG L,ZHANG J,LI H,et al.Shift in the microbial community composition of surface water and sediment along an urban river [J].Science of the total environment,2018,627:600-612.
[11] SHEN C,XIONG J,ZHANG H,et al.Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J].Soil Biology and Biochemistry,2013,(57):204-211.
[12] PETT-RIDGE J,PETERSEN D G,NUCCIO E,et al.Influence of oxic/anoxic fluctuations on ammonia oxidizers and nitrification potential in a wet tropical soil[J].FEMS Microbiol Ecol,2013,85(1):179-194.
[13] WANG Y,FANG X,BAI Y,et al.Distribution of lipids in modern soils from various regions with continuous climate (moisture-heat) change in China and their climate significance[J].Science in China Series D:Earth Sciences,2007,50(4):600-112.
[14] MUEMA E K,CADISCH G,RASCHE F.Soil texture modulates the response of ammonia-oxidizing prokaryotes to biochemical quality of organic inputs in tropical agricultural soils[J].Soil Biology and Biochemistry,2016(100):218-228.
[15] 张军,李铁松,李成柱,等.嘉陵江南充段水质主要污染物分析[J].中国环境监测,2005,21(1):88-90.
[16] IBEKWE A M,MA J,MURINDA S E.Bacterial community composition and structure in an Urban River impacted by different pollutant sources[J].Science of the total environment,2016,566(1):176-185.
[17] XU Z,YU G,ZHANG X,et al.The variations in soil microbial communities,enzyme activities and their relationships with soil organic matter decomposition along the northern slope of Changbai Mountain[J].Applied Soil Ecology,2015,86:19-29.
[18] ZAMAN M,DI H J,CAMERON K C,et al.Gross nitrogen mineralization and nitrification rates and their relationships to enzyme activities and the soil microbial biomass in soils treated with dairy shed effluent and ammonium fertilizer at different water potentials[J].Biology and Fertility of Soils,1999,29(2):178-186.
[19] TRESEDER K K.Nitrogen additions and microbial biomass:A meta-analysis of ecosystem studies[J].Ecology letters,2008,11(10):1111-1120.

