胡子鲶消化道黏膜ACP、ALP、ATPase、NSE、POX和SDH的组织化学定位
任秋楠,陈婷婷,陈娴娴,韦勤勤,李恩,张盛周
(安徽师范大学生命科学学院,安徽省重要生物资源保护与利用重点实验室,芜湖 241000)
胡子鲶(Clarias fuscus)隶属硬骨鱼纲鲶形目胡子鲶科胡子鲶属,是一种温水性小型淡水鱼。胡子鲶肉质细嫩鲜美、营养价值高,在中医药上还有滋阴养血、治疗水肿的功效,深受消费者喜爱。胡子鲶属于以肉食为主的杂食性鱼类,贪食,常生活在较温暖的水体中,适合高产养殖[1]。在我国,胡子鲶主要分布于长江和长江以南各水系中,在广东、广西和福建等省已实现大规模人工养殖[2],给当地带来了很大的经济效益。
研究胡子鲶消化道的组织结构与生理生化特征可为改进其养殖技术,提高养殖质量奠定理论基础。郑文彪等[3]采用扫描电镜技术对胡子鲶消化道黏膜的表面形态结构进行了观察,尹苗等[4]应用细胞化学方法对胡子鲶消化道中粘液细胞的种类和分布进行了研究,黄周英等[5]利用生物化学手段检测了胡子鲶消化道内蛋白酶、淀粉酶和脂肪酶的活力及其分布。但目前有关胡子鲶消化道黏膜中与消化吸收相关的重要酶的分布尚未见研究报道,本研究利用冰冻切片、酶组织化学技术和光密度分析方法对胡子鲶消化道酸性磷酸酶(ACP)、碱性磷酸酶(ALP)、腺苷三磷酸酶(ATPase)、非特异性酯酶(NSE)、过氧化物酶(POX)和琥珀酸脱氢酶(SDH)等6种重要酶的分布和组织定位进行了研究,旨在增进对胡子鲶消化吸收机能的认识,为其人工养殖技术的发展提供基础资料。
材料和方法
1 实验材料
人工养殖胡子鲶7条,购自芜湖市黄山西路菜市场,质量200~500g,确认正常无伤害,置于清水中暂养24h。敲后脑致晕,解剖取出完整消化道,在食道、胃贲门、胃体、胃幽门、前肠、中肠和后肠等7个部位取样,用磷酸缓冲液(PBS,pH7.4)快速洗净,吸水纸轻轻吸干,OCT包埋,进行冰冻切片,切片厚8μm,置于-20℃冰箱保存备用。
2 酶组织化学染色法
6种酶的组织化学染色方法和主要底物见表1。实验试剂的全名、详细配制方法及具体操作步骤参见文献[6]。

表1 6种酶的组织化学染色方法和主要底物Tab.1 Histochemical staining techniques and main substrates of the six investigated enzymes
3 酶活力的光密度测定和数据统计分析
使用Olympus BX61型显微镜,在40倍物镜视野下,观察装片并进行显微拍照,得到清晰的组织图片。使用Image-Pro Plus图像分析软件,对选取的7个部位6种酶的组织化学染色阳性部位进行光密度分析,得到阳性部位的累积光密度(integratedoptical density, IOD)和面积(area)的准确值,算出平均光密度(mean optical density, MOD)。使用SPSS 19.0数据分析软件,用单因素方差分析(oneway ANOVA)对消化道不同部位酶的活力大小进行差异显著性比较,P<0.05为差异显著。
结 果
经光密度分析和数据处理后,胡子鲶消化道各部位6种重要酶的活力分布情况见表2。
1 ACP的分布与定位
阳性部位呈棕黄色,ACP在胃贲门和前肠分布最多,食道、中肠和后肠次之,而在胃体和胃幽门酶活力明显较微弱。食道中ACP主要分布于固有层,黏膜上皮中分布较少(图1A1);胃贲门、胃体和胃幽门中ACP主要位于胃腺中,黏膜上皮细胞中亦有少量分布(图1A2);前肠、中肠和后肠ACP主要分布于黏膜上皮细胞顶部(图1A3)。
2 ALP的分布与定位
阳性部位呈蓝紫色或蓝黑色,ALP在肠道的分布明显多于其他部位,在食道、胃体和胃幽门有少量分布,而胃贲门检测到的酶活力最为微弱。在食道中,ALP主要分布于黏膜上皮细胞底部;在胃贲门、胃体和胃幽门中,ALP位于黏膜上皮和胃腺部,酶活力微弱。在肠道中,ALP主要位于纹状缘,固有层中亦有较多分布(图1B)。
3 ATPase的分布与定位
阳性部位呈黑色,ATPase在前肠活力最高,中肠、胃贲门和胃幽门次之,在胃体和后肠亦有较多分布,而在食道中酶活力微弱。在食道中,ATPase主要分布于黏膜上皮细胞的表层;在胃贲门、胃体和胃幽门中,ATPase主要分布于胃腺和黏膜上皮细胞的表层(图1C1);在肠道中,ATPase集中分布于纹状缘,在固有层中亦有较多分布(图1C2)。
4 NSE的分布与定位
阳性部位呈棕红色,NSE在胃幽门和后肠分布最多,胃贲门和胃体次之,在食道、前肠和中肠中分布最少。在食道中,NSE主要分布于黏膜上皮细胞的表层;在胃贲门、胃体和胃幽门中,NSE在黏膜基部和固有层中活力最高,在胃腺中亦有较多分布(图1D1);前肠和中肠NSE仅在黏膜上皮有少量分布;后肠NSE主要分布于纹状缘和黏膜上皮细胞顶部(图1D2)。

表2 胡子鲶消化道黏膜6种重要酶的分布Tab.2 Relative abundancy and activity of six investigated enzymes in the digestive tract mucosa of Clarias fuscus
5 POX的分布与定位
阳性部位呈黄色或棕黄色,颗粒状,POX在后肠分布最多,其次是胃体、胃幽门和食道,在中肠、贲门和前肠酶活力明显较弱。在食道中,POX主要分布于固有层中,黏膜上皮中分布较少(图1E1);在胃贲门和胃体中,POX主要分布于胃腺中,其次是黏膜上皮;在胃幽门中,POX在黏膜上皮的分布明显多于胃腺;在前肠和中肠中,POX主要分布于固有层中,黏膜上皮中分布较少;在后肠中,POX在固有层和黏膜上皮中均有分布,酶活力较强(图1E2)。
6 SDH的分布与定位
阳性部位呈蓝紫色,SDH在胃贲门,胃体、胃幽门和前肠酶活力较高,其次是中肠和后肠,食道中酶的活力微弱。在食道中,SDH主要分布于黏膜上皮细胞中,其他部位几乎没有分布;在胃贲门、胃体和胃幽门可明显观察到SDH集中分布于胃腺中,黏膜上皮细胞表层亦有少量分布(图1F1);在肠道中,SDH主要分布于黏膜上皮顶部(图1F2)。
讨 论
ACP是一种在机体中广泛分布的磷酸酯酶,是细胞内溶酶体的标志酶,主要参与胞饮作用和细胞内消化过程[7]。研究表明,硬骨鱼类肠上皮细胞可通过胞饮作用吸收营养物质,胞饮作用被看作是鱼类消化吸收蛋白质的另一种途径[8]。在各种鱼类消化道中均能检测到较高的ACP活力,但其分布部位存在一定的物种特异性。欧洲无须鳕(Meluccius meluccius)消化道中ACP分布广泛,食道、胃和肠道中都检测到很强的ACP活力[9];乌鳢(Ophiocephalus argus)消化道ACP主要分布于中肠和后肠,胃中酶活力较低[6];鳜鱼(Siniperca chautsi)消化道ACP主要分布于前肠,胃中亦有较高的酶活力[10]。本研究显示胡子鲶消化道ACP主要分布于前肠和中肠,胃贲门酶活力亦较高,与鳜鱼较为相似,表明胡子鲶前肠和中肠有较强的吸收蛋白质和细胞内消化功能。由于ACP还在核酸和蛋白质的代谢活动及细胞的能量转换过程中发挥重要作用[11],故在胃贲门腺体中有较高ACP活力可能与其参与胃腺的分泌活动有关。
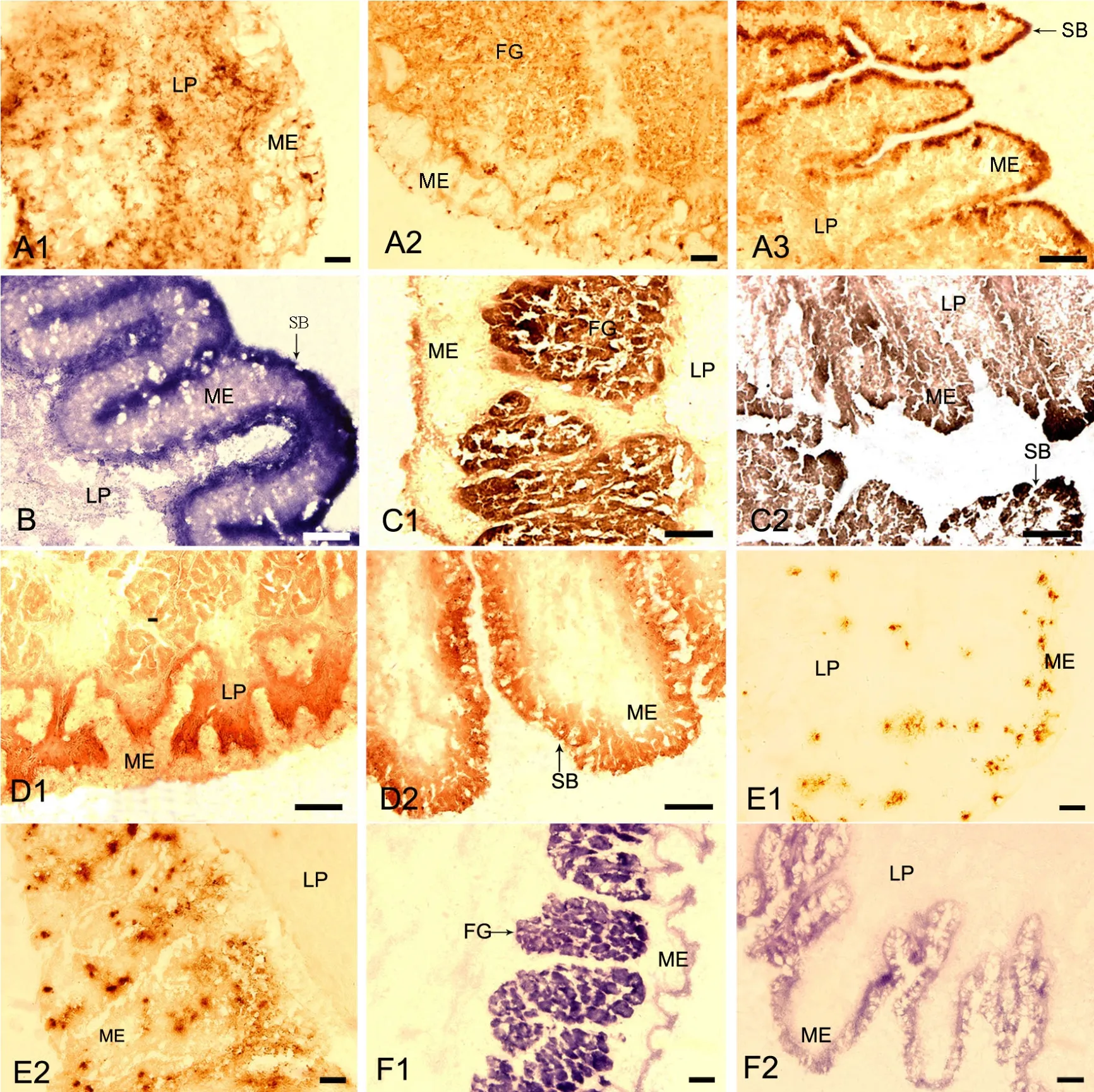
图1 6种重要酶在胡子鲶消化道黏膜中的组织化学定位。A,ACP在食道(A1)、胃贲门(A2)和前肠(A3)的分布;B,ALP在中肠(B)的分布;C,ATPase在胃贲门(C1)和前肠(C2)的分布;D,NSE在胃贲门(D1)和后肠(D2)的分布;E,POX在食道(E1)和后肠(E2)的分布;F,SDH在胃贲门(F1)和后肠(F2)的分布;LP,固有层;ME,黏膜上皮;SB,纹状缘;FG,胃底腺;比例尺,50µmFig.1 Tissue distribution of six essential enzymes in the digestive tract mucosa of Clarias fuscus by histochemical staining.A, distribution of ACP in esophagus (A1), stomach cardia (A2) and foregut (A3);B, distribution of ALP in midgut (B);C, distribution of ATPase in stomach cardia (C1) and foregut (C2); D, distribution of NSE in stomach cardia (D1) and hindgut (D2); E, distribution of POX in esophagus (E1) and hindgut (E2); F, distribution of SDH in stomach cardia (F1) and hindgut (F2).LP, lamina propria; ME, mucosal epithelium; SB, striated border; FG, fundic glands; scale bar, 50µm
ALP是一种在动物体内广泛分布的非特异性磷酸水解酶,该酶主要参与细胞的主动运输过程,在消化道中与脂类、葡萄糖、钙和无机磷酸盐等重要营养物质的吸收有关[12],常被看作是消化道吸收营养物质的标志性酶[13]。本研究显示胡子鲶消化道ALP主要分布于肠道,与乌鳢消化道ALP主要分布于前肠和中肠相似。不同的是,乌鳢胃中亦有较高的ALP酶活力[6],胡子鲶胃中ALP酶活力微弱;欧洲无须鳕消化道ALP主要分布在肠道中,食道和胃中酶活力较低[9];鳜鱼消化道ALP亦主要分布于肠道,胃中活力很低[10]。胡子鲶胃和肠道ALP的分布与这两种鱼相一致。由ALP的功能和分布可推断,胡子鲶前肠、中肠和后肠均有较强的吸收功能。ALP 主要定位于胡子鲶肠上皮细胞的纹状缘,与其参与肠上皮细胞的吸收功能是相适应的。
ATPase是水解酶的一种,普遍存在于细胞膜和细胞器膜上,其主要作用是水解ATP释放能量,参与物质的跨膜转运[14,15]。本研究在胡子鲶胃和肠道各部位均检测到较高的ATPase活力,尤其是前肠部分。乌鳢胃中ATPase活力显著高于肠道[6],和胡子鲶有一定差异;ATPase在鳜鱼胃和肠道均有较多分布[10],与胡子鲶相一致。胡子鲶胃中ATPase主要定位于胃腺,可水解ATP为胃酸和胃蛋白酶的分泌提供充足的能量,肠道ATPase主要位于肠上皮细胞顶部,与其参与营养物质的吸收功能相适应。
NSE是具有促进脂质消化和吸收功能的一种酶,鱼类的主要能量来源是脂类而不是碳水化合物和蛋白质[9]。欧洲无须鳕消化道NSE在食道和胃中活力较低,在肠道中活力较高[9];乌鳢胃体有较强的NSE酶活力,而在胃贲门、胃幽门和肠道中酶活力较弱[6];鳜鱼中肠和后肠NSE活力较高,胃贲门、胃体和前肠酶活力较低[10]。本研究显示胡子鲶消化道NSE在胃幽门活力最高,胃贲门、胃体和后肠中亦有较高的酶活力。由此可见,鱼类消化道NSE的分布有明显的物种特异性。本研究表明胃幽门是胡子鲶消化脂质的主要部位。胡子鲶属于以肉食为主的杂食性鱼类,对脂类的消化和吸收能力要求比较高,在其消化道的前端部位就表现出较强的NSE活力,这可能是胡子鲶对脂质消化的特异性适应机制。
POX是一种对细胞起保护作用的酶,可减少或消除过氧化氢、酚类和胺类等细胞毒性物质[16],主要存在于细胞过氧化物酶体中。该酶还参与脂类代谢过程,亦被视作一种具有免疫功能的酶[17]。POX在胡子鲶胃体和后肠分布最多,在胃幽门和食道中亦有较多分布。乌鳢胃体亦有较高的POX酶活力[6],但与胡子鲶不同的是,乌鳢肠道中POX活力较微弱;鳜鱼胃幽门中POX活力最高,肠道中酶活力较弱[10],和胡子鲶差异较大。POX在胡子鲶胃体和幽门活力较高,可能与这两个部位代谢活动旺盛会产生较多代谢毒性物质有关。POX发挥催化功能产生的活性氧对病原微生物有一定的杀伤作用[11],因而POX在胡子鲶食道和后肠有较高的活力有利于防止病原微生物的入侵,表现为一种保护机制。POX分布与NSE有所重合,可能与其参与脂类代谢有关。
SDH是一种以黄素为辅基的氧化还原酶,是参与三羧酸循环(TCA循环)的关键酶,其活力大小会直接影响TCA循环的反应速率,一般可作为TCA循环运行强度的检测指标[18]。本研究在胡子鲶胃中检测到很强的SDH酶活力,与乌鳢SDH主要分布于胃贲门和胃幽门[6],鳜鱼SDH主要分布于胃贲门和胃体[10]相似。SDH主要定位于胃腺中,和ATPase的定位相一致,与胃酸和胃蛋白酶的合成与分泌需要消耗较多的ATP能量相适应。胡子鲶前肠黏膜上皮细胞中亦有较多SDH分布,位于上皮细胞顶部,可为上皮细胞吸收营养物质提供充足的能量。
总之,胡子鲶消化道6种酶的分布和其他鱼类既有相似性也有其自身的特异性。胡子鲶消化道黏膜酶的分布与消化道各部位的生理功能相适应,6种酶的分布表明,胡子鲶的前肠和中肠有较强的吸收蛋白质和细胞内消化功能,胃幽门是脂质的主要消化部位,前肠和中肠是营养物质吸收的主要部位。
[1]Anderson MJ, Fast AW.Temperature and feed rate effects on Chinese catfish,Clarias fuscus(Lacepède), growth.Aquac Res, 2010, 22(4)∶ 435-442.
[2]陈福才,李明.胡子鲶池塘高产养殖技术.现代农业科技,2014,(1):272.
[3]郑文彪,陈旻,潘炯华.胡子鲶消化道粘膜表面结构的扫描电镜观察.华南师范大学学报(自然科学版),1993,(1):59-67.
[4]尹苗,杨桂文,安利国.胡子鲶粘液细胞类型及其在消化道中的分布.动物学报(Current Zoology),2001,s1:116-119.
[5]黄周英,陈怀宇,洪淑婷,等.温度、pH对胡子鲶主要消化酶活性的影响.泉州师范学院学报,2008,26(6):86-90.
[6]谢毓玲,王锦乙,袁保勤,等.乌鳢消化道黏膜6种重要酶的组织化学定位.中国组织化学与细胞化学杂志,2016,25(5):416-421.
[7]Mir IH, Channa A.Histochemical distribution of lipase and acid phosphatase in the intestinal tract of the snow trout,Schizothorax curvifronsHeckel.J Biol Sci, 2010, 10(7)∶505-512.
[8]Kozari Z, Petrinec Z, Kueir S, et al.Histochemical analyses of digestive enzymes in the intestine of adult large-scaled gurnard (Lepidotrigla Cavillone, Lacepède, 1801).Anat Histol Embryol, 2011, 40(4)∶ 314–320.
[9]Kozaric Z, Nejedli S, Petrinec Z.Histochemical distribution of digestive enzymes in hake,Merluccius merlucciusL.1758.Vet Arhiv, 2004, 74(4)∶ 299- 308.
[10]彭迁迁,权梦雪,罗莹,等.鳜鱼消化道黏液细胞和6种酶的组织化学定位.激光生物学报,2016,25(2):161-169.
[11]王一泽,孙敬锋,刘军锋,等.养殖半滑舌鳎肝胰、中肾、鳃、头肾、脾和心中酸性磷酸酶、碱性磷酸酶和过氧化物酶的组织化学定位.中国组织化学与细胞化学杂志,2017,26(3):229-234.
[12]Tengjaroenkul B, Smith BJ, Caceci T, et al.Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia,Oreochromis niloticusL.Aquaculture,2000, 182(3)∶ 317-327.
[13]Lallès JP.Intestinal alkaline phosphatase∶ multiple biological roles in maintenance of intestinal homeostasis and modulation by diet.Nutr Rev, 2010, 68(6)∶ 323–332.
[14]Liquori GE, Zizza S, Mastrodonato M, et al.Pepsinogen and H, K-ATPase mediate acid secretion in gastric glands ofTriturus carnifex, (Amphibia, Caudata).Acta Histochem, 2005,107(2)∶ 133-141.
[15]Kaplan JH.Biochemistry of Na,K-ATPase.Annu Rev Biochem, 2002, 71∶ 511-535.
[16]刘润芝.脱氧核糖核酸对机体内超氧化物岐化酶和过氧化物酶活性影响初步研究.激光生物学报,2002,11(2):119-121.
[17]Yang X, Yang L, Zheng H.Hypolipidemic and antioxidant effects of mulberry (Moms alba L.) fruit in hyperlipidaemia rats.Food Chem Toxicol , 2010, 48(8-9)∶ 2374-2379.
[18]Rutter J, Winge DR, Schiffman JD.Succinate dehydrogenase - Assembly, regulation and role in human disease.Mitochondrion, 2010, 10(4)∶ 393-401.

