VgDGAT1A转基因大豆高代材料的表型分析
张飞,高秀清,刘宝玲,张靖洁,薛金爱,张红梅*,李润植*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 分子农业与生物能源研究所,山西 太谷 030801)
大豆(Glycinemax)是我国和世界主要粮油作物之一,其蛋白质含量高,氨基酸种类多,钙磷铁含量丰富,脂肪含量高。大豆油除了作为人类食用油的主要来源之外,还用于生物柴油生产、食品和油脂化工业等[1]。大豆油的市场消费量逐年增长[2],培育高油大豆品种尤为重要。因大豆种子油含量与蛋白含量呈负相关,常规育种手段难以克服,不易培育获得蛋白质和油脂含量双高的新品种。
二酰基甘油酰基转移酶(Diacylgycerol acyltransferase,DGAT)是一种内质网细胞微粒体酶,它能够催化二酰甘油加上脂肪酸酰基生成三酰甘油,是三酰甘油合成的限速酶。根据DGAT的结构、亚细胞定位等的差异将其分为4种类型: DGAT1、DGAT2、WS /DGAT和胞质内DGAT (Cyto DGAT)。DGAT1属于酰基辅酶A胆固醇酰基转移酶家族(acyl CoA: cholesterol acyltransferase,ACAT),而DGAT2则属于DGAT2超家族[3,4],DGAT1和DGAT2蛋白主要结合在内质网膜上,属微粒体酶。WS /DGAT和Cyto DGAT是近年发现的新类型,目前研究较少。研究表明,DGAT1在高等植物种子TAG形成中发挥重要作用。DGAT1在大豆的幼根、茎、叶子、花和幼嫩种子等器官中均有表达,并且具有时空性,超表达二酰甘油酰基转移酶DGAT1,能增加三酰甘油的含量,进而增加大豆种子的出油率。
Jako等研究发现,拟南芥DGAT1突变体AS11中种子含油量下降20%~40%,而过量表达拟南芥AtDGAT1,转基因拟南芥种子的DGAT活性比野生型提高10%~70%,并且提高了种子含油量和种子的千粒重[5]。Zheng等发现表达普通玉米DGAT1基因的玉米种子含油量、胚含油量和油酸含量分别提高了9.3%、12.4%和40.5%; 而表达高油玉米DGAT1基因的玉米种子含油量、胚含油量和油酸含量分别提高27.9%、26.1%和84.5%[6]。Zhang等使烟草DGAT1基因沉默后,引起烟草种子油含量减少9%~49%[7]。刘正杰等发现陆地棉内源基因GhDGAT1沉默后转基因种子中GhDGAT1基因表达量显著降低,种仁含油量下降,下降幅度达3.13%[8]。Lardizabal等在大豆种子中过表达真菌DGAT2基因,使大豆种子的总含油量提高了1.5%[9]。这说明DGAT1确实在油脂合成累积过程中起关键作用。研究表明,斑鸠菊二酰甘油酰基转移酶VgDGAT1A在发育种子中高量表达[10]。异源超表达VgDGAT1使亚麻荠种子含油量从野生型的37%提高到46%~51%[11]。VgDGAT1可以显著的提高棉花种子的含油量18%~40%[12]。由此可知,VgDGAT1A的异源表达能够有效增加种子内的脂肪酸含量,是一个优异的提高含油量的靶基因。
本试验在前期培育获得的VgDGAT1A转基因大豆材料基础上,重点对高代转基因大豆材料进行表型分析,通过实时荧光定量PCR检测VgDGAT1A基因在这些高代大豆材料中表达情况。取成熟的转基因大豆种子进行总脂肪酸提取,分析VgDGAT1A对种子总油脂含量及其他表型的影响,鉴定获得含油量平均提高5.1%的高油大豆品系。本研究为全面理解大豆油脂合成积累机制及调控网络提供了新知识,亦为改良高油大豆品种提供可靠的理论与种质资源。
1 材料与方法
1.1 材料
本试验转基因大豆的二脂酰甘油酰基转移酶(DGAT1A)基因从斑鸠菊发育种子中克隆所得。本试验所检测的转基因大豆高代材料(种子特异表达VgDGAT1A)由山西农业大学分子农业与生物能源研究所培育保存。转VgDGAT1A基因大豆种植于山西农业大学农作站网室,待植株长至4周龄(4~6片真叶),取顶端叶片迅速放于液氮中冷冻,然后冷冻保存,以待阳性植株实验。在阳性植株生长后期,取开花后(day after flowering,DFA)30天(30 d)大豆种子经液氮处理后,存于-80 ℃冰箱保存用于定量表达分析,取大豆成熟种子用于提取油脂。
1.2 转VgDGAT1A基因大豆阳性植株检测
本文以4周龄的大豆幼苗(4~6片真叶)为试验对象,采取改良版的CTAB法提取叶片DNA,然后进行PCR扩增,检测外源VgDGAT1A基因。用primer5.0引物设计软件设计引物(表1),设计时应避免引物二聚体的出现,引物由TSINGKE Biological Technology公司合成。用2×Taq PCR StarMix with Loading Dye试剂盒(Genstar公司)进行PCR检测(反应体系共20 μL,正向和反向引物各1 μL(表1中VgDGAT1A引物,10 nmol·L-1),10 μL 2×Taq PCR StarMix混合,1 μL DNA(100 μg·mL-1),7 μL ddH2O,反应在96孔板内进行)。PCR反应程序为:94 ℃ 2min,94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,30个循环,然后利用1%琼脂糖凝胶电泳检测。
表1阳性VgDGAT1A植株检测及其qRT-PCR引物
Table1Primers of qRT-PCR of assays in positiveVgDGAT1A-transgnicsoybeans

引物Primer序列/5’→3’VgDGAT1A-FTGCGACTCATACAGGATTCAACVgDGAT1A-RAAATGTGTCCCTTGGGTTTGTqRT-PCR-FCCACTTGCTGCCTACATTqRT-PCR-RCGAGACGCCTGATAGAACGmActin-FAAGCTGTTCTCTCCTTGTACGCCGmActin-RGCACAGTGTGAGACACACCATCA
1.3 VgDGAT1A在转基因大豆中的异源表达分析
本试验使用Total RNA Extractor试剂盒(BBI Life Science公司)提取总RNA。取大豆种子中期进行取样,在液氮中充分研磨,然后进行总RNA的提取。将所得到的RNA溶液置于-80 ℃保存。使用cDNA Synthesis Kit 反转录试剂盒(Genstar公司)获得cDNA。用2×增强型染料实时荧光定量PCR 预混液(GenStar公司)进行qRT-PCR(反应体系共50 μL,正向和反向引物各1 μL(表1中qRT-PCR引物,10 nmol·L-1),25 μL 2×RealStar Green Power Mixture混合,1 μL cDNA(100 μg·mL-1),1 μL ROX Reference Dye(50×),21 μL RNase-free H2O,反应在96孔板内进行)。内参引物见表1中GmActin。反应程序为:95 ℃ 10 min,95 ℃ 15 s,59 ℃ 1min,72 ℃ 30 s,40个循环。以大豆管家基因Actin做内参,采用2-ΔΔCq来计算目的基因相对表达水平。
1.4 大豆总脂肪酸提取
利用分析天平分别准确称取50 mg粗研的野生型大豆Jack和转基因大豆种子粉末,加入石英砂后充分研磨,研磨后置于50 mL离心管中,加入7.5 mL甲醇∶氯仿(2∶1)溶液,置于37 ℃的摇床抽提24 h,离心后收集上层有机相,剩余的样品残渣再加入7.5 mL甲醇∶氯仿(2∶1)溶液重复抽提12 h并离心收集上层有机相,同理进行第3次抽提后合并3次的有机相。加入5 mL氯仿,9 mL 1%的NaCl溶液,使得最后甲醇∶氯仿∶H2O为2∶2∶1.8,混匀后8 000 r·min-1离心10 min,收集下层有机相到称重的玻璃管中,氮气吹干后称出玻璃管及脂肪酸的总重量。每个样品3次重复。计算方法:总脂含量=(提取后总重-提取前管重)/0.05。
2 结果与分析
2.1 转VgDGAT1A基因大豆阳性植株的检测
以大豆核基因组DNA为模板,PCR检测转VgDGAT1A基因的阳性大豆植株,凝胶电泳分离PCR产物(图1),在第5代材料中,共检测大豆植株2 000株,检测出阳性植株有1 578株,检测通过率78.9%,后续实验选用检测出的VgDGAT1A稳定整合的第6或第7阳性大豆品系。

图1 VgDGAT1A转基因大豆PCR检测。Fig.1 The PCR test for VgDGAIT DNA in the transgenic soybeans注:VgDGAT1A基因片段是1 828 bp,图中“+”为阳性质粒上的目的基因,“-”代表非转基因野生大豆,图中“1~22”代表转基因植株Note:The PCR amplification fragment of VgDGAT1A is 1 828 bp. "+" represents target fragment from positive plasmid, "-" represents wild soybean, "1~22" represents transgenic soybean plants
2.2 VgDGAT1A在大豆种子中的表达分析
检测发育种子总RNA提取质量显示,A260/280范围在1.97~2.01,条带分明,没有明显的弥散带,质量好,可以用于后续cDNA第一链合成及qRT-PCR试验。以野生型大豆Jack为对照,对转VgDGAT1A基因大豆种子发育中期阶段样品进行荧光定量检测(图2)。比较发现,VgDGAT1A基因在大豆种子发育中期高量表达。可见外源基因VgDGAT1A已经在大豆中稳定高效表达。
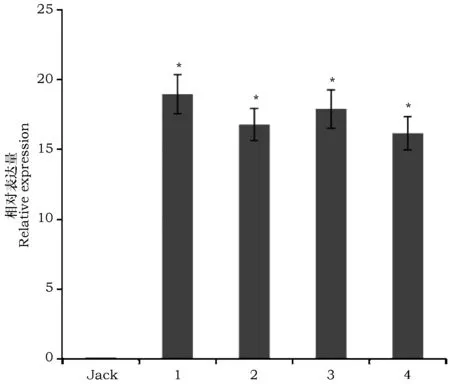
图2 qRT-PCR检测大豆种子发育中期VgDGAT1A基因表达Fig.2 Expression of VgDGAT1A gene by qRT-PCR during mid-period of soybean seed mature process. 注:“Jack”为野生型大豆,“1~4”为转VgDGAT1A大豆不同品系Note:“Jack” represents wild-type soybean and "1~4" represents transgenic VgDGAT1A different soybean lines
2.3 VgDGAT1A转基因大豆种子总油脂含量分析
对7个VgDGAT1A转基因大豆品系和非转基因的野生型大豆Jack大豆种子油脂含量测定结果(图3)显示,转VgDGAT1A基因大豆与野生型(Jack)品种相比,总脂含量均有明显提高(4%~9%),平均提高了5.1%。检测结果表明,外源VgDGAT1A基因转入大豆并高效表达,编码形成的DGAT1酶蛋白能正常行驶功能,且显著增加大豆总油脂(TAG)含量。观察转基因和非转基因大豆种子形态,未见差异(图4)。

图3 转VgDGAT1A大豆与野生型Jack种子油含量Fig.3 Content of seed oil of transgenic and wild-type Jack seed注:“Jack”为野生型大豆,“1~7”为转VgDGAT1A大豆不同品系。Note:"Jack"representy wild-type soybean,"1~7" represents transgenic VgDGAT1A different soybean lines.

图4 转VgDGAT1A大豆与野生型Jack种子表型对比Fig.4 Comparison of phenotypes of seeds of VgDGAT1A and wild type seeds of Jack
3 讨论与结论
早前研究表明,DGAT表达与大豆种子油脂积累速率之间表现出强烈的正相关性[13]。在发育的种子中,DGAT活性的逐渐增强引发了油脂快速积累,DGAT活性逐渐降低的同时油脂含量也逐步稳定[14]。油菜BnDGAT1超表达能显著提高种子总脂肪酸含量[15]。对蓖麻 DGATs 的研究表明,在蓖麻种子油脂的累积高峰期,DGAT1活性增强,油脂含量显著增加[16]。本文对VgDGAT1A转基因大豆阳性植株鉴定表明,经过多年种植,高代转VgDGAT1A基因大豆仍然呈现整合的VgDGAT1A基因稳定遗传。qRT-PCR分析表明,VgDGAT1A基因在大豆种子发育中期的表达量高,VgDGAT1A基因编码的DGAT1亦可正常行使功能,促进TAG合成,导致转VgDGAT1A基因大豆种子含油量显著提高。本文对高代转VgDGAT1A基因大豆种子表型检测与分析,再次证实VgDGAT1A是一个优异的提高种子含油量的基因,亦可用于其他油料作物油脂含量和品质的遗传改良。
植物油脂代谢是一个由多基因参与的,涉及各蛋白酶协同表达和共同运作的高度精密调控的生化过程。Vanhercke 观察到当DGAT1和WRI1共同浸入本氏烟草叶中时,对TAG积累有显着的协同效应,在烟草中通过WRI1与DGAT1 基因协同表达,在油脂含量提升的同时,脂肪酸成分也出现变化,多不饱和脂肪酸含量下降,同时单不饱和脂肪酸含量上升[17]。丁健等发现沙棘果肉高油脂积累源于源基因“GPD1”和汇基因“DGAT1和DGAT2”的协同高表达[18]。崔琴琴发现FAD2和DGAT2共表达能够提高油桐的含油量,同时少量提高亚油酸含量[19]。各种油料作物的DGAT基因研究的逐渐深入,以及更多与植物油脂代谢相关基因的发现,对提高植物油产量和品质具有重要意义。

