酰腙-菲啰啉镨配合物的合成及性质研究
陈凤英,杨妙妙,李晓
(商洛学院化学工程与现代材料学院/陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
酰肼类化合物本身就具有非常强的生物活性,能够在类似人体环境的情况下与生物体中的微量元素反应,因此引起了人们广泛的关注[1]。但是人们在研究的过程中发现,酰肼类化合物分子结构中含有-NH-NH2基团,而-NH-NH2基团本身具有一定的毒性[2],限制了该类化合物的发展。酰腙化合物是通过酰肼的氢原子与醛或酮的氧原子发生亲核加成反应后再失去水的产物。由于酰腙分子中不存在-NH2基团,其代谢产物均是低毒或无毒[3-4]。国内外研究者通过对酰腙类化合物进行全面的研究,发现酰腙类化合物具有很好的生物活性,如对肿瘤、癌症的抑制作用[5-7]等。1,10-菲啰啉分子存在着大的共扼体系,具有良好的分子内和分子间电子传递和能量传递能力,能够与多种金属离子结合形成稳定的配位化合物,具有十分丰富的配位化学内容[8-10]。为此,本文合成了2-羰基丙酸-4-硝基苯甲酰腙及1,10-菲啰啉与镨的配合物,通过紫外光谱法研究了配合物与BSA在不同温度下的结合常数,并讨论了铜离子对配合物与BSA结合常数的影响。
1 实验部分
1.1 主要仪器与试剂
2-羰基丙酸-4-硝基苯甲酰腙为实验室合成,硝酸镨由氧化镨与硝酸反应结晶制得。1,10-菲啰啉、乙醇、甲醇、硫酸铜、三羟甲基氨基甲烷(Tris)、N,N-二甲基甲酰胺(DMF)均为分析纯试剂,BSA为生化试剂。
集热式恒温加热磁力搅拌器、电热恒温鼓风干燥箱、数控超声波清洗机、傅里叶变换红外光谱仪、热分析仪、红外干烘箱、紫外可见光谱仪、电子天平等。
1.2 酰腙-菲啰啉镨配合物的制备
用10 mL蒸馏水溶解1 mmol Pr(NO3)3·6H2O得到硝酸镨溶液,称取2 mmol 2-羰基丙酸-4-硝基苯甲酰腙和2 mmol 1,10-菲啰啉用50 mL乙醇溶解得到配体溶液,然后在不断搅拌下将硝酸镨溶液缓慢滴加到配体溶液中,80℃水浴加热反应6 h。将反应液冷却,过滤、洗涤得到配合物的粗产品,再用甲醇重结晶得到酰腙-菲啰啉镨配合物。
1.3 配合物与BSA的相互作用
称取一定量酰腙-菲啰啉镨配合物放入烧杯,加入少量的DMF使其完全溶解,将其转入25 mL容量瓶中,用蒸馏水定容至刻度配制成浓度为2.0×10-4mol·L-1的配合物溶液。
称取一定量的Tris和NaCl,用蒸馏水配制成pH=7.4 的含有0.1 mol·L-1NaCl的 0.1 mol·L-1的Tris-HCl缓冲溶液。
称取0.033 0 g BSA,溶于50 mL容量瓶中,用Tris-HCl缓冲溶液溶解定容,得到1×10-5mol·L-1的BSA溶液,于4℃冰箱中保存。
称取0.025 0 g CuSO4·5H2O,用蒸馏水先配制成 1×10-3mol·L-1的硫酸铜溶液,取 1 mL 稀释至 100 mL,得到 1×10-5mol·L-1的硫酸铜溶液。
在编号为1~12的10mL比色管中依次按照表1中比例加入1×10-5mol·L-1BSA溶液和配合物溶液,加Tris-HCl溶液定容至5 mL,摇匀,分别在25℃和37℃下反应30 min,以pH=7.4的Tris-HCl溶液为空白,测定不同溶液的紫外可见光谱。
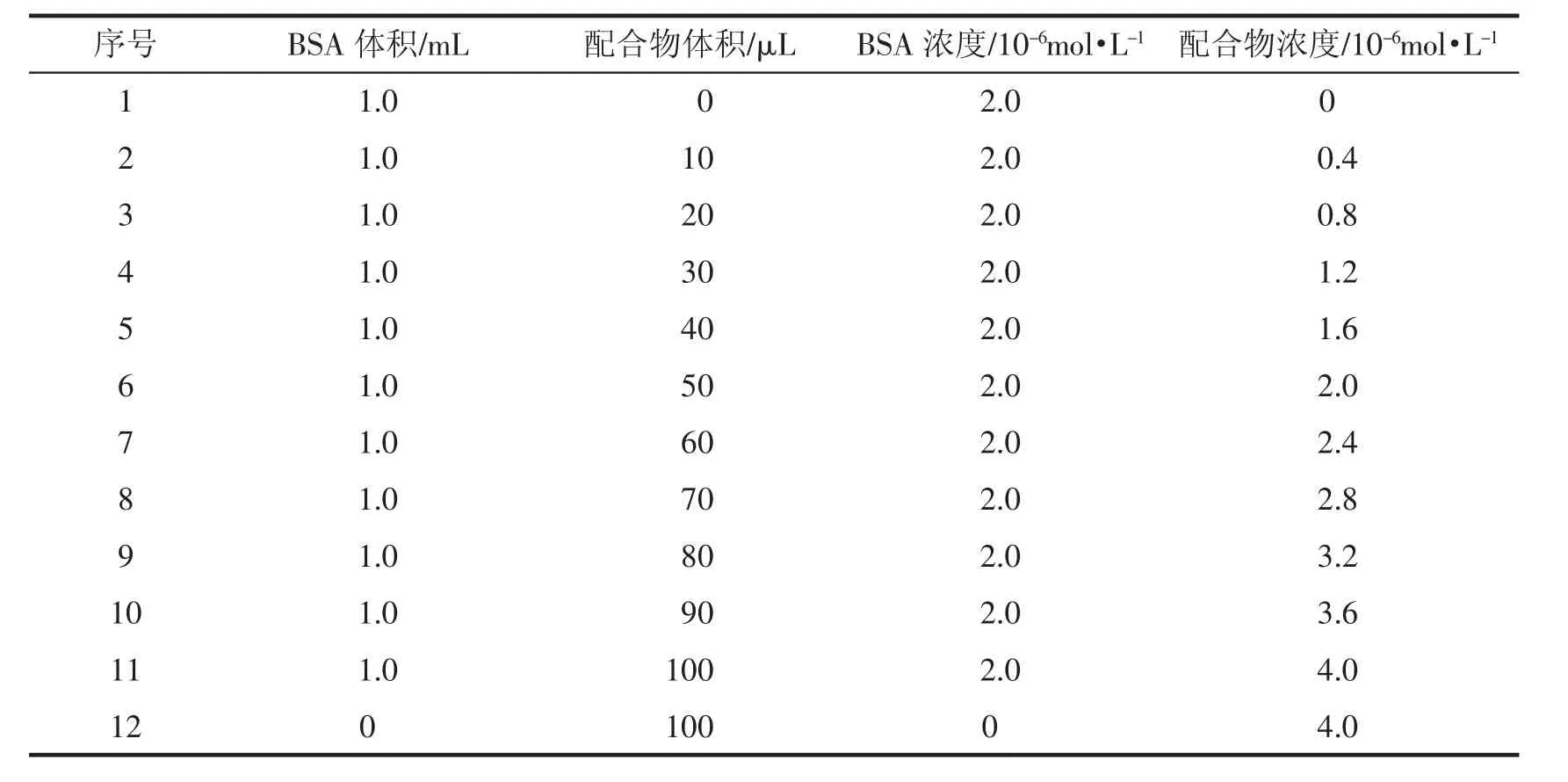
表1 溶液的配制比例
1.4 共存金属离子对配合物与BSA的相互作用的影响
在编号为1~12的10 mL比色管中按照表1中比例加入BSA溶液、配合物溶液和1 mL硫酸铜溶液,用Tris-HCl溶液定容至5 mL,摇匀,在37℃下反应30 min,以pH=7.4的Tris-HCl溶液为空白,测定不同溶液的紫外可见光谱,考察共存铜离子对配合物与BSA的相互作用的影响。
2 结果与讨论
2.1 配合物的红外光谱
在波数为4 000~400 cm-1,采用KBr压片法测试了酰腙-菲啰啉镨配合物的红外光谱,所得谱图如图1所示。配合物的红外光谱图在3 500 cm-1出现了一个较宽的峰,此峰可归属为水分子中O-H键的伸缩振动,说明配合物中存在着水分子。C=O和C=N的伸缩振动分别出现在1 350 cm-1和1 580 cm-1附近,说明酰基氧原子和亚氨基氮原子与镨离子发生了配位,同时在780 cm-1和800 cm-1出现了Pr-O和Pr-N键的振动峰,进一步证明配体与镨离子发生了配位[11],形成了金属配合物。

图1 酰腙-菲啰啉镨配合物的红外光谱
2.2 配合物的热稳定性分析
在N2气氛中以10℃·min-1的升温速率测试了配合物从室温到800℃的温度范围内的热重曲线,测试结果如图2所示。配合物在室温~100℃失重率约5%,此为失去配合物中的少量吸附水,100℃~150℃失重率约为6%,推测此阶段分解的是2个结晶水分子和1个OH-,理论失重率6.25%,说明配合物中有水分子存在,这与红外光谱相吻合。150℃~220℃配合物的重量维持在一个水平,说明在此区间内,配合物未发生分解。220℃~350℃配合物失重率约为20%,此处失去的为1,10-菲啰啉,理论失重率21.2%。350℃~800℃阶段对应为酰腙配体的缓慢分解。
根据红外光谱分析和热重曲线分析,推测该配合物分子式为PrC32H29O13N8,结构如图3所示。

图2 酰腙-菲啰啉镨配合物的热重

图3 酰腙-菲啰啉镨配合物的结构
2.3 配合物与BSA的结合常数
紫外光谱可以用来测定小分子药物与蛋白质大分子的结合常数,小分子药物与蛋白质大分子的结合方式可以近似表示为:

其中KA为结合常数,KD为解离常数

[P]是游离受体蛋白质大分子的浓度,[Q]是小分子药物的浓度,[QP]是小分子药物与蛋白质大分子结合物浓度,[P]0是蛋白大分子总浓度,[P]0=[P]+[QP]。
由此可得:

当生成物QP没有紫外吸收时,游离蛋白大分子的浓度分别可用相应的紫外吸收强度表示为:

经整理(3)式、(4)式得:

以(A-A0)-1对[Q]-1作Lineweaver-Burk双倒数曲线图,可由该图的斜率和A0可求得配合物与BSA的结合常数KA。
图4是配合物在25℃和37℃时与BSA相互作用拟合得到的Lineweaver-Burk双倒数曲线图。由图4的拟合结果可知,在25℃时,线性方程为 y1=0.761 96+2.392 05×10-7x,在 37 ℃时线性方程为y2=0.715 10+2.052 48×10-7x,通过计算可得在25℃和37℃时,配合物与BSA的结合常数分别为 3.19×106L·mol-1和 3.48×106L·mol-1,表明配合物与BSA的结合常数随着温度的升高增大。

图4 配合物与BSA相互作用的双倒数
2.4 铜离子对配合物与BSA的结合常数的影响
本文选用铜离子为研究对象,在模拟人体温度37℃时,测定其对配合物与BSA结合常数的影响,测试所得双倒数曲线见图5。
由图5可知,在铜离子存在下,配合物与BSA相互作用的双倒数线性方程为y=0.746 33+2.344×10-7x,结合常数 KA分别为 3.184×106L·mol-1小于37℃下无铜离子存在时的结合常数KA=3.48×106L·mol-1。可能是由于铜离子与配合物之间存在一定的竞争效应,从而减弱了配合物与BSA的结合能力。

图5 铜离子存在下配合物与BSA相互作用的双倒数
2.5 配合物与BSA结合的作用力类型
小分子与生物大分子的作用力类型包括范德华力、静电引力、氢键、疏水作用等。在保持温度和压力不变的情况下,生物大分子与小分子的结合反应能否自发进行取决于结合前后体系的吉布斯自由能的变化量△G、体系焓的变化量△H以及体系熵的变化量△S。如果△G<0,△H<0,△S>0,或者两者兼有,均有利于结合反应的自发进行。根据大量的实验研究结果发现,疏水作用力使体系的△H和△S变正,氢键结合或范德华力使体系的△H和△S变负,静电作用力使体系的△H≤0和△S>0。当温度变化不大时,△H可以近似地认为不随温度变化,看作一个常数。由热力学公式:

式中:R 为常数(8.314 5 J·mol-1·K-1)。
由(6)式、(7)式、(8)式分别计算在 25 ℃、37 ℃时,配合物与BSA作用过程的热力学参数,结果见表2。

表2 配合物与BSA作用过程的热力学参数
由表2可知,配合物与BSA作用过程的△G<0,即此反应是自发进行的。△H>0且△S>0,可以推断出配合物与BSA的作用力以疏水作用为主。
3 结论
合成了2-羰基丙酸-4-硝基苯甲酰腙、1,10-菲啰啉镨配合物,采用紫外光谱法研究了配合物在25℃和37℃时与BSA的相互作用的结合常数,考察了共存铜离子对其结合常数的影响,结果发现铜离子与配合物之间存在一定的竞争效应,使得配合物与BSA的结合常数下降。配合物与BSA结合的作用力类型研究发现,配合物与BSA的作用力以疏水作用为主。

