特质焦虑对急性心理性应激反应的预测*
彭惠妮 吴健辉 孙小方 关 青 罗跃嘉
特质焦虑对急性心理性应激反应的预测*
彭惠妮1吴健辉1孙小方2关 青1罗跃嘉1
(1深圳大学心理与社会学院, 深圳 518060) (2清华大学工业工程系, 北京 100084)
急性应激反应使得个体在紧急情况下迅速调动心理生理资源, 从而更好地面对当前的挑战。本研究采用特里尔社会应激测试(Trier Social Stress Test, TSST), 以心率和唾液皮质醇为应激反应指标, 在控制了性别、年龄和受教育时间三个人口学变量的条件下, 探讨特质焦虑对急性心理性应激反应的预测作用。结果发现:(1) TSST成功地诱发了被试的应激反应, 表现为心率加快和唾液皮质醇含量升高; (2)分层回归结果显示, 特质焦虑对急性应激状态下的心率变化具有预测作用, 对唾液皮质醇变化的预测效应未达到显著水平。上述结果表明特质焦虑和急性应激反应的快反应指标——交感神经系统——密切相关, 特质焦虑水平越高, 急性应激状态下的交感神经系统反应越小。特质焦虑水平较高的个体可能由于长期的焦虑造成心肌细胞的过度消耗, 从而导致急性应激反应受限。
特质焦虑; 急性心理性应激; 心率; 唾液皮质醇; 预测
1 前言
应激是每个人生活的一部分。在日常生活中, 人们常面临如亲人离世、自然灾害、高考、考研和工作面试等各种威胁和挑战。急性应激源可诱发个体的一系列生理应激反应。交感神经–肾上腺髓质(sympathetic adrenal medulla: SAM)系统和下丘脑–脑垂体–肾上腺皮质(hypothalamus pituitary-adrenal: HPA)轴的活动是应激反应的两个主要生理指标。在急性应激状态下, SAM系统快速激活, 造成心率加快(Allen, Kennedy, Cryan, Dinan, & Clarke, 2014)。研究表明心率是测量应激生理快反应最便捷有效的指标, 在应激研究领域应用广泛(Porges, 1995)。HPA轴的激活速度相对较慢, 伴随其活动的增强, 皮质醇分泌量增加(Sandi & Haller, 2015)。急性应激反应使人们能够快速觉察到危险并调动心理生理资源来应对挑战(de Kloet, Joëls, & Holsboer, 2005)。然而, 过度和持续的应激可能会导致一些不良后果, 例如创伤后应激障碍、抑郁症、焦虑症和精神分裂症等精神疾病和心脑血管疾病等躯体疾病(Sapolsky, 2015; Ventriglio, Gentile, Baldessarini, & Bellomo, 2015)。
不同个体在面对同一个应激源时, 应激反应形式和程度具有很大差异(Kudielka & Wüst, 2010)。近年来, 应激领域的研究逐渐开始聚焦于能够预测应激反应个体差异的因素(Sapolsky, 2015)。一方面, 一些研究采用实验室应激源如TSST, 探讨人口统计学因素(例如性别、年龄与受教育时间)和心理因素(例如人格与认知)与健康个体的应激反应的关系(Bale & Epperson, 2015; Fiocco, Joober, & Lupien, 2007; Novais et al., 2016; Wu et al., 2017)。另一方面, 还有一些研究以自然发生的创伤事件为应激源, 考察在创伤事件发生前所采集的生物因素(例如杏仁核活性与基因)和心理因素(例如人格与认知)与创伤后应激障碍症状或心理应激反应的关系(Admon et al., 2009; Beevers, Lee, Wells, Ellis, &Telch, 2011; Bomyea, Risbrough, & Lang, 2012; Cobb, Lancaster, Meyer, Lee, & Telch, 2017)。
部分研究关注的是特质焦虑和急性应激反应的关系。特质焦虑是一种相对稳定且具有个体差异的焦虑倾向(Spielberger, Gorsuch, & Lusthene, 1970)。已有研究较多关注焦虑障碍如广泛性焦虑障碍、社交恐惧症和惊恐障碍患者的急性心理性应激反应, 但是研究结果并不一致。有研究发现焦虑障碍患者的急性心理性应激反应高于控制组(Gola et al., 2012)或与控制组无差异(Klumbies, Braeuer, Hoyer, & Kirschbaum, 2013), 但也有研究得出了相反的结论(Wichmann, Kirschbaum, Lorenz, & Petrowski, 2017)。对于健康人群, 多数研究发现高特质焦虑者的急性心理性应激反应低于低特质焦虑者。例如, Jezova, Makatsori, Duncko, Moncek和Jakubek (2004)采用特里尔社会应激测试(Trier Social Stress Test, TSST )中的公众演讲任务, 选取健康男性作为被试, 发现与低特质焦虑组相比, 高特质焦虑组的SAM系统的肾上腺素和去甲肾上腺素反应水平较低; HPA轴激素(促肾上腺皮质激素、血浆皮质醇和唾液皮质醇)反应水平也较低。Villada, Hidalgo, Almela和Salvador (2014)的研究同样采用TSST作为急性应激源, 也发现高特质焦虑组的唾液皮质醇反应水平低于低特质焦虑组。然而, Wirtz等(2007)的研究发现中年男性的特质焦虑水平与唾液皮质醇应激反应不相关。
目前关于健康人群的特质焦虑与急性心理性应激反应关系的研究中, 大部分研究是依据量表测得的特质焦虑分数进行高低分组, 将特质焦虑作为类别变量来分析(Jezova et al., 2004; Villada et al., 2014)。Haslam, Holland和Kuppens (2012)总结了近20年的类别测量学(Taxometric)研究, 发现多数正常人格和精神疾病为连续变量而非间断的类别变量, 正常人格和人格障碍可能不存在类别群(Taxa)。比如, 社交焦虑障碍(Boyers et al., 2017)、广泛性焦虑障碍(Kertz, Mchugh, Lee, & Björgvinsson, 2014)和焦虑敏感性(Asmundson, Weeks, Carleton, Thibodeau, & Fetzner, 2011)都是连续性结构而非类别结构。对特质焦虑进行全范围连续的分析可提供较多信息以产生更大的统计效力和较小的参数估计偏差(Steudte-Schmiedgen et al., 2015)。
不同的研究采用的应激反应指标不同, 而这些应激反应指标反映了应激反应的不同方面(Kloet et al., 2005)。急性应激源可诱发一系列生理反应, 包括代表快反应的SAM系统和代表慢反应的HPA轴。研究表明, 为应对威胁或潜在威胁情境和恢复内稳态, SAM系统和HPA轴可充分调动资源, 进而发挥重要作用(Kloet et al., 2005)。然而, 目前多数研究只测量了其中一个生理指标, 例如Villada等(2014)和Wirtz等(2007)的研究仅测量了HPA轴的唾液皮质醇变化来反映急性心理性应激反应水平。本研究拟同时采用快反应指标——交感神经系统的心率变化和慢反应指标——HPA轴的唾液皮质醇变化来反映急性心理性应激反应水平。
本研究将所有健康被试的特质焦虑分数作为连续变量, 采用急性应激的快反应指标——交感神经系统的心率变化和慢反应指标——HPA轴的唾液皮质醇变化, 探讨特质焦虑对急性心理性应激反应的预测效应。以往研究表明, 性别(Bale & Epperson, 2015; Novais, Monteiro, Roque, Correia-Neves, & Sousa, 2016)、年龄(Novais et al., 2016; Gunnar, Talge, & Herrera, 2009)和受教育时间(Fiocco, Joober, & Lupien, 2007)与急性心理性应激反应存在显著相关关系。比如, 在急性应激状态下, 男性比女性表现出更高的唾液皮质醇反应; 随着年龄的增长, 个体唾液皮质醇反应越高; 受教育时间与唾液皮质醇反应呈负相关关系。然而, Jezova等(2004)的研究中选取的被试均为男性, 虽然在年龄方面进行了控制, 但未控制受教育时间。本研究拟在控制这三个人口学变量的条件下探讨特质焦虑对急性心理性应激反应的预测作用。根据之前相关研究结果(Jezova et al., 2004; Villada et al., 2014), 提出如下假设:特质焦虑水平可负向预测急性心理性应激反应, 即特质焦虑水平越高, 急性心理性应激反应越小。
2 方法
2.1 被试
通过张贴广告的方式从北京市的高校招募被试, 招募的要求为:(1)在校大学生, 年龄为18~28岁; (2)身体健康。然后通过电话采访以筛选被试, 被试排除的标准为:(1)精神或神经疾病史; (2)内分泌紊乱疾病史(如库欣综合征等); (3)其它重大慢性生理疾病史, 如糖尿病、心脏病、脑膜炎、严重肾脏病、恶性肿瘤、癫痫和偏头痛等; (4)脑部损失病史(如经历过脑部手术、脑出血和严重脑部创伤等); (5)长期服用抗精神病药物、神经类药物或肾上腺皮质激素类药物; (6)正在怀孕; (7)生活作息长期昼夜颠倒; (8)近6个月接受过重要手术; (9)酗酒(每天摄入次数大于2次), 吸烟过度(每天吸食大于5支)。最终正式参与实验的被试为54人, 其中男性35人, 女性19人, 年龄18~25岁(平均年龄22.57 ± 1.67岁), 受教育时间13~18年(平均受教育时间15.89 ± 1.34年)。参与正式实验的被试均填写知情同意书, 实验结束后获得一定报酬。
2.2 实验流程
实验均在下午1点30分至5点之间进行, 此时间段内的唾液激素(salivary hormone) (例如皮质醇)处于一天内的较低水平且相对稳定(Nelson, 2005)。实验前一天和被试进行电话联系, 告知他们在实验当天不要进行剧烈运动。实验前, 所有被试都报告自己已遵照主试的上述所有要求。被试到达实验室后, 首先安坐在沙发上30分钟, 期间填写人口统计学问卷(年龄、性别和受教育时间等)和特质焦虑量表(Trait Anxiety Inventory, T-AI)。休息结束后, 采集唾液样本和记录心率(时间点:基线)。然后, 被试完成TSST。TSST包括准备阶段、演讲阶段和数学心算阶段各5分钟, 在各个阶段分别进行持续的心率记录。TSST结束后立即采集唾液样本和记录心率(持续记录5分钟) (时间点:1)。在TSST任务开始后第35分钟(时间点:2), 第60分钟(时间点:3)和第75分钟(时间点:4)进行同样的唾液采集和心率记录工作。实验流程和数据收集时间详见图1。
2.3 量表材料
状态–特质焦虑问卷(State-Trait Anxiety Inventory, STAI)由 Spielberger和Gorsuch (1983)编制,本研究选用STAI中文版的特质焦虑分量表(T-AI) (汪向东, 王希林, 马弘, 1999), 包括20个条目, 采用4点评分法:1-几乎没有、2-有些、3-经常、4-几乎总是如此, T-AI总分反映了受试者一贯或平时的焦虑情况。
2.4 应激诱发
TSST是由Kirschbaum和他的合作者在1993年创设的一种心理性应激测试手段(Kirschbaum, Pirke, & Hellhammer, 1993)。研究发现修改版TSST可同样有效或甚至比原版TSST更有效地诱发应激反应(Buchanan, Bagley, Stansfield, & Preston, 2012)。因此本研究采用修改版TSST来诱发被试的应激反应。修改版TSST由准备(5分钟)、演讲(5分钟)和数学心算任务(5分钟)三部分构成。主试给予被试演讲任务的指导语, 引导被试想象他正在一间商店购物时被商店的保安指控偷窃, 他必须在商店经理面前为自己辩护。这一任务与原版TSST的模拟工作面试任务不同。准备阶段, 被试在一个房间限时5分钟进行准备, 允许用纸笔做记录, 但是演讲时笔记会被收走。主试告知被试将有摄像机对其整个演讲过程进行录像, 以便后期进行分析, 在他演讲的过程中, “经理”等人会做记录并以此对他进行评价。准备结束后, 主试将被试带到另外一个房间, 让被试站在适当的位置, 调整话筒架的高度, 要求被试全程站立演讲。在房间内坐着由两位女性主试和一位男性主试扮演的经理, 身穿白大褂, 全程保持中性表情, 不提供任何反馈, 当被试无话可说时, 主试需要提问。演讲结束后, 被试紧接着完成数学心算任务。在该任务中, 要求被试从数字1022开始, 连续减数字13, 只需要出声报告心算结果, 心算过程不必出声。若报告的心算结果错误, 被试需要从1022重新开始心算。
2.5 应激反应测量
2.5.1 唾液采集
采用唾液采集管(salivette; Sarstedt, Rommelsdorf, Germany)来收集唾液。采集后的唾液样本冷藏于–22℃的冰柜中。分析前, 将唾液样本溶解后在3000 rmp转速下离心10分钟。采用电化学发光免疫法(electrochemiluminescence immunoassay)测定唾液皮质醇浓度(Cobas e 601, Roche Diagnostics, Numbrecht, Germany)。敏感性为0.5 nmol/L (下限)。批内和批间检测变异均小于10%。

图1 实验流程示意图
2.5.2 心率记录
通过Biopac Amplifier-System (MP150; Biopac, Goleta, CA, USA)来记录心率, 三个心电电极分别放置在脖子右侧, 左脚踝内侧和右脚踝内侧。信号采样频率为1000 Hz。采用AcqKnowledge软件对在每个时间点持续记录5分钟的心跳次数分别进行平均, 计算后得到的每分钟心跳的次数(beats per minutes, bpm)相应作为该时间点的心率指标。
2.6 数据分析
将心率和唾液皮质醇反应作为应激反应指标。为了证实TSST的有效性, 采用单因素重复测量方差分析(ANOVA)来检验上述指标在不同时间点上的差异。然后采用Bonferroni在不同时间点之间进行事后比较。在本研究中心率的峰值出现在演讲阶段, 故心率的应激反应指标(△心率)为TSST演讲阶段的平均心率减去基线水平的心率; 唾液皮质醇的峰值出现在TSST开始后35分钟(时间点2), 故唾液皮质醇的应激反应指标(△唾液皮质醇)为TSST开始后35分钟(时间点2)的唾液皮质醇水平减去基线水平的唾液皮质醇。
采用皮尔逊相关的方法分析特质焦虑与急性应激反应的相关关系。然后采用分层回归的方法来分析特质焦虑对急性应激反应的预测作用, 即在控制了对急性心理性应激反应可能有影响的人口统计学变量之后, 考察特质焦虑对急性心理性应激反应的预测效应。具体步骤如下:第一步, 将人口统计学变量性别、年龄和受教育时间作为第一层变量纳入回归方程; 第二步, 将预测变量特质焦虑作为第二层变量纳入上述回归方程。计算两层之间2产生的变化(△2), 以此探讨在除去性别、年龄和受教育时间三者的共同预测影响之后, 特质焦虑预测效应的统计显著性。所有变量进入回归方程的方法均采用强迫法。回归模型的因变量为应激反应(心率和△唾液皮质醇)。
采用SPSS 19.0软件包进行数据处理, 所有报告的值均为双侧检验, 显著性水平设置为0.05。
3 结果
3.1 应激反应
TSST诱发的生理反应(心率和唾液皮质醇)的平均值和标准差见表1。
3.1.1 心率应激反应
心率的峰值出现在演讲阶段。△心率的平均值为16.3 bmp, 标准差为12.1。对各个时间点的心率进行单因素重复测量方差分析显示, 时间主效应显著,(7, 371) = 25.12,< 0.001,hp2= 0.29。事后比较分析显示在TSST演讲期间和心算期间的心率均显著高于基线、准备阶段和其他所有时间点的心率(s< 0.01)。演讲期间的心率与心算期间的心率差异不显著(= 0.835)。TSST开始后15分钟(时间点1)、35分钟(时间点2)、60分钟(时间点3)、75分钟(时间点4)的心率均与基线水平的心率差异不显著(s> 0.05)。心率的变化趋势见图2。

图2 应激前中后各个时间点的心率(±SD)
3.1.2 唾液皮质醇应激反应
唾液皮质醇的峰值出现在TSST开始后35分钟(时间点2)。△唾液皮质醇的平均值为5.92 nmol/L, 标准差为5.85。对各个时间点的唾液皮质醇含量进行单因素重复测量方差分析显示, 时间主效应显著,(4, 212) = 19.01,< 0.001,hp2= 0.22。事后比较分析显示TSST开始后35分钟(时间点2)的唾液皮质醇水平显著高于其他所有时间点(s< 0.01)。TSST开始后15分钟(时间点1), 35分钟(时间点2)和60分钟(时间点3)的唾液皮质醇水平显著高于基线和TSST开始后75分钟(时间点4)的唾液皮质醇水平(s< 0.05)。唾液皮质醇的变化趋势见图3。

表1 不同时间点心率和唾液皮质醇[M(SD)]
3.2 特质焦虑与应激反应的相关分析
特质焦虑与心率急性应激反应负相关(= –0.32,< 0.05), 与唾液皮质醇急性应激反应相关不显著(= –0.06,= 0.68)。(特质焦虑与心率急性应激反应的简单相关散点图见图4)
3.3 特质焦虑与应激反应的回归分析
每个应激反应回归模型的具体结果见表2。
3.3.1 心率应激反应的回归模型
第一层人口统计学变量模型边缘显著,(2, 51) = 2.40,= 0.078。其中受教育时间可正向预测心率应激反应(β = 0.55,< 0.05), 可单独解释11.50%的心率应激反应的方差变异量。第二层预测变量模型显著,(2, 51) = 3.85,< 0.05。加入特质焦虑预测变量后, 解释心率应激反应的方差变异量增加了11%。特质焦虑可负向预测心率应激反应(β = –0.35,< 0.05)。
3.3.2 唾液皮质醇应激反应的回归模型
唾液皮质醇应激反应模型中第一层模型((2, 51) = 0.35,= 0.792)和第二层模型((2, 51) = 0.27,= 0.898)均不显著, 模型中所有变量对唾液皮质醇应激反应的预测效应均未达到显著水平(s> 0.05)。
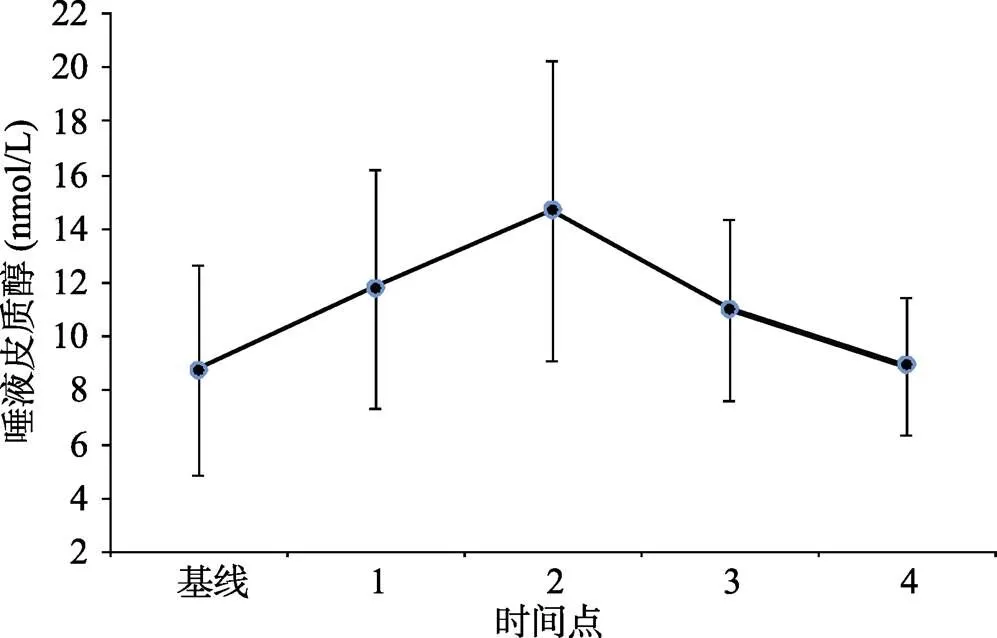
图3 应激前中后各个时间点的唾液皮质醇(±SD)

图4 特质焦虑与心率急性应激反应的简单相关散点图

表2 应激反应分层回归模型
4 讨论
本研究选取健康人群为被试, 采用TSST为应激诱发手段, 以客观的心率和唾液皮质醇为急性应激反应指标, 将特质焦虑作为连续变量而非类别变量, 在控制了性别、年龄和受教育时间三个人口统计学变量的条件下, 探讨特质焦虑对急性心理性应激反应的预测作用。结果显示:TSST成功地诱发了被试显著的应激反应, 表现为心率加快和唾液皮质醇含量升高。这一结果与以往采用TSST技术的研究结果基本一致(Kirschbaum et al., 1993; Villada et al., 2014)。杨娟、侯燕、杨瑜和张庆林(2011)的研究发现TSST可诱发中国被试显著的急性应激反应, 证明了TSST对中国人群也适用。本研究结果再次证实了这一结论。本研究最重要的结果是, 特质焦虑水平越高, 心率急性应激反应越低, 而特质焦虑对唾液皮质醇急性应激反应没有显著的预测效应。
本研究结果表明, 特质焦虑水平可负向预测急性应激状态下的心率反应, 即特质焦虑水平越高, 急性应激源诱发的交感神经反应越小。该结论与Jezova等(2004)的结论一致, 虽然Jezova等(2004)的研究采用的指标是肾上腺素和去甲肾上腺素, 但是这些指标也可体现SAM系统在急性应激状态下的反应。此外, 研究表明对特质焦虑进行全范围连续的分析可提供较多信息以产生更大的统计效力和较小的参数估计偏差(Steudte-Schmiedgen et al., 2015)。然而, 以往大部分关于特质焦虑与急性心理性应激反应关系的研究并未将特质焦虑作为连续变量进行分析, 而是依据被试的特质焦虑分数进行分组(Jezova et al., 2004; Villada et al., 2014)。本研究的创新之处不但在于采用了更易采集的心率指标, 而且把特质焦虑作为连续变量进行分析。尤为重要的是, 虽已有不少研究表明, 性别、年龄和受教育时间等因素与急性心理性应激反应密切相关(Bale & Epperson, 2015; Fiocco, Joober, & Lupien, 2007; Gunnar, Talge, & Herrera, 2009; Novais et al., 2016), 但是以往关于特质焦虑与急性心理性应激反应关系的研究中, 并未全面地控制这几个人口学变量, 而本研究结果是在控制了上述人口学因素后得到的。
关于特质焦虑与心率急性应激反应呈负相关关系的机理, 一种可能的解释是, 高特质焦虑个体的β-肾上腺素受体反应性减小。研究者发现焦虑障碍患者如惊恐障碍患者的β-肾上腺素受体反应性减小(Brown, Charney, Woods, Heninger, & Tallman, 1988); 同时, 研究者在生活长期处于极度应激状态(Dimsdale, Mills, Patterson, Ziegler, & Dillon, 1994)和在心境状态量表的紧张–焦虑维度得分较高(Yu, Dimsdale, & Mills, 1999)的健康人群中也发现了β-肾上腺素受体反应性减小的现象。其机制可能是长期的焦虑引起了血浆去甲肾上腺素等儿茶酚胺类激素含量增高(Axelrod & Reisine, 1984), 使得β-肾上腺素受体长时间持续兴奋, 这造成了心肌细胞的过度消耗和凋亡(Bisognano et al., 2000), 从而进一步导致在急性应激状态下β-肾上腺素受体的反应性出现代偿性的减小(Young, Nesse, Weder, & Julius, 1998)。而分布在心肌细胞上的β-肾上腺素受体激发后, 对心肌产生正性作用, 导致心肌兴奋, 比如收缩加剧、心脏射血速度加快、心率上升等, 以应对当前的紧急情况, 并进行“战斗或逃跑” (Grimm & Brown, 2010)。据此推测, 高特质焦虑者的β-肾上腺素受体反应性的减小造成了交感神经急性应激反应的降低。这种降低可能阻碍了急性应激状态下交感神经资源的快速调动, 从而不利于紧急情况下的快速应对。
另一种可能的解释是, 特质焦虑与心率急性应激反应存在相关关系可能是由于两者具有相同的遗传途径。5-羟色胺转运体基因连锁多态性区域(5HTTLPR)对于中枢/周围神经系统的血清素含量及其效应具有重要的决定性作用, 与情绪调节和生理反应密切相关(Phillips, Hunt, Der, & Carroll, 2011)。研究发现携带5HTTLPR长等位基因的个体不仅具有较高的特质焦虑水平, 对实验室应激任务也表现出较低的血压和心率反应(Williams et al., 2008)。因此, 携带5HTTLPR长等位基因可能是较高特质焦虑和较低心率急性应激反应发生关联的机制所在。
本研究中TSST成功地诱发了被试的唾液皮质醇应激反应, 但未发现特质焦虑对唾液皮质醇应激反应的预测作用。该结果与同样采用TSST且将被试的特质焦虑分数作为连续变量的Wirtz等(2007)的研究结果一致, 但与Jezova等(2004)和Villada等(2014)的研究结果不一致。Jezova等(2004)和Villada等(2014)的研究均是依据量表所测的特质焦虑分数进行高低分组, 将特质焦虑作为类别变量来分析。此外, Jezova等(2004)的研究中选取的被试均为男性, 虽然控制了年龄但没有控制受教育时间。与这两个研究不同的是, 本研究将特质焦虑作为连续变量, 以健康男性和女性为被试, 控制了性别、年龄和受教育时间三个人口学变量。这些人口学和方法学的差异, 可能导致了不同实验室之间研究结果的差异。这也说明, 特质焦虑和急性应激的慢反应(HPA轴活动)之间的关系可能不是单维的, 可能有更多的因素共同参与了两者的关系。此外, 研究发现不同的人格特质与应激反应系统的不同成分(HPA轴与SAM系统)相关(Puig-Perez et al., 2015)。Chida和Hamer (2008) 的元分析研究(161项关于健康人群的急性应激反应的实证研究)发现消极心理特质或状态如特质焦虑、敌意和神经质等与交感神经急性应激反应(心率)相关, 但与HPA轴(唾液皮质醇)急性应激反应不相关。反之, 积极心理特质或状态如乐观、自我提升和幸福感等与HPA轴急性应激反应相关, 而与交感神经急性应激反应不相关。因此, 作为消极心理特质的特质焦虑对心率应激反应具有预测作用, 而对唾液皮质醇应激反应不具有预测效应。
本研究结果显示特质焦虑对心率应激反应和唾液皮质醇应激反应的预测作用并不一致。前人研究已经证明, 应激状态下SAM系统和HPA轴的反应机制和功能是相互独立的(de Boer, De Beun, Slangen, & van Gugten, 1990)。SAM系统是应激的快反应系统, 在该系统内肾上腺髓质受交感神经支配, 在急性应激状态下, 这一系统可被立即激活(Rimmele et al., 2007)。HPA轴是应激的慢反应系统, 元分析研究(173项采用TSST技术的实证研究)发现皮质醇的峰值不会出现在任何时间点, 皮质醇的峰值广泛地分布于TSST结束后20至30分钟(即TSST开始后35至45分钟) (Goodman, Janson, & Wolf, 2017)。这两种反应机制相互协作, 共同应对紧急情况下的挑战。本研究结果也进一步说明, 关于急性应激反应的研究应同时采用SAM系统和HPA轴的指标, 这样才能体现急性应激反应的全貌。
本研究结果表明受教育时间可正向预测心率应激反应, 该结果与Fiocco等(2007)的研究结果相反。其原因可能是Fiocco等(2007)的研究控制了不同受教育时间组的自尊水平, 而本研究未对个体的自尊水平进行控制。李松桃、王明月、陈菲菲和毕重增(2016)的研究采用中国人群为被试, 发现受教育时间越长, 自尊水平越高。同时, 有研究同样采用TSST作为应激源, 发现中国被试的自尊水平与心率急性应激反应正相关(陈禹等, 2014)。据此推测, 可能由于受教育时间较长者的自尊水平较高, 导致其交感神经急性应激反应升高。这种升高可促进快速调动心理生理资源, 以使个体更好地应对挑战, 从而满足受教育时间较长者的较高社会认可需求。
本研究的局限性:(1)本研究的被试样本选自大学生群体, 不能推广到其他人群。(2)动物研究发现应激与行为的关系呈倒U型(inverted-U)曲线, 不同强度的应激水平可能与心理行为具有不同的相互关系(Sapolsky, 2015)。由于伦理限制, 人类研究的实验室应激诱发手段仅可诱发低中等强度应激反应(Wu & Yan, 2017)。虽然已有探讨特质焦虑与自然发生的重大应激源所诱发的应激反应关系的研究, 但是这些研究均只采用创伤后应激障碍症状或主观情绪反应作为应激反应指标(Cobb et al., 2017; Shell, Gazelle, & Faldowski, 2014), 而主观报告法中个体对问卷项目的解释可能存在偏差(Compton et al., 2008)。因此, 建议在以后的工作中加入客观的生理指标, 以提高对重大应激源所致的严重应激反应测量的效度。
5 结论
总而言之, 本研究发现特质焦虑对急性心理性应激的交感神经系统反应有显著的预测作用, 即特质焦虑水平越高, 急性心理性应激源所诱发的交感神经反应越小。这一发现为紧急情况下个体的应激反应提供了科学的预测指标。未来研究可采用追踪研究的方法, 探讨个体非应激状态下的心理特质对自然发生的生活事件所引发的应激反应(生理和心理)的预测效应。
Admon, R., Lubin, G., Stern, O., Rosenberg, K., Sela, L., & Ben-Ami, H., Hendler,T. (2009). Human vulnerability to stress depends on amygdala's predisposition and hippocampal plasticity.(33), 14120–14125.
Allen, A. P., Kennedy, P. J., Cryan, J. F., Dinan, T. G., & Clarke, G. (2014). Biological and psychological markers of stress in humans: Focus on the Trier social stress test., 94–124.
Asmundson, G. J. G., Weeks, J. W., Carleton, R. N., Thibodeau, M. A., & Fetzner, M. G. (2011). Revisiting the latent structure of the anxiety sensitivity construct: More evidence of dimensionality.(1), 138–147.
Axelrod, J., & Reisine, T. D. (1984). Stress hormones: Their interaction and regulation.(4648), 452.
Bale, T. L., & Epperson, C. N. (2015). Sex differences and stress across the lifespan.(10), 1413–1420.
Beevers, C. G., Lee, H. J., Wells, T. T., Ellis, A. J., & Telch, M. J. (2011). Association of predeployment gaze bias for emotion stimuli with later symptoms of PTSD and depression in soldiers deployed in Iraq.(7), 735–741.
Bisognano, J. D., Weinberger, H. D., Bohlmeyer, T. J., Pende, A., Raynolds, M. V., & Sastravha, A., … Port, D. J. (2000). Myocardial-directed overexpression of the human β1-adrenergic receptor in transgenic mice.(5), 817.
Bomyea, J., Risbrough, V., & Lang, A. J. (2012). A consideration of select pre-trauma factors as key vulnerabilities in PTSD.(7), 630–641.
Boyers, G. B., Broman-Fulks, J. J., Valentiner, D. P., McCraw, K., Curtin, L., & Michael, K. D. (2017). The latent structure of social anxiety disorder and the performance only specifier: A taxometric analysis.(6), 507–521.
Brown, S. L., Charney, D. S., Woods, S. W., Heninger, G. R., & Tallman, J. (1988). Lymphocyte β-adrenergic receptor binding in panic disorder.(1), 24–8.
Buchanan, T.W., Bagley, S.L., Stansfield, R.B., & Preston, S.D. (2012). The empathic, physiological resonance of stress.(2), 191–201.
Chen, Y., Ren, G. F., Li, H. J., Yang, Y., Guan, L. L., Hu, X. Y., & Yang, J. (2014). The relationship between self-esteem and psychosocial stress response:The mediating role of the need for social approval.(4), 435–441.
[陈禹, 任国防, 李海江, 杨瑜, 关丽丽, 胡新雨, 杨娟. (2014). 自尊与心理性应激反应的关系: 社会认可需求的中介作用.(4), 435–441.]
Chida, Y., & Hamer, M. (2008). Chronic psychosocial factors and acute physiological responses to laboratory-induced stress in healthy populations: a quantitative review of 30 years of investigations. P(6), 829–885.
Cobb, A. R., Lancaster, C. L., Meyer, E. C., Lee, H.-J., & Telch, M. J. (2017). Pre-deployment trait anxiety, anxiety sensitivity and experiential avoidance predict war-zone stress-evoked psychopathology.(3), 276–287
Compton, R. J., Robinson, M. D., Ode, S., Quandt, L. C., Fineman, S. L., & Carp, J., 2008. Error-monitoring ability predicts daily stress regulation.(7), 702–708.
de Boer, S. F., de Beun, R., Slangen, J. L., & van Gugten, G. J. (1990). Dynamics of plasma catecholamine and corticosterone concentrations during reinforced and extinguished operant behavior in rats.(4), 691–698.
de Kloet, E. R., Joëls, M., & Holsboer, F. (2005). Stress and the brain: From adaptation to disease.(6), 463–475.
Dimsdale, J. E., Mills, P., Patterson, T., Ziegler, M., & Dillon, E. (1994). Effects of chronic stress on beta-adrenergic receptors in the homeless.(4), 290–295.
Fiocco, A. J., Joober, R., & Lupien, S. J. (2007). Education modulates cortisol reactivity to the Trier social stress test in middle-aged adults.(8–10), 1158–1163.
Gola, H., Engler, H., Schauer, M., Adenauer, H., Riether, C., & Kolassa, S., … Kolassa,I. T. (2012). Victims of rape show increased cortisol responses to trauma reminders: A study in individuals with war- and torture-related PTSD.(2), 213–220.
Goodman, W. K., Janson, J., & Wolf, J. M. (2017). Meta-analytical assessment of the effects of protocol variations on cortisol responses to the Trier social stress test., 26–35.
Grimm, M., & Brown, J. H. (2010). β-adrenergic receptor signaling in the heart: Role of camkii.(2), 322–330.
Gunnar, M. R., Talge, N. M., & Herrera, A. (2009). Stressor paradigms in developmental studies: What does and does not work to produce mean increases in salivary cortisol.(7), 953–967.
Haslam, N., Holland, E., & Kuppens, P. (2012). Categories versus dimensions in personality and psychopathology: A quantitative review of taxometric research.(5), 903.
Jezova, D., Makatsori, A., Duncko, R., Moncek, F., & Jakubek, M. (2004). High trait anxiety in healthy subjects is associatedwith low neuroendocrine activity during psychosocial stress.(8), 1331–1336.
Kertz, S. J., Mchugh, R. K., Lee, J., & Björgvinsson, T. (2014). Examining the latent structure of worry and generalized anxiety in a clinical sample.(1), 8–15.
Kirschbaum, C., Pirke, K. M., & Hellhammer, D. H. (1993). The 'Trier Social Stress Test' -- A tool for investigating psychobiological stress responses in a laboratory setting.(1–2), 76–81.
Klumbies, E., Braeuer, D., Hoyer, J., & Kirschbaum, C. (2013). The reaction to social stress in social phobia: Discordance between physiological and subjective parameters.(8), e105670.
Kudielka, B. M., & Wüst, S. (2010). Human models in acute and chronic stress: Assessing determinants of individual hypothalamus-pituitary-adrenal axis activity and reactivity. Stress-the International Journal on the Biology of Stress, 13(1), 1–14.
Li, S.T., Wang, M.Y., Chen, F.F., & Bi, Z.Z. (2006). Development of self-esteem in the elderly: Differences in age, gender and level of education.(9), 2260–2262.
[李松桃, 王明月, 陈菲菲, 毕重增. (2016). 老年自尊的发展: 年龄、性别和受教育水平的差异.(9), 2260–2262.]
Novais, A., Monteiro, S., Roque, S., Correia-Neves, M., & Sousa, N. (2016). How age, sex and genotype shape the stress response., 44–56.
Phillips, A. C., Hunt, K., Der, G., & Carroll, D. (2011). Blunted cardiac reactions to acute psychological stress predict symptoms of depression five years later: Evidence from a large community study.(1), 142–148.
Porges, S. W. (1995). Cardiac vagal tone: A physiological index of stress.(2), 225–233.
Puig-perez, S., Villada, C., Pulopulos, M. M., Almela, M., Hidalgo, V., & Salvador, A. (2015). Optimism and pessimism are related to different components of the stress response in healthy older people.(2), 213–221.
Rimmele, U., Zellweger, B. C., Marti, B., Seiler, R., Mohiyeddini, C., Ehlert, U., & Heinrichs, M. (2007). Trained men show lower cortisol, heart rate and psychological responses to psychosocial stress compared with untrained men.(6), 627–635.
Sandi, C., & Haller, J. (2015). Stress and the social brain: Behavioural effects and neurobiological mechanisms.(5), 290–304.
Shell, M. D., Gazelle, H., & Faldowski, R. A. (2014). Anxious solitude and the middle school transition: A diathesis × stress model of peer exclusion and victimization trajectories.(5), 1569–1583.
Sapolsky, R. M. (2015). Stress and the brain: Individual variability and the inverted-u.(10), 1344–1346.
Spielberger, C. D.,Gorsuch, R. L., & Lusthene, R. E. (1970).. Palo Alto, CA, USA: Consulting Psychologists Press.
Steudte-Schmiedgen, S., Kirschbaum, C., Gao, W., Alexander, N., Schönfeld, S., Hoyer, J., &Stalder, T. (2015). Reply to: Linking hair cortisol levels to phenotypic heterogeneity of posttraumatic stress symptoms in highly traumatized Chinese women.(4), e23–e24.
Ventriglio, A., Gentile, A., Baldessarini, R. J., & Bellomo, A. (2015). Early-life stress and psychiatric disorders: Epidemiology,neurobiology and innovative pharmacological targets.(11), 1379–1387.
Villada, C., Hidalgo, V., Almela, M., & Salvador, A. (2014). Individual differences in the psychobiological response to psychosocial stress (Trier social stress test): The relevance of trait anxiety and coping styles.:(2), 90–99.
Wang, X.D., Wang, X.L., & Ma, H. (1999).(Suppl., pp.205–209). Beijing, China:Chinese Journal of Mental Health.
[汪向东, 王希林, 马弘.(1999).(增订版, pp.205–209). 北京: 中国心理卫生杂志社.]
Wichmann, S., Kirschbaum, C., Lorenz, T., & Petrowski, K. (2017). Effects of the cortisol stress response on the psychotherapyoutcome of panic disorder patients., 9–17.
Williams, R. B., Marchuk, D. A., Siegler, I. C., Barefoot, J. C., Helms, M. J., & Brummett, B. H., … Schanberg, S. M. (2008). Childhood socioeconomic status and serotonin transporter gene polymorphism enhance cardiovascular reactivity to mental stress.(1), 32-39.
Wirtz, P. H., Elsenbruch, S., Emini, L., Rüdisüli, K., Groessbauer, S., & Ehlert, U. (2007). Perfectionism and the cortisol response to psychosocial stress in men.(3), 249–255.
Wu, J., & Yan, J. (2017). Editorial: Stress and cognition., 970.
Wu, J. H., Sun, X. F., Wang, L., Zhang, L., Fernández, G., & Yao, Z. (2017). Error consciousness predicts physiological response to an acute psychosocial stressor in men., 84–90.
Yang, J., Hou, Y., Yang, Y., & Zhang, Q. L. (2011). Impact of Trier social stress test(TSST) on salivary cortisol secretion.(4), 403–409.
[杨娟, 侯燕, 杨瑜, 张庆林. (2011).特里尔社会应激测试(TSST)对唾液皮质醇分泌的影响.(4), 403– 409.]
Young, E. A., Nesse, R. M., Weder, A., & Julius, S. (1998). Anxiety and cardiovascular reactivity in the Tecumseh population.(12 Pt 1), 1727– 1733.
Yu, B. H., Dimsdale, J. E., & Mills, P. J. (1999). Psychological states and lymphocyte β-adrenergic receptor responsiveness.:(1), 147–52.
Trait anxiety predicts the response to acute psychological stress
PENG Huini1; WU Jianhui1; SUN Xiaofang2; GUAN Qing1; LUO Yuejia1
(1College of Psychology and Sociology, Shenzhen University, Shenzhen 518000, China) (2Department of Industrial Engineering, Tsinghua University, Beijing 100084, China)
Recently, An increasing number of studies are focusing on individual differences in response to acute psychological stress. Emerging evidence suggests that personality, especially trait anxiety, might be a significant predictive factor of individual difference in response to acute stress. Most of the previous studies have taken trait anxiety as a categorical (discontinuous)construct. However, a full-range analysis of trait anxiety could result in greater statistical power and less parameter estimation bias. The present study aims to examine whether and how the continuum of trait anxiety scores predict the acute psychological stress response induced by a standardized laboratory stress induction procedure (the Trier Social Stress Test, TSST) while controlling for the potentially confounding factors of gender, age and education years.
A total of 54 healthy students (35 males, 19 females), aged 18~25 years (mean: 22.57 ± 1.67) and educated for 13~18 years (mean: 15.89 ± 1.34), were recruited from universities in Beijing. Several inclusion criteria were employed to control for potential factors influencing the stress response (see 2.1 for details). The acute psychological stress was induced by the TSST and the stress response was measured with heart rate (the index of the response in sympathetic adrenal medulla) and salivary cortisol (the index of the response in hypothalamus pituitary-adrenal). Two hierarchical multiple regression analyses were utilized to study how trait anxiety predicts the heart rate and salivary cortisol response toward stress.
The result showed that the TSST elicited significantly acute psychological stress responses. Specifically, both heart rate and salivary cortisol during the TSST were higher than that measured at any other time points. Regression analysis corroborated that after controlling for gender, age and education years, trait anxiety significantly and negatively predicted heart rate response (β =-0.35,< 0.01), but not salivary cortisol response to acute psychological stress.
The present findings suggest that trait anxiety is a powerful predictor of sympathetic adrenal medulla response, i.e., individuals with higher level of trait anxiety perform lower sympathetic nerve activity in rapid response to acute psychological stress. Individuals with high trait anxiety may experience long-term anxiety in their daily life and chronic consumption of psychophysiological resources, thereby resulting in the limited response to acute stressors.
trait anxiety; acute psychological stress; heart rate; salivary cortisol; predict
2017-09-04
* 国家自然科学基金资助项目:应激下情绪与记忆的认知神经机制(项目批准号:31530031)重点项目; 国家自然科学基金资助项目:社区正常老化及轻度认知障碍的多维评估与实证研究(项目批准号:31571129)面上项目; 国家自然科学基金资助项目:皮质醇觉醒反应预测脑功能(项目批准号:31771246)面上项目。
罗跃嘉, E-mail: luoyj@szu.edu.cn
B845
10.3724/SP.J.1041.2018.00997

