4-甲基-7-芳基-2,1,3-苯并噻二唑的合成方法
郭 杰
(浙江工业大学药学院,浙江 杭州 310014)
0 引言
由于 2,1,3-苯并噻二唑(BTD)具有较强的共平面性、较强的电子亲和势、较好的稳定性和较高的氧化点位,对化合物能隙有较好的调节性[1-2], 因此,2,1,3-苯并噻二唑被广泛作为有机共轭分子并应用于光电材料领域,在液晶、太阳能电池、离子识别材料、有机发光二极管、荧光探针等领域有着广泛的应用[3-5]。在过去几年中,有越来越多的以2,1,3-苯并噻二唑为结构基元的有机小分子材料的相关报道,在有机太阳能电池领域和有机电致发光器件中发挥了很大的作用[6],极大地推动了有机光电材料领域的发展[7]。
1 合成路线介绍
4-甲基-7-芳基-2,1,3-苯并噻二唑是以 3-甲基苯二胺为起始原料制备的,通用方法(Scheme 1):先将化合物1,无水二氯甲烷投入反应容器中,在冰水浴下搅拌30 min,缓慢加入三乙胺,再在0℃下缓慢滴加亚硫酰氯的无水二氯甲烷溶液,将反应在50℃下加热搅拌5 h,待反应液冷却后,加入适量水分液,取有机层,用硫酸钠固体干燥除水,减压浓缩,柱色谱提纯,得到棕色液体化合物2。将化合物2,48%的氢溴酸投入反应容器中,加入液溴的氢溴酸溶液,在120℃下加热回流16 h,待反应液冷却后,加碳酸钠饱和溶液中和反应液,用二氯甲烷萃取,用硫酸钠固体干燥除水,减压浓缩,柱色谱提纯,得到黄色固体化合物3。将化合物3,芳基硼酸,四三苯基膦钯,氟化铯投入反应容器中,加入1,4-二氧六环,反应在120℃下加热回流18 h,待反应液冷却后,加适量水稀释反应液,用乙酸乙酯萃取,用硫酸钠固体干燥除水,减压浓缩,柱色谱提纯,得到化合物4。
2 实验部分
2.1 仪器及试剂
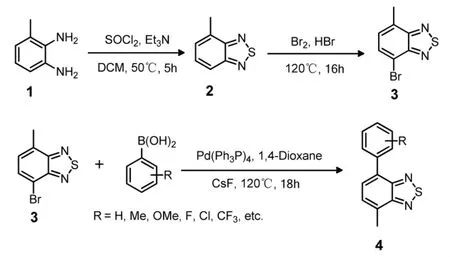
Scheme 1 4-甲基-7-芳基-2,1,3-苯并噻二唑合成路线
熔点用SGWRX-4B熔点仪测定,核磁共振仪为Bruker Model AvanceⅢ500 MHz,以TMS为内标。CDCL3和DMSO-d6作为常用的氘代试剂。薄层色谱使用薄层硅胶板(TLC,烟台江友硅胶),柱层析使用200~300目柱层析硅胶(青岛海洋化工)。所用试剂均为分析级。
2.2 实验操作
2.2.1 4-甲基-2,1,3-苯并噻二唑(2)的合成
取500 mL圆底烧瓶,称取3-甲基苯二胺(10.0 g, 82.0 mmol),无水二氯甲烷(250 mL)加入圆底烧瓶中,在冰水浴下搅拌30 min,缓慢加入三乙胺(45.5 mL, 327.9 mmol),再在 0 ℃下缓慢滴加亚硫酰氯(11.9 mL,163.9 mmol)的无水二氯甲烷溶液(50 mL),将反应在50℃下加热搅拌5 h,待反应液冷却后,加入水(3×200 mL)分液 3次,取有机层,用无水Na2SO4固体干燥,减压浓缩,柱色谱提纯 (PE/EtOAc=10:1),得到棕色液体化合物 2,11.1 g (90%)。
2.2.2 4-溴-7-甲基-2,1,3-苯并噻二唑 (3)的合成
将化合物 2(11.1 mL, 73.8 mmol)和 48%的氢溴酸(250 mL)加入500 mL圆底烧瓶,再加入液溴(3.8 mL,74 mmol)的氢溴酸溶液(50 mL),在120℃下加热回流16 h,待反应液冷却后,加碳酸钠饱和溶液中和反应液,用二氯甲烷 (3×200 mL)萃取3次,取有机层,用无水Na2SO4固体干燥,减压浓缩,柱色谱提纯 (PE/EtOAc=30∶1),得到黄色固体化合物 3,15.5 g(92%)。1H NMR(500 MHz, CDCl3) δ7.74(d, J=7.3 Hz, 1H),7.26(dd, J=7.3,1.3 Hz, 1H),2.71(s,2H).
4-Methyl-7-bromo-2,1,3-benzothiadiazole[8]:1H NMR (500 MHz, CDCl3) δ 7.74 (d, J=7.3 Hz,1H),7.26 (dd,J=7.3,1.3 Hz,1H),2.71(s, 2H).
2.2.3 4-甲基-7-芳基-2,1,3-苯并噻二唑(4)的合成
称取化合物3 (1.1 g,5.0 mmol)、 芳基硼酸(6.0 mmol)、四三苯基膦钯(577.5 mg, 0.5 mmol)、氟化铯 (1.5 g,10.0 mmol) 置于100 mL耐压管中,加入 1,4-二氧六环(30 mL),反应在 120 ℃下加热回流18 h,待反应液冷却后,加水(100 mL)稀释反应液,用乙酸乙酯(3×50 mL)萃取 3次,取有机层,用硫酸钠固体干燥,减压浓缩,柱色谱提纯 (PE/EtOAc=30∶1),得到化合物 4。具体收率见Scheme 2。
4-methyl-7-phenyl-2,1,3-benzothiadiazole (4a):1H NMR (500 MHz, CDCl3) δ 7.92(d,J=7.0 Hz, 2H), 7.62 (d, J=7.0 Hz, 1H),7.54 (t, J=7.7 Hz, 2H), 7.48~7.43 (m, 2H),2.80 (d, J=1.1 Hz, 3H).13C NMR (126 MHz,CDCl3) δ 156.02, 153.50, 137.64, 131.97,130.62, 129.10, 128.56, 128.34, 128.06, 128.00,17.96 (two sp2signal were not observed because of overlapping).
4-methyl-7-(4-methyl)phenyl-2,1,3-benzothiadiazole (4b): 1H NMR (500 MHz,CDCl3)δ 7.82 (d, J=8.2 Hz,2H),7.60 (d, J=7.0 Hz, 1H), 7.44 (dd, J=7.0, 1.2 Hz, 1H),7.37 ~7.33 (m, 2H), 2.79 (d, J=1.3 Hz, 3H),2.46 (s, 3H).13C NMR (126 MHz, CDCl3) δ 156.01, 153.58, 137.94, 134.75, 131.97, 130.22,129.27, 128.95, 128.36, 127.57, 21.26, 17.92(two sp2signal were not observed because of overlapping).
4-methyl-7-(4-chloro)phenyl-2,1,3-benzothiadiazole(4c):1H NMR (500 MHz, CDCl3)δ 7.87 (d, J=8.6 Hz, 2H), 7.60 (d, J=7.0 Hz,1H),7.50 (d,J=8.6 Hz,2H),7.45 (dd,J=7.1, 1.2 Hz,1H),2.80 (d,J=1.1 Hz, 3H).13C NMR (126 MHz, CDCl3) δ 156.00, 153.24,135.99, 134.09, 131.10, 130.63, 130.32, 128.74,128.28, 127.92, 17.98(two sp2signal were not observed because ofoverlapping).
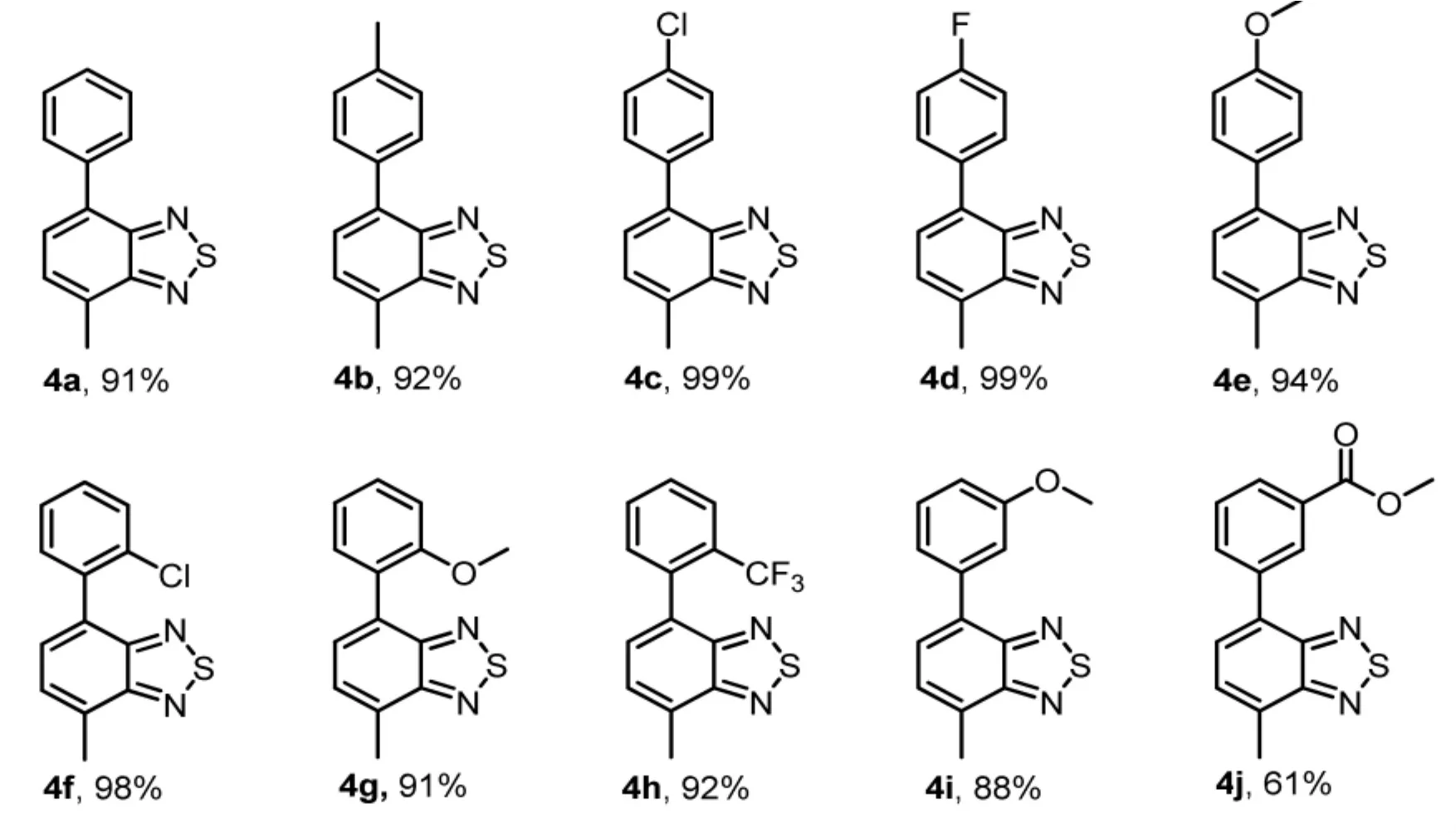
Scheme 2 化合物4底物拓展
4-methyl-7-(4-fluoro)phenyl-2,1,3-benzothiadiazole(4d):1H NMR (500 MHz,CDCl3)δ7.90 (dd,J=8.7,5.5 Hz,2H),7.58 (d,J=7.0 Hz, 1H), 7.45 (dd, J=7.1, 1.2 Hz, 1H),7.22 (t,J=8.7 Hz,2H),2.80 (d,J=1.1 Hz,3H).13C NMR (126 MHz, CDCl3) δ 162.72 (JC-F=247.8 Hz),155.99,153.39,133.64 (JC-F=3.3 Hz), 130.86, 130.74 (JC-F=8.1 Hz), 130.74,128.30, 127.83, 115.50 (JC-F=21.4 Hz), 17.94(two sp2signal were not observed because of overlapping).
4-methyl-7-(4-methoxy)phenyl-2,1,3-benzothiadiazole(4e):1H NMR (500 MHz, CDCl3) δ 7.88 (d, J=8.8 Hz, 2H), 7.56 (d, J=7.1 Hz,1H),7.42 (dd,J=7.0,1.2 Hz,1H),7.07(d,J=8.8 Hz,2H), 3.90 (s,3H),2.78 (d,J=1.1 Hz, 3H).13C NMR (126 MHz, CDCl3) δ 159.57, 156.01, 153.54, 131.52, 130.20, 130.10,129.84, 128.38, 127.13, 114.01, 55.35, 17.87(two sp2signal were not observed because of overlapping).
4-methyl-7-(2-chloro)phenyl-2,1,3-benzothiadiazole(4f):1H NMR (500 MHz, CDCl3)δ 7.59~7.56 (m, 1H), 7.53 (d, J=6.9 Hz, 1H),7.51~7.49 (m, 1H),7.47 (dd,J=7.0,1.2 Hz,1H), 7.42~7.39 (m, 2H), 2.82 (d, J=1.1 Hz,3H).13C NMR (126 MHz, CDCl3)δ155.41,153.66, 136.55, 133.49, 131.91, 131.51, 130.04,129.98, 129.95, 129.45,127.81,126.69,18.00.
4-methyl-7-(2-methoxy)phenyl-2,1,3-benzothiadiazole(4g):1H NMR (500 MHz, CDCl3)δ7.57 (d,J=6.9 Hz,1H),7.51 (dd,J=7.5,1.8 Hz,1H),7.45 (dddd,J=7.4,6.1,4.7,1.8 Hz, 2H), 7.15~7.07 (m, 2H), 3.79 (s, 3H),2.80 (d, J=1.2 Hz, 3H).13C NMR (126 MHz,CDCl3) δ 157.02, 155.57, 154.15, 131.57,130.47, 129.83, 129.56, 129.40, 128.06, 126.73,120.62, 111.46, 55.66, 17.94.
4-methyl-7-(2-trifluoromethyl)phenyl-2,1,3-benzothiadiazole(4h):1H NMR (500 MHz,CDCl3) δ 7.86 (d, J=8.5 Hz, 1H), 7.67 (td, J=7.5, 0.9 Hz, 1H), 7.59 (t, J=7.7 Hz, 1H),7.47 (d, J=7.6 Hz,1H),7.44 (s, 2H), 2.82(s, 3H).13C NMR (126 MHz, CDCl3) δ 155.14,154.32, 136.44, 132.38, 131.54, 131.36, 129.82,129.62, 129.20, 128.27, 127.61, 126.42 (JC-F=5.0 Hz),124.02 (JC-F=273.6 Hz),17.97.
4-methyl-7-(3-methoxy)phenyl-2,1,3-benzothiadiazole(4i):1H NMR (500 MHz,CDCl3)δ7.63 (d, J=7.0 Hz, 1H), 7.52 ~7.48 (m,2H),7.48 ~7.42 (m,2H),7.02 ~6.98 (m, 1H),3.91(s, 3H), 2.80 (d, J=1.1 Hz, 3H).13C NMR(126 MHz, CDCl3) δ159.71, 156.02, 153.46,138.97,131.78, 130.76,129.53, 128.30,128.03,121.53,114.99,113.51,55.36,17.97.
4-methyl-7-(3-methoxycarbonyl)phenyl-2,1,3-benzothiadiazole(4j):1H NMR (500 MHz,CDCl3) δ8.57 (t, J=1.8 Hz, 1H), 8.16 (d, J=7.9 Hz, 1H),8.11(d,J=7.9 Hz, 1H),7.66 (d,J=7.0 Hz, 1H), 7.60 (t, J=7.8 Hz, 1H), 7.46(dd, J=7.0, 1.2 Hz, 1H), 3.97 (s, 3H), 2.80(d, J=1.1 Hz, 3H).13C NMR (126 MHz, CDCl3)δ 167.01, 155.98, 153.27, 137.89, 133.58,131.28, 130.79, 130.56, 130.10, 129.09, 128.63,128.28,52.25, 17.99.
3 结论
本文探索了一条制备4-甲基-7-芳基-2,1,3-苯并噻二唑的合成工艺路线,以3-甲基苯二胺为起始原料,分子内合环得到4-甲基-2,1,3-苯并噻二唑,再经溴代反应得到4-甲基-7-溴-2,1,3-苯并噻二唑,再与苯硼酸发生Suzuki偶联反应得到4-甲基-7-芳基-2,1,3-苯并噻二唑。通过该路线最终得到了15种含有不同取代基4-甲基-7-芳基-2,1,3-苯并噻二唑的衍生物,且收率良好,对光电材料的合成提供了新的前提物质和合成思路,具有良好的工业应用前景。

