重组6型腺相关病毒介导的绿色荧光蛋白在野百合碱诱导肺动脉高压大鼠肺组织中的表达
樊 勇,郝燕捷,高 岱,张卓莉
肺动脉高压(pulmonary hypertension,PH)是一类以进行性肺动脉压力升高和肺血管阻力增大,最终导致右心功能不全或死亡为主要特点的心肺血管疾病,病情进展快,预后很差[1]。近年来随着相关领域基础研究和临床研究特别是动脉型肺动脉高压(pulmonary arterial hypertension,PAH)研究的迅速发展,PH的靶向治疗已用于临床,患者的临床症状和生活质量得到明显改善,生存时间得以延长[2]。然而,目前PAH的发病机制尚未完全阐明,因此临床治疗并不能真正逆转PAH的肺血管重塑,患者的长期预后仍然很差。
伴随精准医疗概念的提出,基因治疗技术也随着基因编辑技术的改进而迅速发展,为某些疾病,特别是罕见病的治疗提供了新的途径。自1984年重组腺相关病毒(recombinant adeno-associated virus, rAAV)首次使用以来[3],rAAV一直被认为是最有希望的基因治疗载体之一,具有非致病性和低免疫原性,转染效率高,可转染分裂期和非分裂期细胞并介导治疗基因长期稳定表达等优点,目前已广泛用于多种疾病的基因治疗研究[4-6]。rAAV共9种血清型,可分为rAAV1-9,不同血清型具有不同的组织嗜向性。既往文献报道rAAV6具有较明显的嗜肺性,可介导基因在动物肺组织中高效、稳定表达,已用于肺部疾病的基因治疗[7-10],但未见其在PAH治疗中的研究报道。本研究以野百合碱诱导的PAH大鼠为研究模型,以rAAV6为载体,检测以气管内注射的方法转染肺组织后rAAV6-ZsGreen在肺组织中转染效率及表达情况,为今后利用rAAV6-ZsGreen载体开展PAH的机制研究及治疗研究奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器:野百合碱(monocrotaline,MCT)(购自美国Sigma公司);ZsGreen 抗体(购自美国Clonetech公司),β-actin单抗(购自北京中杉金桥生物有限公司);rAAV6-CMV-ZsGreen(由上海汉恒生物有限公司构建)。一次性1 ml无菌胰岛素注射器(BD公司,USA);CM1950冰冻切片机(Leica公司,Germany);倒置荧光显微镜(Olympus公司,Japan);凝胶图像分析系统(Syngene XT-4公司,USA);多导生理仪(TME BL-420S公司, China)。
1.1.2 实验动物及分组:6周龄SPF级雄性Sprague-Dawley(SD)大鼠24只,体重160~180 g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0011],在北京大学第一医院动物中心饲养。动物饲养环境温度为22~25 ℃,相对温度60%,动物自由饮水、进食,每日12 h光照。所有大鼠适应性喂养3 d后随机分为3组,每组8只。正常对照组大鼠颈背部皮下注射1∶4乙醇生理盐水混合液,第2天分离暴露大鼠颈部气管,使用1 ml BD无菌胰岛素针朝向心脏方向刺进气管注射100 μl无菌磷酸盐缓冲液(phosphate buffered solution,PBS);PAH模型组大鼠颈背部皮下注射野百合碱60 mg/kg,第2天以同样的方法注射等容量PBS液;PAH病毒组大鼠颈背部皮下注射野百合碱60 mg/kg,第2天以相同的方式注射100 μl含1×1011vg(virus genomes)rAAV6-ZsGreen液。本研究实验过程获得北京大学第一医院伦理委员会批准(批准号:J201527)。
1.2 方法
1.2.1 右心导管法检测右室收缩压和肺动脉压:动物注射后21 d用10%水合氯醛(0.3 ml/100 g)麻醉大鼠,动物仰卧位固定。采用颈部正中切口,分离右侧颈外静脉,将连接压力换能器的PE-50管朝近心端插入颈外静脉,并穿过右心房、右心室到达肺动脉,使用多导生理仪测量记录右室收缩压(right ventricular systolic pressure, RVSP)和平均肺动脉压(mean pressure of pulmonary artery,mPAP)。
1.2.2 大鼠肺组织病理学检查:mPAP检测后取两块大鼠左肺下叶组织,置于4%多聚甲醛中固定,用冰冻切片包埋剂包埋,行冰冻切片,厚度为5 μm,用于绿色荧光蛋白(ZsGreen)表达的观察。另部分肺组织行石蜡包埋切片,厚度为5 μm。采用苏木精-伊红染色法行组织病理学检查,测量肺小动脉中膜厚度(wall thickness,WT)和血管外径(external diameter,ED),计算中膜厚度百分比,WT%=(2×WT/ED)×100%。取心脏组织,用甲醛固定后沿房室沟分离心房和心室,再沿室间隔分离左右心室,滤纸吸干水分后称量,计算右心肥厚指数(right ventricular hypertrophy index,RVHI),RVHI=右心室质量/(左心室+房间隔)质量。
1.2.3 Western blot法检测大鼠肺组织中ZsGreen蛋白表达:另取一小块(约50 mg)右下肺组织置于液氮中保存,检测前使用蛋白裂解液加蛋白酶抑制剂裂解提取组织蛋白。采用10%的分离胶和5%浓缩胶进行SDS聚丙烯酰胺凝胶电泳,将凝胶上的条带电转至聚偏二氟乙烯膜(PVDF膜)上,5%脱脂牛奶封闭1 h,分别与ZsGreen单抗(1∶1 000),内参蛋白β-actin单抗(1∶2 000)孵育过夜,再与相应二抗(1∶5 000)孵育1 h后进行化学发光、显影、定影,以及凝胶图像分析灰度值。ZsGreen蛋白相对表达量=目标ZsGreen表达灰度值/β-actin表达灰度值。
1.3 统计学方法
采用SPSS 20.0统计学软件对数据进行分析,采用Image J软件分析平均荧光强度和蛋白相对定量灰度值,计量资料采用均数±标准差表示。采用完全随机分组三水平研究设计,正常对照组、PAH模型组和PAH病毒组间各检测指标量化数据的差异比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 PAH大鼠模型建立
野百合碱注射后21 d所有大鼠均成活,PAH模型组和PAH病毒组大鼠体重比较差异无统计学意义(P=0.955),但均明显低于对照组大鼠,差异均有统计学意义(均P<0.05)。PAH模型组和PAH病毒组大鼠RVSP、mPAP均明显高于正常对照组,差异均有统计学意义(均P<0.05)。PAH模型组和PAH病毒组大鼠WT比值明显高于正常对照组,差异均有统计学意义(均P<0.05)(表1)。组织病理学检查显示,PAH模型组和PAH病毒组大鼠均可见肺组织结构排列紊乱,重塑血管周围大量炎性细胞浸润;与PAH模型组比较,PAH病毒组大鼠肺组织无明显增加的结构破坏及炎性细胞浸润(图1)。表明野百合碱诱导的PAH大鼠模型成功建立,rAAV6病毒本身对PAH的形成过程以及肺组织结构有较低免疫原性和毒性。
2.2 各组大鼠肺组织中ZsGreen表达
病毒转染后20 d,荧光显微镜下显示正常对照组和PAH模型组大鼠肺组织仅见肺泡和血管微弱的自发荧光,而PAH病毒组大鼠肺组织可见广泛而均匀的特异性绿色荧光蛋白ZsGreen表达,PAH病毒组大鼠肺组织ZsGreen平均荧光强度(A值)为 33.471±5.147,明显高于PAH模型组的4.167±1.249和正常对照组的4.581±1.871,差异均有统计学意义(均P<0.05)(图2)。
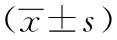
表1 3组大鼠体重、血流动力学结果及血管重塑指标比较Table 1 Comparison of rat weight, hemodynamic result and vascular remodeling indicators among 3
与各自正常对照组比较,aP<0.05(单因素方差分析,LSD-t检验); 1 mm Hg=0.133 kPa;PAH:动脉型肺动脉高压;RVSP:右室收缩压;mPAP:平均肺动脉压;WT:中膜厚度百分比;RVHI:右心肥厚指数A:正常对照组大鼠肺组织结构正常; B:PAH模型组大鼠肺组织结构排列紊乱,重塑血管周围可见大量炎性细胞浸润;C:PAH病毒组大鼠肺组织结构排列紊乱,重塑血管周围可见大量炎性细胞浸润,但与PAH模型组大鼠比较未见明显增加A:光学显微镜下正常对照组大鼠肺组织形态,可见肺动脉血管正常;B:光学显微镜下PAH模型组大鼠肺组织形态,可见肺动脉血管重塑;C:光学显微镜下PAH病毒组大鼠肺组织形态,可见肺动脉血管重塑;D:荧光显微镜下正常对照组大鼠肺组织仅见肺泡和血管自发弱荧光; E:荧光显微镜下肺动脉模型组大鼠肺组织仅见肺泡和血管自发弱荧光; F:荧光显微镜下肺动脉病毒组大鼠肺组织较强绿色荧光; G:3组大鼠肺组织中ZsGreen荧光强度比较,F=230.70,P<0.000;与正常对照组比较,aP<0.05;与PAH模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=8); PAH:动脉型肺动脉高压
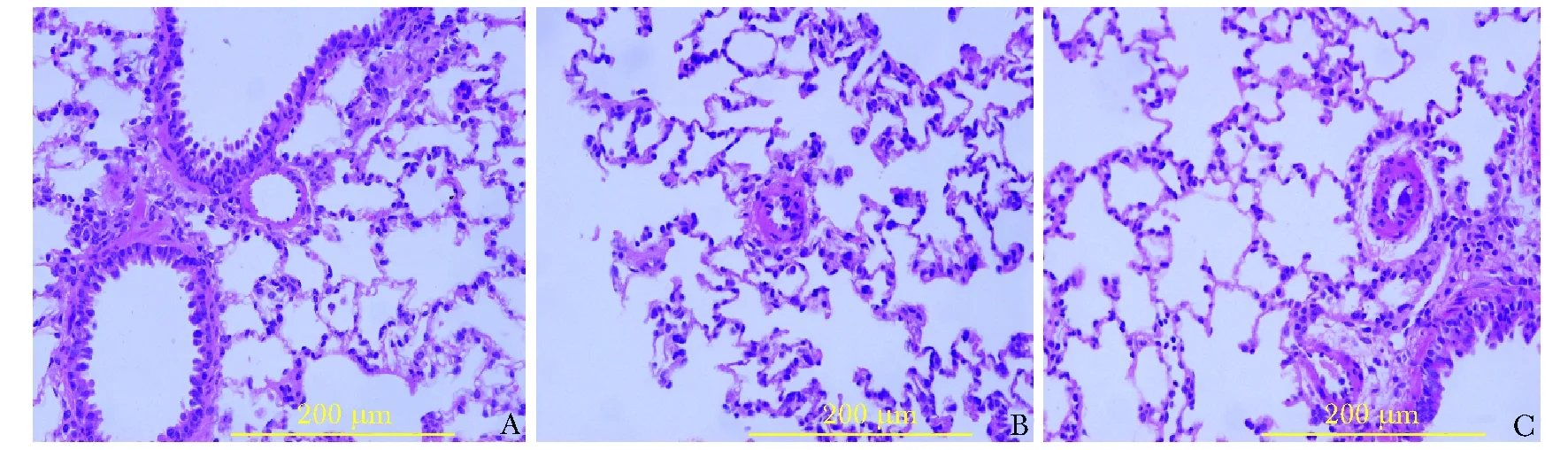
图1各组大鼠肺组织病理学表现(HE ×400,标尺=200 μm)
Fig1Histopathological findings of rat lung tissue in different groups (HE ×400, bar=200 μm)
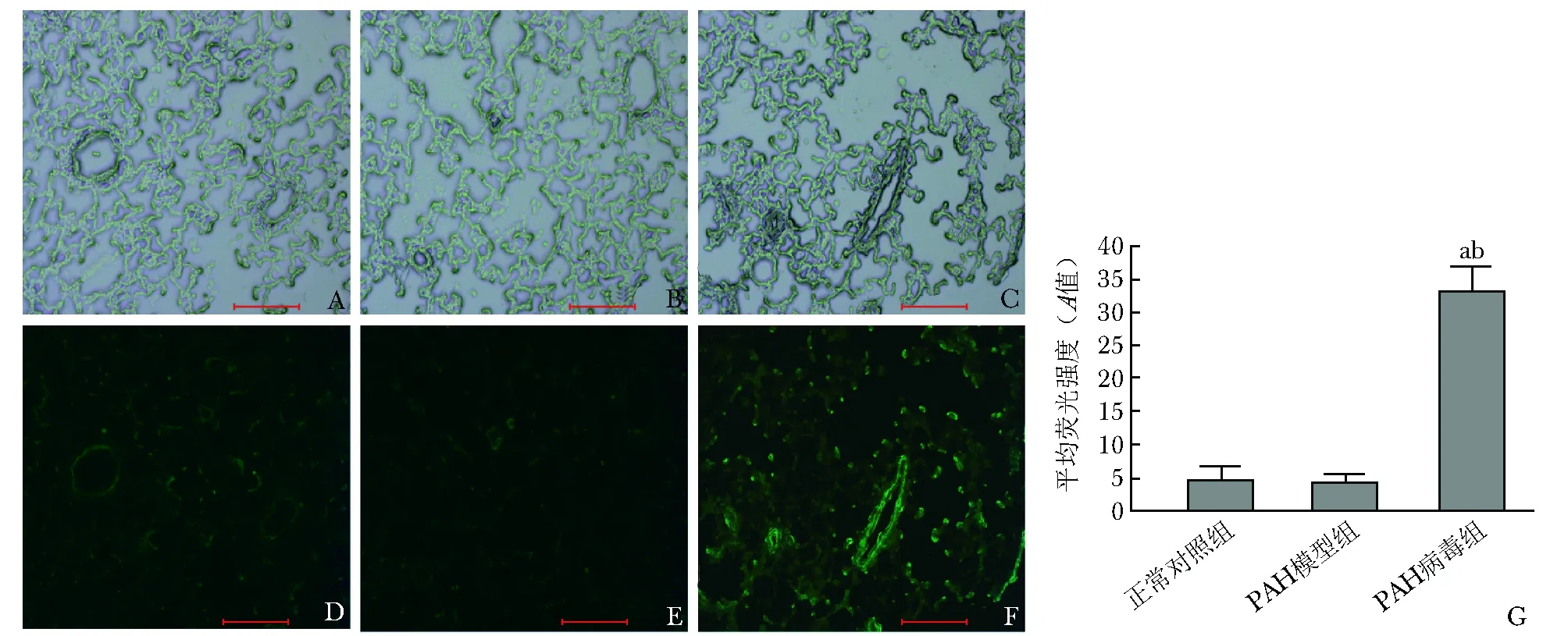
图2各组大鼠肺组织ZsGreen荧光强度比较(×100,标尺=500 μm )
Fig2Fluorescence intensity of ZsGreen in rat lung tissue in different groups (×100,bar=500 μm )
2.3 大鼠肺组织绿色荧光蛋白ZsGreen相对表达量
Western blot检测显示正常对照组和PAH模型组大鼠肺组织中ZsGreen蛋白反应条带微弱,PAH病毒组大鼠组肺组织ZsGreen蛋白反应条带明显增强,Image J软件分析正常对照组、PAH模型组和PAH病毒组大鼠肺组织中ZsGreen蛋白相对表达量(灰度值)分别为0.072±0.017、0.067±0.019和0.317±0.062,PAH病毒组大鼠组肺组织ZsGreen蛋白相对表达量明显高于正常对照组和PAH模型组,差异均有统计学意义(均P<0.05)(图3)。

图 3 Western blot检测各组大鼠肺组织ZsGreen蛋白相对表达量Fig 3 Relative expression level of ZsGreen protein in rat lung tissue by Western blotA:PAH病毒组大鼠肺组织中ZsGreen蛋白反应条带强于正常对照组和PAH模型组;B:各组大鼠肺组织中ZsGreen蛋白相对表达量量化比较,F=67.30,P<0.000;与正常对照组比较,aP<0.05;与PAH模型组比较,bP<0.05(单因素方差分析,LSD-t检验,n=8); PAH:动脉型肺动脉高压
3 讨论
PH是临床上严重的心肺血管疾病,可由多种疾病所导致,病情隐匿,病死率高,预后差[11]。研究表明,肺血管舒缩功能障碍和血管重塑是PH的主要病理生理改变,但其具体发病机制尚未完全阐明。目前虽然靶向治疗在一定程度上可以改善患者的预后,但是靶向药物的作用主要是扩张血管及降低肺动脉压力,缺少有效抑制甚至逆转肺血管重塑的药物,因此PAH患者的长期预后不佳[12]。
随着分子生物学的进展,基因治疗可以为PAH的发病机制、分子病因以及治疗提供更多思路,而基因载体的选择对基因治疗的成功与否至关重要。AAV是一种在体转染病毒,为无包膜的线性单链DNA病毒,其优势在于具有广泛的宿主细胞范围,可稳定、高效地介导基因在宿主体内表达,由于其表达合成的病毒蛋白较少,因此具有较低的免疫原性和较高的安全性,并且经改造后的rAAV具有较特异的组织嗜向性(不同血清型对于组织的亲和性不同),被认为是最有潜力的基因治疗载体之一,对癌症、血友病、糖尿病、艾滋病等具有良好的应用前景[13-14]。Glybera是欧洲第一个被授权的基因治疗产品,其利用AAV载体将一个脂蛋白酯酶正常基因进行拷贝,通过肌肉注射传递到脂蛋白酯酶缺乏患者体内,使得这类患者2年内急性胰腺炎发病率显著减少[15]。此外,2017年10月美国食品和药物管理局评审委员会全票通过全球首例利用AAV作为载体治疗基因缺失遗传病的药物Luxturna,可以眼内直接注射给药,从此开启了基因治疗时代。rAAV大致可分为9种血清型,不同血清型具有不同的组织嗜向性。Ito等[16]发现rAAV1介导的IL-10过表达可以通过抑制巨噬细胞聚集,降低肺组织白介素6及肿瘤生长因子β表达而阻止野百合碱诱导的大鼠PAH的形成,明显改善PAH大鼠总体预后。Crosswhite等[17]通过rAAV2携带TNFα的短发夹RNA(short hairpin RNA,shRNA)有效敲低肺组织中TNFα表达,减轻肺组织巨噬细胞浸润和IL-6等炎症因子的释放,从而达到治疗PAH的目的。此外还有研究者报道rAAV5介导的miR-29a-3p过表达以及rAAV9介导的前列环素合酶过表达均可有效缓解PAH动物模型疾病严重程度[18-19]。
除以上报道的几种rAAV血清型外,既往研究还发现rAAV6具有较明显的嗜肺性,可介导多种基因在动物肺组织中高效、稳定的表达,在肺部其他疾病的基因治疗中报道较多[9]。研究显示,与rAAV2相比,rAAV6在啮齿动物肺部及体外培养的气道上皮细胞中基因转导效率明显增加[20]。Macloughlin等[21]发现rAAV6介导的核因子kappa B抑制因子α过表达可有效减轻脂多糖诱导的大鼠急性肺损伤,为该疾病的治疗带来新的思路。与rAAV5相比,未发现明显的由病毒自身引起的组织炎症,提示其较低的毒性与较好的安全性。此外,还有研究显示rAAV6可高效转染狗以及羊等大动物[7,22],为更多肺部疾病的发病机制和基因治疗研究提供策略[23],但rAAV6能否有效转染PH动物模型,目前国内外还未见相关研究。
本研究采用颈部气管暴露且一次性BD无菌胰岛素针注射给药的方式,可以最大限度保证rAAV6病毒成功进入肺组织,进而发挥其高效、稳定的转染效果,整个过程只需准确找好位置,暴露大鼠颈部约1 cm皮肤及皮下肌肉,一次性BD 1ml无菌胰岛素针朝向心方向刺进气管注射给药后缝合皮肤,操作用时短,安全性高,且注射溶剂时可以最大剂量成功进入大鼠气管。报告基因ZsGreen是一种从珊瑚中分离出来的绿色荧光蛋白,比传统的从水母中分离的绿色荧光蛋白亮度更高,稳定性更好,更有利于载体转染效果的观察。rAAV6在体转染后可在肺组织细胞内借助CMV启动子转染并翻译出绿色荧光蛋白,由polyA终止转录,一般2~3周后基因表达达峰,并能长期稳定表达,本研究显示PAH病毒组绿色荧光表达明显强于正常对照组和PAH模型组,并在肺组织中广泛均匀分布;Western blot检测也进一步证实rAAV6介导的报告基因ZsGreen可有效转染至PAH大鼠肺组织。肺组织病理检查显示PAH病毒组大鼠肺组织结构及局部炎症细胞浸润并未比PAH模型组明显增加,提示rAAV6病毒的低免疫原性及毒性。
综上所述,PAH的形成及发展是一个慢性过程,本研究结果显示,rAAV6-ZsGreen通过气管暴露给药可高效、安全地转染大鼠肺组织,并且对肺组织结构无明显影响,为下一步rAAV6载体携带目的基因在PAH动物模型中的机制研究及治疗探索提供实验基础。当然,现有的基于病毒为载体的基因疗法也有一定局限性,解决转基因的沉默问题以及进一步提高病毒感染效率将是未来改良现有技术的研究方向。

