阿司匹林丁香酚酯在大鼠体内的代谢动力学研究
周 豪,杨亚军,孔晓军,刘希望,杨孝朴,李剑勇*
(1.甘肃农业大学动物医学院,兰州 730070;2.中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,兰州 730050)
阿司匹林(Aspirin)作为三大经典药物之一,多年来都被作为“解热镇痛药”的代名词广泛应用于各种原因引起的发热、疼痛等病症。阿司匹林的抗炎作用也是治疗类风湿性关节炎、骨关节炎等病症的首选药物之一[1]。20世纪70年代低剂量的阿司匹林具有抗血小板凝血作用的发现,使其在心血管疾病的预防和治疗方面有广泛的应用。但阿司匹林长期服用的副作用同样不容忽视,其对胃肠的刺激性易引起胃溃疡和胃出血[2]。阿司匹林丁香酚酯(Aspirin Eugenol Ester, AEE)是中国农业科学院兰州畜牧与兽药研究所以阿司匹林和丁香酚为原料,经过酯化反应合成的一种新型非甾体抗炎药物,该药物降低了阿司匹林对胃肠道的刺激性,同时增强了挥发油丁香酚的稳定性。截至目前,先后就AEE的药效学[3]、急性毒性、慢性毒性、生殖毒性[4-5]、稳定性和致畸性[6]等进行了研究,显示AEE具有良好的成药性。作为一种新的合成药物,研究AEE的代谢动力学,以期为全面评价AEE的药学性质提供依据,并为临床合理用药提供参考。
1 材 料
1.1 药品与试剂 AEE(纯度大于99%),由中国农业科学院兰州畜牧与兽药研究所农业部兽用药物创制重点实验室制备;阿司匹林(ASA)对照品(批号100113-201405)纯度99.8%;水杨酸(SA)对照品(批号100106-201104)纯度99.9%;丁香酚(Eugenol)对照品(批号110725-201615)纯度99.3%,内标香草酸(批号110776-201503)纯度99.8%,均购于中国食品药品检定研究院。内标4-甲基水杨酸酸甲酯(批号M1584)购于TCI(上海)化成工业发展有限公司。质谱级乙腈、甲酸均购于美国新泽西Fisher化学药品有限公司;超纯水购于广州屈臣氏食品饮料有限公司;其他试剂均为分析纯及以上。
1.2 仪器设备 1200高效液相色谱仪,6410B三重四级杆质谱仪均为安捷伦公司产品。样品快速蒸发仪(美国LABCONCO公司);高速离心机(Thermo ScientificTMSorvallTMST40),涡旋混合器(Scientific Industries Vortex Genie2),超低温冰箱(海尔DW-86L388A)。
1.3 试验动物 60日龄成年SD大鼠12只(批号SCXK(G)字2015-001,购于中国农业科学院兰州兽医研究所,中国兰州),雌雄各半,体重300 g左右。给药前12 h禁食,自由饮水。
2 方 法
2.1 色谱条件 液质联用是药物代谢中最常用的方法[7-9],根据参考文献[10-11]方法并改进,确定为:色谱柱为安捷伦ZORBAX RRHD Eclipse Plus C18(3.0×100 mm,1.8 μm);流动相A为乙腈,B为水相,水相含有0.1%甲酸和1%的乙腈,流速0.4 mL/min,进样量为10 μL,柱温30 ℃。其中ASA和SA在负离子模式下同时测定,流动相为等度洗脱(A∶B=3∶7);AEE和丁香酚在正离子模式下同时测定,流动相为梯度洗脱;水相比例为:0~1 min,50%;1~3 min,35%;3~5 min,20%;5~7 min,50%。
2.2 质谱条件 采用电喷雾离子源,多反应监测;离子源温度300 ℃;毛细管电压正模式下4000 V,负模式下3500 V。AEE及其待测物的质谱条件见表1。
2.3 给药方案和血样采集 采用大鼠颈静脉插管方式采血,手术后适应3 d开始给药;AEE用0.5%羧甲基纤维素钠混匀制成浓度为4 mg/mL,按20 mg/kg灌胃给药[10]。给药后分别于0.5、1、1.5、2、3、4、6、8、10、12、24、48 h采取血浆样品;每次采血300 μL左右,采血后补充等量生理盐水。采取血液样品置于含肝素钠的离心管中,4000 r/min离心10 min,取上清液-20 ℃保存。
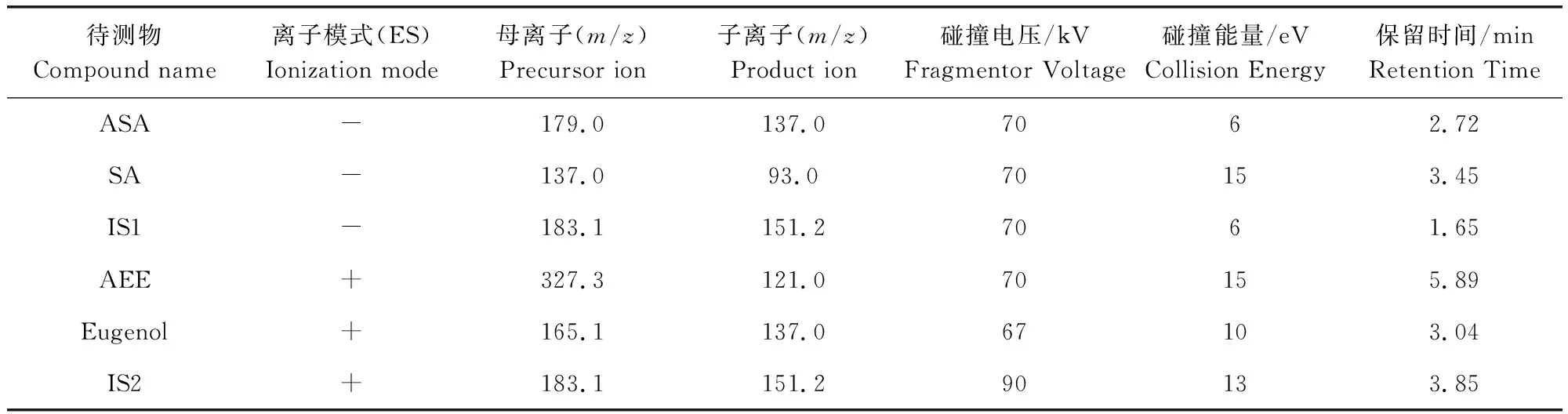
表1 AEE及其代谢物的质谱条件Tab 1 Mass spectrometry detection conditions of AEE and its metabolites
内标: IS1为香草酸;IS2为4-甲基水杨酸甲酯
Internal standard: IS1 is vanillic acid, IS2 is methyl 4-methyl salicylate
2.4 样品处理 将待测血浆样品置于室温,待其完全融化,用移液器精密移取50 μL置于离心管中,加入10 μL内标和300 μL乙腈,涡旋震荡30 s,4 ℃条件下14000 g离心10 min,取上清液用样品快速蒸发仪除去溶剂,加入200 μL流动相复溶,涡旋震荡30 s,经0.22 μm滤膜过滤后进样。
2.5 标准曲线的建立 精密称取AEE和丁香酚标准品,以乙腈为溶剂配制成浓度为 5、10、20、50、100、200、500、1000 ng/mL的系列浓度标准液。分别吸取上述不同浓度标准液50 μL,加入空白血浆50 μL和1 μg/mL内标(4-甲基水杨酸甲酯)10 μL,按2.4项方法操作,进样10 μL,以待测物峰面积与内标峰面积比值(Y)对相应的待测物浓度(X)作线性回归,得出回归方程和相关系数。
精密称取阿司匹林和水杨酸标准品,以乙腈为溶剂配制成浓度为5、10、50、100、500、1000、5000、10000 ng/mL的系列浓度标准液。内标(香草酸)为1 μg/mL;同上操作,计算回归方程和相关系数。
2.6 数据处理 药物浓度-时间数据采用WinNonLin5.2软件拟合药物动力学模型,计算出药代动力学参数。
3 试验结果
3.1 专属性考察 在选定的色谱条件下,AEE和代谢物丁香酚以及ASA和SA可以实现很好的分离,见色谱图1。
3.2 标准曲线与定量限 ASA的血药浓度测定标准曲线为:Y=0.00749X+0.08341,R2=0.9927,SA为Y=0.0143X+0.08335,R2=0.9996,线性范围均为5~10000 ng/mL。AEE的血药浓度测定标准曲线为:Y=0.0183X+1.1750,R2=0.9973,丁香酚为:Y=0.0119X+0.03617,R2=0.9959,线性范围均为5~1000 ng/mL。
3.3 精密度与准确度 取血浆样品按高、中、低3个浓度,每个浓度5个平行样品。按2.4样品处理方法项处理后进样分析,以一天内5次测定结果计算日内精密度和准确度;连续测定3 d计算日间精密度和准确度。本方法测定的AEE及其代谢物的血浆样品的日内和日间精密度均RSD<10%,结果符合目前生物样品分析方法指导原则的有关规定。血浆样品测定AEE及其代谢物日内精密度、日间精密度和准确度以及回收率见表2。
3.4 基质效应 取空白血浆样品按2.4项方法处理后,加入高、中、低3种不同浓度的待测物,每个浓度设3个平行样品;测得样品中被测物的峰面积,与用流动相配制的相应浓度的标准溶液中被测物的峰面积比较,计算基质效应。4种待测物及内标在高、中、低3个浓度血浆样品中基质效应均在85%~115%之间,说明血浆样品处理方法中对被测成分影响不大,方法稳定可靠。
3.5 稳定性 对样品的稳定性考察主要有短期稳定性的考察:短期稳定性样品配好后,在室温条件下放置6 h后分析;冻融稳定性考察:样品反复冻融(-80 ℃)3次后,进样分析;长期稳定性考察:将样品在-80 ℃条件下存放三周后分析。样品稳定性结果见表3,样品稳定性RSD值均小于15%,表明血浆中被测物浓度可以被准确测定。
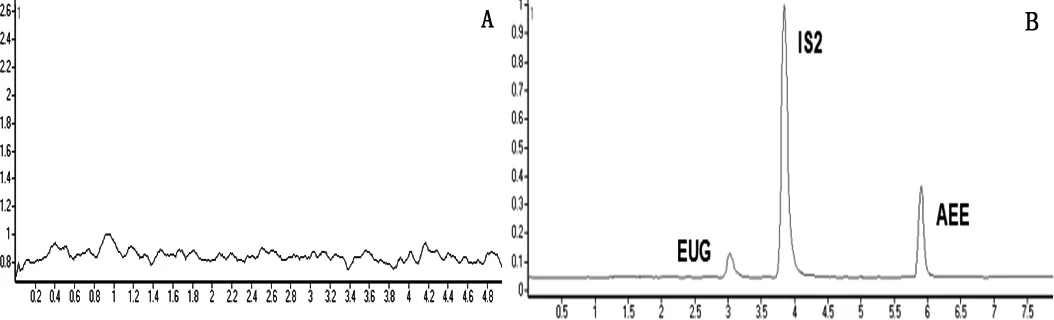
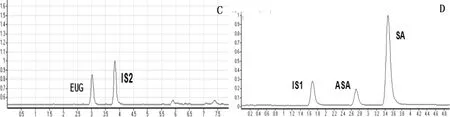

A. 空白血浆;B. 空白血浆加入EUG(丁香酚)、IS2(4-甲基水杨酸甲酯)和AEE标准品;C. 给药1 h后血浆中加入内标IS2;D. 空白血浆加入内标IS1(香草酸)、ASA和SA标准品;E. 给药1 h后血浆中入内标IS1A.Representative chromatograms of blank plasma samples; B.Representative chromatograms of EUG, IS2, and AEE in blank Plasma samples spiked with analytes; C.One hour after administration, the representative chromatograms of IS2 was add to the Plasma samples; D.Representative chromatograms of IS1, ASA and SA in blank Plasma samples spiked with analytes; E.One hour after administration, the representative chromatograms of IS1 was add to the Plasma samples.图1 色谱图Fig 1 Representative Chromatogram

待测物Compoundname浓度/(ng·mL-1)concentration日内(intra-day)日间(inter-day)精密度RSD/%Precision准确度(RE)accuracy精密度RSD/%Precision准确度(RE)accuracy回收率/%recoveryASA208.883.579.628.5681.42±6.175004.35-1.253.221.1884.33±3.2850003.00-0.255.182.3285.26±4.37SA203.501.135.464.5494.79±5.175001.02-0.734.782.5497.28±3.5150002.561.155.971.2798.63±3.48AEE203.853.667.852.5979.82±5.341006.542.376.013.2280.23±3.145001.360.233.910.7784.19±5.15EUG207.133.327.672.2276.38±4.221008.161.336.861.3979.46±5.835002.04-0.192.630.3484.30±4.41

表3 AEE及其代谢物样品稳定性考察Tab 3 Stability of AEE and its metabolites
3.6 大鼠口服给药后体内药动学分析 大鼠灌胃给药后,按时间点采集血样,经处理后进行LC-MS/MS分析。根据不同时间点的数据,对AEE及其代谢物在大鼠血浆内随时间的浓度变化进行分析发现:AEE和阿司匹林在血浆中无法检出,丁香酚在血浆中能被检出,但在0~48 h内均未达到定量限。水杨酸在大鼠血浆中随时间的浓度变化的药-时曲线见图2,并计算了水杨酸的主要药代动力学参数见表4。
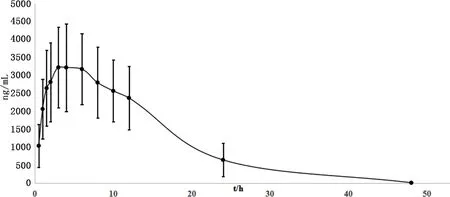
图2 AEE给药后大鼠体内水杨酸的平均血药浓度-时间曲线(mean±SD, n=12)Fig 2 The mean plasma concentration of SA versus time after AEE administration in rat (mean±SD, n=12)
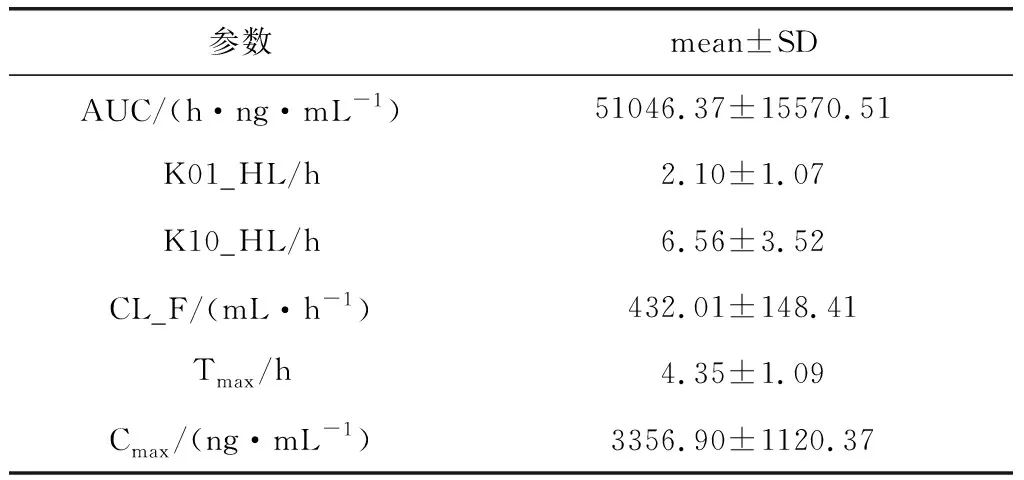
参数mean±SDAUC/(h·ng·mL-1)51046.37±15570.51K01_HL/h2.10±1.07K10_HL/h6.56±3.52CL_F/(mL·h-1)432.01±148.41Tmax/h4.35±1.09Cmax/(ng·mL-1)3356.90±1120.37
4 讨 论
目前对于AEE临床药理方面的研究显示其具有良好的成药性;该药物降低了阿司匹林对胃肠道刺激性的同时,增强了丁香酚的稳定性;但对于其在啮齿类动物体内药物代谢动力学的研究是空白的。对AEE在大鼠体内的代谢动力学研究有利于解释其药理作用机理及作用过程,对于指导新药设计,提高新药疗效和安全性,科学的制定药品质量标准具有重要意义。
本试验所建立的LC-MS/MS方法能够分别同时检测血浆中AEE及代谢产物丁香酚、阿司匹林和水杨酸。色谱条件在文献[10]的基础上进行了改进,由单一代谢物的逐个测定改为同一模式下多个代谢物同时测定。AEE和丁香酚同时测定的流动相采用梯度洗脱,节省了样品测定时间。在文献[11]的基础上对阿司匹林的质谱条件进行了优化,增强了阿司匹林响应值的同时减轻了源内裂解的现象。方法学考察结果表明该方法具有专属性好、准确度高、精密度好和灵敏度高等特点,与文献[10]相比更适用于AEE及其代谢产物在动物体内的血药浓度的测定和药代动力学研究。
AEE以20 mg/kg单剂量口服给药后,测定血浆中AEE及其代谢物丁香酚、阿司匹林和水杨酸的浓度,以研究AEE及其活性代谢产物在体内情况。一方面明确可能的药理活性物质如AEE和阿司匹林、丁香酚的存在与否,另一方面研究已知的活性代谢产物水杨酸的浓度及动力学[10]。AEE经口服给药后,AEE及其代谢物阿司匹林在血浆中几乎检测不到;丁香酚在血浆中能被检出,但在0~48 h内均达不到定量限;水杨酸在血浆中的浓度较高。该实验证实了口服给药后AEE在体内迅速代谢,其血浆浓度较低,主要由水杨酸和丁香酚在体内发挥其药理活性。
据文献报道[12],阿司匹林以10 mg/kg单剂量灌胃给药后在SD大鼠体内水杨酸的达峰时间(Tmax)为2.17±0.98 h,达峰浓度(Cmax)为1.904±0.208 μg/mL,半衰期为5.208±1.699 h;药时曲线面积(AUC)为16.720±3.086 h·μg·mL-1。通过AEE代谢物水杨酸的药物动力学参数对比可以看出:在几乎相同的克分子数下,AEE比阿司匹林代谢的水杨酸药效作用更强,在较长时间内能保持较高的血药浓度,因此,仅就代谢物而言,AEE能更好地发挥阿司匹林的药效作用,给药间隔可以是阿司匹林的2~3倍,给药间隔以1 d 1次足以达到治疗效果。

