阿莫西林克拉维酸钾片含量测定方法的改进
张静岩 张炜 任风芝 张雪霞 王海燕 孟令茹
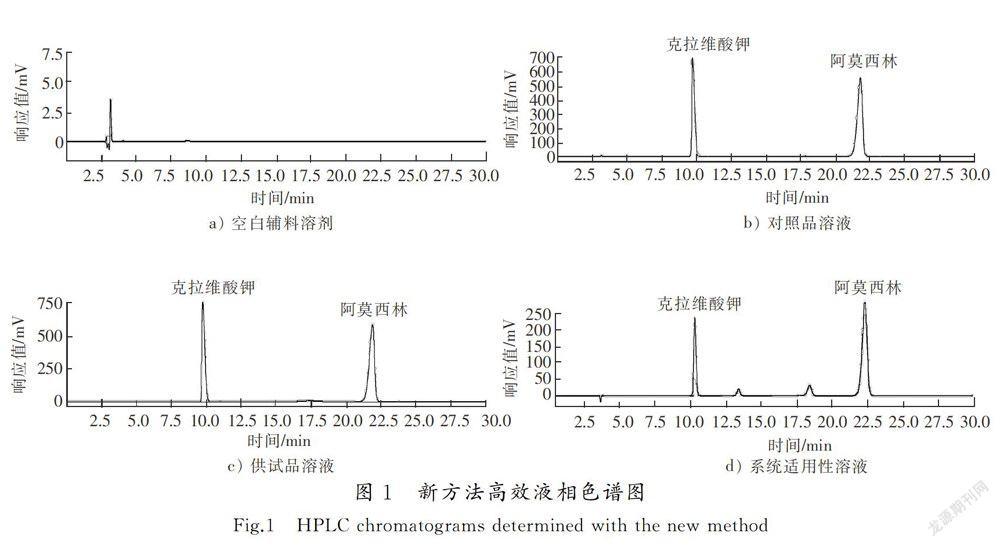
摘要:为解决实际应用中克拉维酸钾峰与后相邻杂质的分离度达不到要求的问题,建立了一种同时测定阿莫西林克拉维酸钾片中阿莫西林和克拉维酸钾含量的新方法,采用反相高效液相色谱法(RP-HPLC), Ultimate AQ-C18色谱柱(4.6 mm×250 mm,5 μm),以pH值为4.4的0.05 mol/L磷酸二氢钠缓冲液为流动相,柱温为35 ℃,流速为1.0 mL/min ,检测波长为220 nm 。结果表明:阿莫西林和克拉维酸钾两主峰与相邻杂质得到完全基线分离,分离度大于1.5;克拉维酸钾对照品溶液质量浓度为0.050 0~0.500 1 mg/mL时与峰面积的线性关系良好(r=0.999 8),平均回收率(n=9)为100.14%,RSD值为0.24%;阿莫西林对照品溶液质量浓度为0.100 0~1.000 1 mg/mL时与峰面积的线性关系良好(r=0.999 9),平均回收率(n=9)为100.45%,RSD值为017%。与原有的《中华人民共和国药典》方法相比,新的阿莫西林克拉维酸钾片含量测定方法专属性好,准确度高,操作简便快捷,结果可靠,可作为一种质量控制方法。
关键词:色谱分析;阿莫西林;克拉维酸钾;含量测定;高效液相色谱法
中图分类号:R9781+1文献标志码:Adoi: 10.7535/hbgykj.2018yx04013
阿莫西林克拉维酸钾片是葛兰素史克(GSK)公司研制的由阿莫西林三水化合物和克拉維酸钾组方的复方制剂,属于国家基本药物[1-2]。其中阿莫西林为广谱青霉素类抗生素,克拉维酸钾为竞争性广谱β-内酰胺酶抑制剂,两者合用,可保护阿莫西林免受β-内酰胺酶的水解,使对阿莫西林耐药并产生β-内酰胺酶的细菌仍然对阿莫西林敏感,从而不影响阿莫西林的杀菌效果[3-4],临床上广泛应用于敏感菌引起的上呼吸道感染、下呼吸道感染、泌尿系统感染、软组织及皮肤感染以及其他感染。国家食品药品监督管理总局(CFDA) 明确规定在2018年底前需完成对“阿莫西林克拉维酸钾片”及其原研制剂的一致性评价工作[5-9]。目第4期张静岩,等:阿莫西林克拉维酸钾片含量测定方法的改进河北工业科技第35卷前,本实验室对该药品进行了含量、杂质和溶出曲线等对比研究。《中华人民共和国药典》(以下简称《药典》)2015版[10]所述方法在含量测定部分指出,记录色谱图谱应与标准图谱一致,但对分离度并未有具体的要求,而在实际应用中发现克拉维酸钾峰与后相邻杂质的分离度达不到要求。本文在《药典》2015版分析方法及相关文献\[10-20\]的基础上,对阿莫西林克拉维酸钾片含量的测定方法进行了改进,采用水相柱对样品组分进行分离,通过色谱条件优化实现纯缓冲盐相作为流动相,从而达到绿色环保检测的要求,操作简便,且最终的分离度符合要求,效果较好。
1主要仪器与试药
Aglient 1260高效液相色谱仪(安捷伦科技有限公司提供);色谱柱Ultimate AQ-C18(4.6 mm×250 mm,5 μm,月旭科技(上海)股份有限公司提供);BP211D电子天平(德国赛多利斯集团提供)。
克拉维酸化学对照品(批号为130429-201307,含量为95.0%(质量分数,下同),中国药品生物制品检定所提供);阿莫西林化学对照品(批号为130409-201011,含量为85.8%,中国食品药品检定研究院提供);阿莫西林克拉维酸钾系统适用性对照品(批号为130588-201202,中国食品药品检定研究院提供);阿莫西林克拉维酸钾片 (规格为0.375 g,批号为170201,170202,170203,自制);水为超纯水;磷酸二氢钠(批号为20140728,优级纯,天津市永大化学试剂开发中心提供)。
2方法与结果
2.1色谱条件
色谱柱为Ultimate AQ-C18(4.6 mm×250 mm,5 μm),流动相为005 mol/L磷酸盐缓冲液(0.05 mol/L磷酸二氢钠溶液,取磷酸二氢钠7.8 g,加水900 mL使之溶解,用10%磷酸溶液或氢氧化钠溶液调pH值至(4.4±0.1),加水稀释至1 000 mL),检测波长为220 nm,进样体积为20 μL,柱温为35 ℃,流速为1.0 mL/min,分离度不低于2.0,色谱图见图1。
2.2溶液的配制
阿莫西林克拉维酸钾系统适用性对照品溶液的配制:精密称取适量阿莫西林克拉维酸钾系统适用性对照品,加流动相溶解并稀释制成0.8 mg/mL的溶液。
对照品溶液的配制:精密称取适量克拉维酸对照品和阿莫西林对照品,加水超声溶解,制成含克拉维酸0.25 mg/mL和含阿莫西林0.50 mg/mL的溶液。
供试品溶液的配制:另取阿莫西林克拉维酸钾10片,研细,精密称取适量,加水超声溶解,制成含克拉维酸0.25 mg/mL和含阿莫西林0.50 mg/mL的溶液,用0.45 μm的微孔滤膜过滤,弃去初滤液,取续滤液作为供试品溶液。
2.3专属性试验
分别精密吸取阿莫西林克拉维酸钾系统适用性对照品溶液、阿莫西林克拉维酸对照品溶液、供试品溶液,以及高温、光照、酸碱和氧化的强制降解样品溶液各20 μL,注入液相色谱仪,按“2.1”项所述方法进行分析,记录色谱图。结果发现,在该色谱条件下,所有强降解产物与两主峰分离度良好,未见辅料干扰,克拉维酸保留时间为9.82 min,阿莫西林保留时间约为21.75 min,辅料无吸收峰。表明该方法的专属性良好。
2.4线性范围考察
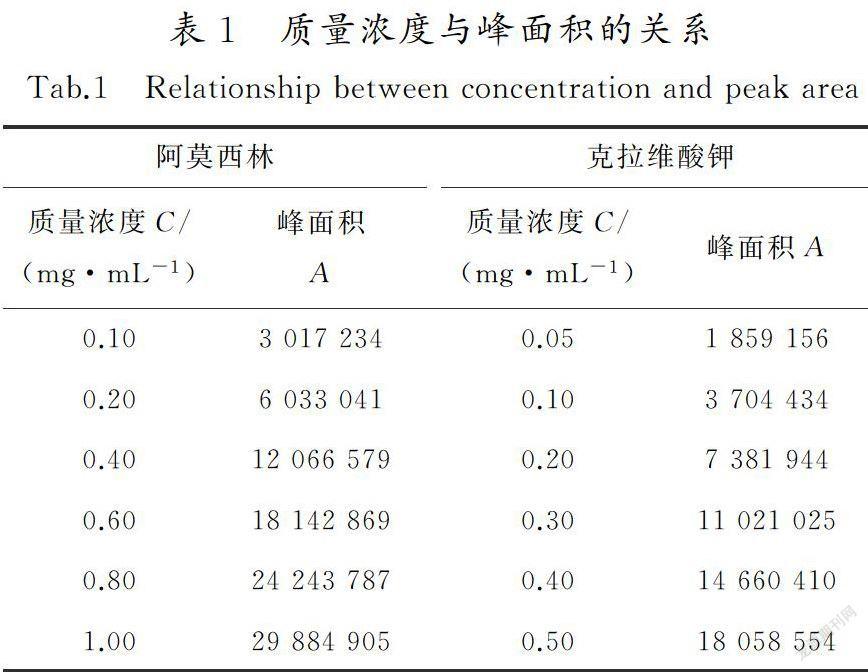
取克拉维酸对照品26.32 mg、阿莫西林对照品58.28 mg,精密称定,用超纯水配制成含克拉维酸0500 1 mg/mL和含阿莫西林1.000 1 mg/mL的对照品储备液。准确移取储备液1,2,4,6和8 mL,分别置于10 mL量瓶中,用超纯水稀释定容至刻度,摇匀,得到克拉维酸质量浓度分别为005,010,020,030,040,050 mg/mL和阿莫西林质量浓度分别为010,020,040,060,080,100 mg/mL的标准品溶液。分别吸取20 μL进样,记录色谱图。以对照品峰面积A为纵坐标,质量浓度C为横坐标进行线性回归,得到克拉维酸的线性方程为A=36 136 625.041 1C+112 292.364 4(r=0.999 8) ,表明克拉维酸在质量浓度为0.050 0~0.500 1 mg/mL时与峰面积的线性关系良好;阿莫西林的线性方程为A=29 999 898.274 0C+64 788.391 8(r=0.999 9),表明阿莫西林在质量浓度为0100 0~1000 1 mg/mL时与峰面积的线性关系良好。结果见表1。
2.5回收率试验
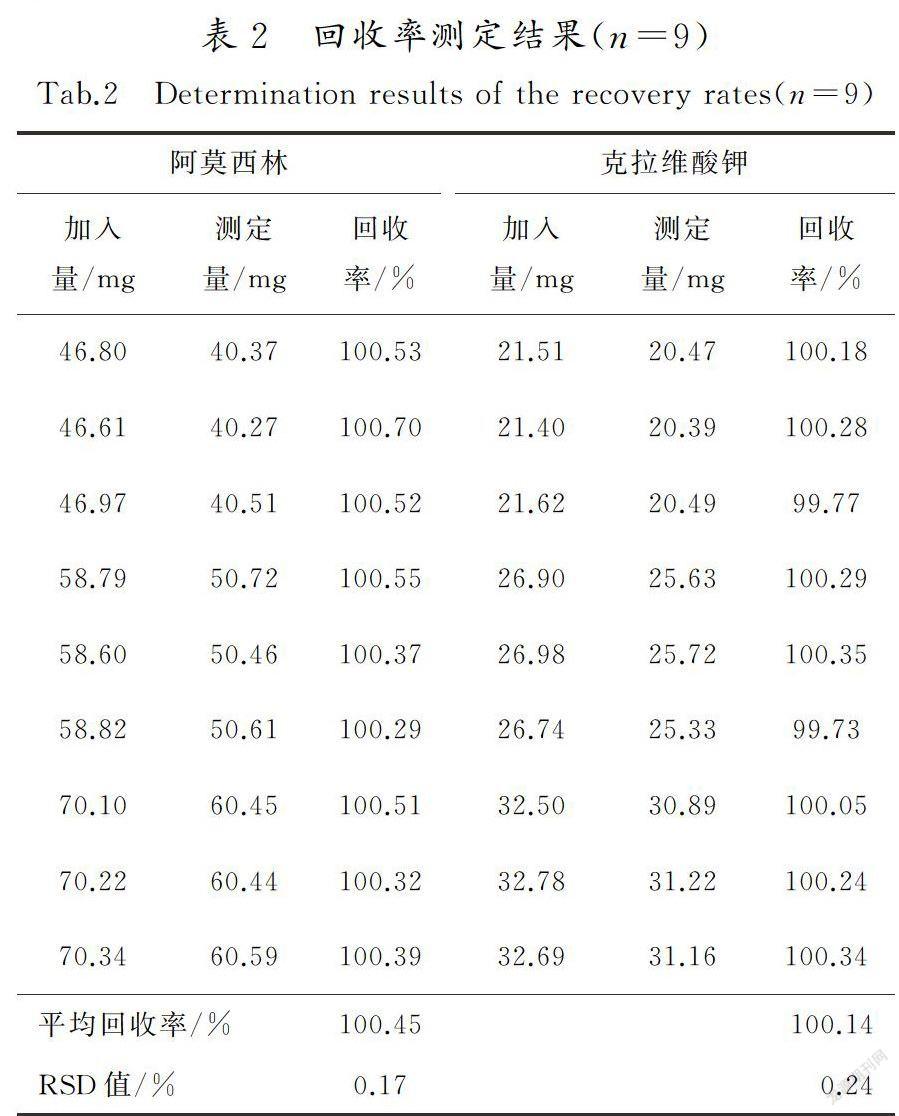
按处方比例称取辅料和阿莫西林原料制成的无克拉维酸钾的空白辅料,分成9等份,3 份为一组,分别精密加入一定量的克拉维酸钾对照品,充分混
合均匀后置于100 mL 量瓶中,按“2.1”项所述方法进行分析,记录色谱图。按处方比例称取辅料和克拉维酸钾原料制成的无阿莫西林的空白辅料,分成9等份,3 份为一组,分别精密加入一定量的阿莫西林对照品,充分混合均匀后置于100 mL 量瓶中,按“2.1”项所述方法进行分析,记录色谱图。结果见表2。
2.6检测限和定量限试验
取阿莫西林对照品适量,加入超纯水溶解,配制成质量浓度为0.101 1 mg/mL的溶液,然后逐步稀释至原质量浓度的1/100 ,1/500 ,1/1 000,1/5 000 ,1/10 000,按上述色谱条件进样测定,最小检出限为10.11 ng/mL(S/N=3),最小定量限为20.22 ng/mL(S/N=10)。
取克拉维酸钾对照品适量,加入超纯水溶解,配制成质量浓度为0.100 4 mg/mL的溶液,然后逐步稀释至原质量浓度的1/100 ,1/500 ,1/1 000,1/2 000,1/5 000,1/10 000,按上述色谱条件进样测定,测得最小检出限为10.04 ng/mL(S/N=3),最小定量限为50.20 ng/mL(S/N=10)。
2.7精密度试验
精密吸取“2.2”项同一对照品溶液20 μL,连续重复进样6次,以相应的色谱峰的面积计算RSD值,阿莫西林为0.15%、克拉维酸为0.07%(n=6),结果见表3。结果表明,仪器的精密度良好。
2.8重复性试验
取阿莫西林克拉维酸钾片样品(规格为0.375 g,批号为170201),配制成供试样品溶液6份,按“2.1”项所述色谱条件重复测定阿莫西林和克拉维酸钾含量(质量分数,下同),结果见表4 。结果表明,该方法的重复性良好。
2.9稳定性试验
取同批阿莫西林克拉维酸钾片样品(规格为 0375 g,批号为170201),按“2.2”项所述方法制备供试品溶液,室温放置,按“2.1”项色谱条件分别于0,2,4,6和8 h进样分析,记录供试品溶液各色谱图的峰面积,结果见表5。结果表明,供试品溶液在8 h内的稳定性良好。
3样品测定
按外标法以峰面积计算克拉维酸钾和阿莫西林的含量,分别用新方法和《药典》方法对3批样品的含量进行测定,测定结果如表6和表7所示。比较表6和表7中2种方法的测定结果发现,新方法中主峰与杂质峰达到基线分离,分离度大于1.5。
4结语
1)本文所述新方法采用Ultimate AQ-C18色谱柱、纯缓冲盐A相作为流动相进行等梯度洗脱,减少了有害溶剂的使用,将对人体的伤害降到最低,达到了绿色环保检测的效果。
2)克拉维酸钾尾部杂质被完全分离出,与相邻杂质能够实现完全基线分离,且克拉维酸钾峰与其前邻杂质峰的分离度达到3.8,与其后杂质峰的分离度达到5.0;阿莫西林主峰与其前峰的分离度达到23,与其后峰的分离度达到7.9,均优于《药典》条件。
3)按外标法以峰面积计算克拉维酸钾和阿莫西林的含量,新方法中主峰与杂质峰达到基线分离,分离度大于1.5,较好地解决了《药典》方法峰型拖尾和分离度不好等问题。新方法的专属性好,准确度高,操作简便快捷,结果可靠,可作为质量控制方法。
4)本研究虽然相比《药典》方法分离度好,使用的溶剂绿色环保,但尚存在不足之处,如分析时间较长,导致分析效率较低。未来需要在缩短分析时间方面加以深入研究,建议采用UPLC进行分析,因为在分离色谱峰时,UPLC的分离度高出HPLC 1倍,甚至更多,分析时间也缩短为HPLC的1/3,分辨率和灵敏度也能得到有效提高[21]。在条件允许的情况下,采用UPLC对该品种进行分析将是不错的选择。
参考文献/References:
[1]CHONG X M, ZOU W B, YAO S C,et al. Rapid analysis of the quality of Amoxicillin and Clavulanate potassium tablets using diffuse reflectance near-infrared spectroscopy[J].AAPS Pharm Sci Tech, 2017,18(4):1312-1317.
[2]黃敏文,袁耀佐,张玫,等. 国产阿莫西林克拉维酸钾片质量评价[J]. 药物分析杂志,2012,32(3):520-526.
HUANG Minwen,YUAN Yaozuo,ZHANG Mei,et al.Quality evaluation of domestic Amoxicillin and Clavulanate potassium tablets [J].Chinese Journal of Pharmaceutical Analysis, 2012,32(3):520-526.
[3]关旭久,张旭,洪晓菲,等.阿莫西林克拉维酸钾分散片含量测定方法的探讨[J].中国处方药,2015,13(1):16-17.
GUAN Xujiu,ZHANG Xu,HONG Xiaofei, et al. Determination of the content of Amoxicillin potassium Clavulanate dispersible tablets[J].Journal of China Preseription Drug,2015,13(1):16-17.
[4]蔡玲玲,邹丹. 国产阿莫西林克拉维酸钾片的质量评估[J]. 中国现代药物应用,2015,9(16):272-273.
CAI Lingling,ZOU Dan. Quality evaluation of domestic Amoxicillin and Clavulanate potassium tablets[J].Chinese Journal of Modern Drug Application, 2015,9(16):272-273.
[5]郝瑞霞,王景欣. 自产阿莫西林克拉维酸钾片与原研产品的体外溶出一致性分析[J].中国医药导刊,2016,18(8):854-857.
HAO Ruixia,WANG Jingxin.In vitro dissolution profile comparison on Amoxicillin and Clavulanate potassium tablets and innovator drug[J].Chinese Journal of Medicinal Guide, 2016,18(8):854-857.
[6]林蘭,牛剑钊,许明哲,等. 国外仿制药一致性评价比较分析[J]. 中国新药杂志,2013,22(21):2470-2474.
LIN Lan,NIU Jianzhao,XU Mingzhe,et al.Comparative analysis of consistency evaluation for generic drugs in foreign countries[J].Chinese Journal of New Drugs, 2013,22(21):2470-2474.
[7]刘昌孝. 药品安全战略与仿制药一致性评价策略[J]. 中国临床药理学与治疗学,2016,21(10):1081-1087.
LIU Changxiao.Strategy for drug safety and consistency evaluation of generic drugs[J]. Chinese Journal of Clinical Pharmacology Therapeutics,2016,21(10):1081-1087.
[8]许明哲,牛剑钊,陈华,等. 浅谈仿制药质量一致性评价过程管理的原则及政策依托[J]. 中国新药杂志,2013,22(21):2475-2477.
XU Mingzhe, NIU Jianzhao,CHEN Hua,et al. Principle and policy for process management of consistency evaluation for generic drugs[J].Chinese Journal of New Drugs, 2013,22(21): 2475-2477.
[9]陈震,杨建红,张彦彦,等.影响我国化学药品仿制药质量的潜在因素分析[J]. 中国新药杂志,2017,26(12):1345-1350.
CHEN Zhen,YANG Jianhong,ZHANG Yanyan,et al. Analysis of the potential factors affecting the quality of chemical generic drugs in China[J]. Chinese Journal of New Drugs,2017,26(12):1345-1350.
[10]国家药典委员会. 中华人民共和国药典(二部)[M]. 北京: 中国医药科技出版社, 2015: 435.
[11]劳乔莲,邱文涛,劳秋立. 阿莫西林-克拉维酸钾干混悬剂(8∶1)的质量标准控制[J]. 中国处方药,2017,15(8):29-31.
LAO Qiaolian,QIU Wentao,LAO Qiuli. The study of quality standards on Amoxicillin and Clavulanate potassium for suspension(8∶1)[J]. Journal of China Prescription Drug, 2017,15(8):29-31.
[12]张珂. HPLC法测定阿莫西林克拉维酸钾颗粒的含量[J]. 药学进展,2007,31(5):221-224.
ZHANG Ke. Determinationof Amoxicillin and Clavulanate potassium granules by HPLC[J]. Progressin Pharmaceutical Sciences, 2007,31(5):221-224.
[13]张亚洲,樊兰兰,屈啸声,等. RP-HPLC法测定阿莫西林克拉维酸钾干混悬剂(14∶1) 中阿莫西林克拉维酸的含量[J].安徽医药,2013,17(2):207-210.
ZHANG Yazhou,FAN Lanlan,QU Xiaosheng,et al.Determinnation of Amoxicillin and Clavulanate potassium suspension (14∶1) by RP-HPLC[J].Anhui Medical and Pharmaceutical Journal, 2013,17(2):207-210.
[14]黄敏文,袁耀佐,钱文,等.UPLC-UV法同时测定阿莫西林克拉维酸钾片中阿莫西林和克拉维酸的含量及其在国产片剂溶出曲线测定中的应用[J]. 药物分析杂志,2013,33(12):2171-2175.
HUANG Minwen,YUAN Yaozuo,QIAN Wen,et al.Simultaneous determination of Amoxicillin and Clavulanate in amoxicillin and clavulanate potassium tablets by UPLC-UV and its application in the dissolution profile study in domestic tablets[J].Chinese Journal of Pharmaceutical Analysis,2013,33(12):2171-2175.
[15]沈丹丹,吴群,胡幸,等. 阿莫西林/克拉维酸钾干混悬剂有关物质测定方法的比较研究[J]. 中国抗生素杂志,2016,41(11):848-852.
SHEN Dandan, WU Qun, HU Xing,et al. Comparative study on determination methods of Amoxicillin and Clavulanate potassium for suspension[J]. Chinese Journal of Antibiotics,2016,41(11):848-852.
[16] 王德刚,程玉宝,马萍,等. 阿莫西林克拉维酸钾缓释片含量测定及释放度测定方法研究[J]. 今日药学,2010,20(10):19-22.
WANG Degang,CHENG Yubao,MA Ping,et al.Study on determination of content and release of Amoxicillin and Clavulanate potassium sustained-release tables[J].Pharmacy Today,2010,20(10):19-22.
[17]崇小萌,李进,王琰, 等. 阿莫西林克拉维酸钾片剂的关键质量属性与控制[J].药学学报, 2016,51(7): 1121-1124.
CHONG Xiaomeng,LI Jin,WANG Yan,et al. The control of the critical quality attributes of Amoxicillin and Clavulanate potassium tablet[J]. Acta Pharmaceutica Sinica, 2016,51(7): 1121-1124.
[18] 左登平. 利用NIR技術建立阿莫西林克拉维酸钾颗粒一致性比对模型的研究[J]. 黑龙江医药,2014,7(5):1044-1046.
ZUO Dengping.Study on conformity test of Amoxicillin and Clavulanate potassium granules by near infrared spectroscopy[J].Heilongjiang Medicine Journal,2014,7(5):1044-1046.
[19]薛晶,朱克旭,崇小萌,等. 水分对阿莫西林克拉维酸钾颗粒稳定性的影响[J]. 中国药学杂志,2016,51(3):224-229.
XUE Jing,ZHU Kexu,CHONG Xiaomeng,et al.Influence of moisture on stability of Amoxicillin and potassium Clavulanate granules[J].Chinese Pharmaceutical Journal, 2016,51 (3):224-229.
[20]周文杰,张丽英. 校正因子在阿莫西林/克拉维酸钾片含量测定中的应用探讨[J]. 中国抗生素杂志,2009,34(10):637-640.
ZHOU Wenjie,ZHANG Liying. Research of the application of correction factorin the determination of Amoxicillin and potassium Clavulanate tablets[J]. Chinese Journal of Antibiotics, 2009,34(10):637-640.
[21]郑勤琴,项勋,段纲,等.高效液相色谱和超高效液相色谱在药物分析中的应用研究[J].上海畜牧兽医通讯,2017(2):57-59.
ZHENG Qinqin,XIANG Xun,DUAN Gang,et al.Applications of HPLC and UPLC in pharmaceutical analysis[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2017(2):57-59.

