车桑子丛枝病的病原分子检测鉴定及风险分析
李龙,刘乐荷,伍建榕,,蒋勇,冯立,赵霞
(1. 西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650224; 2. 西南林业大学 林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224; 3. 攀枝花市林业局森林病虫害防治检疫站,四川 攀枝花 617202)
车桑子Dodonaeaviscosa为无患子科Sapindaceae车桑子属植物,广泛分布在热带、亚热带、暖温带,中国主要分布在华南和西南地区。在云南金沙江干热河谷中部两岸、福建南部、台湾、广东、广西、海南、四川均有分布。车桑子是西南干热河谷地区重要的本土树种,对该地区植被恢复、水土保持、土壤有机碳含量提高具有重要作用[1]。
植原体phytoplasma原称类菌原体(MLO),是一类无细胞壁,存在于植物筛管细胞、介体昆虫各个组织中的类似植物病原细菌,不能单独培养的原核生物。植原体能引起许多林木、蔬菜、农作物发病,给农林生产造成重大损失,最近几年发现比较多,并且有不断增加的趋势[2]。由植原体引起的病害能让寄主产生以下几种症状:主枝和侧枝生长受到抑制,腋芽和不定芽大量生长,从而形成丛枝、矮化症状;叶片褪绿黄化,叶变小;花器发生变态;果实变小、畸形或不结实。在调查攀枝花林木病虫害过程中发现车桑子丛枝病发生较为普遍,为了防止车桑子丛枝病发生面积的进一步扩大,也为了更好地防治此种病害,利用已建立的PCR技术对在攀枝花采集的车桑子丛枝病株进行了植原体检测,对扩增得到的植原体16S rDNA片段进行同源性比对和系统发育分析,并应用林业有害生物风险分析指标体系对车桑子丛枝病进行风险评估分析。
1 材料和方法
1.1 病害调查 在攀枝花市米易县10个车桑子种植区进行丛枝病调查,在每一种植区选择50 m×50 m样方,在样方内随机选择30株车桑子调查,记录丛枝车桑子的株数。
1.2 基因检测材料 车桑子丛枝病植株和无症植株于2015年6月采自四川省攀枝花市米易县草坝子车桑子种植区。同时在云南省红河州建水县和元阳县采集无症车桑子植株作为阴性对照,样品均保存在-80 ℃冰箱。
1.3 车桑子丛枝病植原体的检测
1.3.1 叶片总DNA提取 分别称取0.1 g丛枝病植株和无症状植株的幼嫩叶片,用植物基因组DNA提取试剂盒(OMEGA)(昆明硕阳科技有限公司)提取车桑子叶片的总DNA,并将DNA置于-20 ℃冰箱中保存,备用。
1.3.2 引物及PCR反应条件 利用植原体16S rDNA通用引物R16mF2 (5′-CATGCAAGTCGAACGGA-3′)/R16mRl(5′-CTTAACCCCAATCATCGAC-3′)[3]为常规PCR引物,目的条带为1 500 bp,然后以通用引物对R16F2(5′- ACGACTGCTGCTAAGACTGG-3′)和R16R2(5′-TGACGGGCGGTGTGTACAAA-3′)[3]为巢式PCR扩增引物,预期产物为1 200 bp。常规PCR总反应体系为20 μL,其中,2×Power Tap PCR MasterMix(北京百泰克生物技术有限公司产品)为10 μL,双蒸水为7.8 μL,上下游引物各0.6 μL,DNA模板1 μL。PCR反应条件为95 ℃预变性5 min后,进入以下循环:94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸2 min 30 s,35个循环后在72 ℃条件下保持10 min,最后在PCR仪4 ℃条件下存放。待整个PCR反应结束后,取PCR产物5 μL在1%琼脂糖凝胶中点样,进行电泳检测,其余放在-20 ℃保存备用。以常规PCR产物为反应模板,以 R16F2/R16R2为扩增引物,52 ℃退火1 min,72 ℃延伸2 min,30个循环,进行巢式PCR扩增(其余反应条件同常规PCR)。最后分别取PCR产物5 μL在1%琼脂糖凝胶中电泳检测。
1.4 核苷酸序列测定及分析 将含有目的片段的Nested-PCR产物送至昆明硕阳科技有限公司测序,将测得的16S rDNA基因序列在NCBI中进行BLAST分析。从NCBI数据库中分别下载来自不同组的植原体,利用MEGA7.0中的邻接法构建系统进化树。
1.5 风险评估分析 林业有害生物(不含有害植物)风险分析指标体系[4-5]参照表1,风险分析指标体系采用的量化计算公式见表2。

表1 林业有害生物(不含有害植物)风险分析指标体系
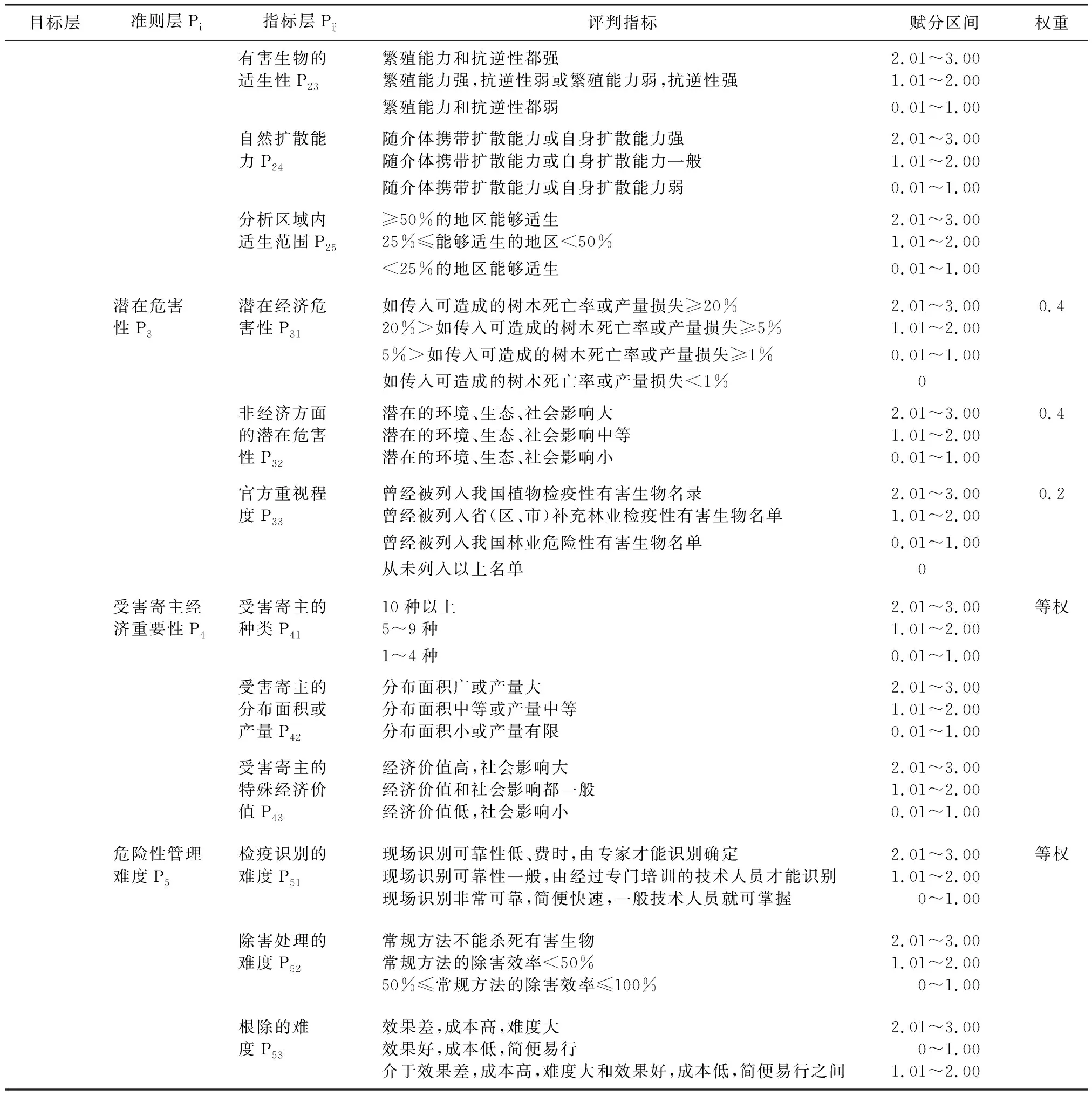
续表
风险分析等级划分标准 风险综合评价值(R)分为4级,2.50≤R<3.00代表特别危险,2.00≤R<2.50代表高度危险,1.50≤R<2.00代表中度危险,0≤R<1.50代表低度危险。

表2 风险分析指标体系采用的量化计算公式
2 结果分析
2.1 车桑子在种植区的发病情况 车桑子丛枝病的症状表现为小叶、黄化、丛枝。感病植株的树势比正常植株弱,腋芽和不定芽大量生长,形成丛枝、矮化症状(图1)。

图1 车桑子丛枝病株和健株症状比较
米易县各车桑子种植区调查发现,坊田乡的车桑子感病率最高,达到53.4%,小麻柳坪的车桑子感病率最低,为16.7%(表3)。
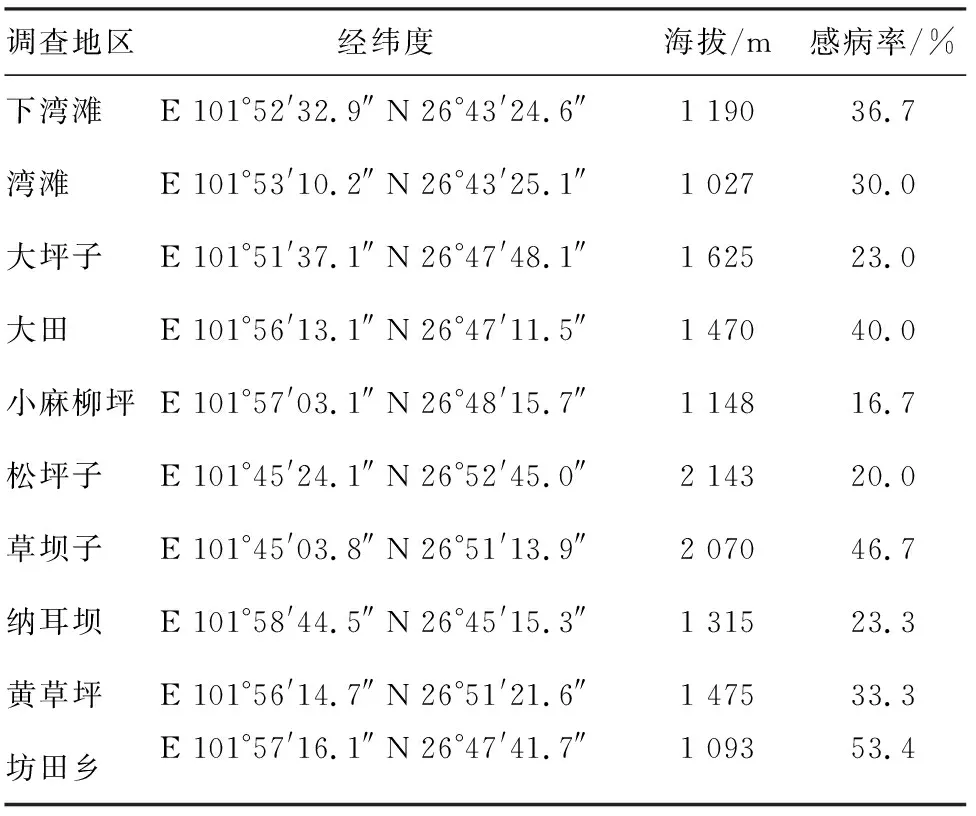
表3 米易县种植区车桑子感病率
2.2 PCR测序分析 分别以无症和感病车桑子植株总DNA为模板,用R16mF2/R16mR2引物对进行普通PCR,以及用R16F2/R16R2引物对进行巢式PCR扩增,其中在攀枝花市米易县采集的无症和感病车桑子样品中均获得较亮的DNA片段,约1 200 bp,与Lee[3,6]等的结果相同,说明此种病原为系统侵染,而且植株中含有植原体病原;在云南省红河州元阳县和建水县采集的无症车桑子植株,并没有发现约1 200 bp的DNA片段,说明了车桑子没有被植原体侵染(图2)。
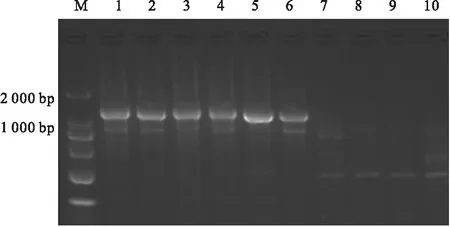
注:M:2 000 bp Marker; 1-3.米易县丛枝症状车桑子; 4-6.米易县无症车桑子; 7-8.建水县无症状车桑子; 9-10.元阳县无症车桑子。
图2车桑子丛枝植原体16SrDNA巢式PCR扩增
2.3 系统进化树的构建与同源分析 获得的1条植原体DNA序列(登录号:MG470796)与 GenBank中登录的植原体各组中的代表性序列比较,并通过构建系统进化树)进一步对比分析。车桑子丛枝病植原体与翠菊黄化病、柳叶菜属丛枝病、蓝莓丛枝病病原等16S rI-B组的各植原体株系在同一进化枝上(图3)。

图3 用邻接法构建的车桑子丛枝病植原体16S rDNA系统进化树
2.4 风险评估分析
2.4.1 有关分布 我国车桑子主要分布在云南金沙江干热河谷中部两岸;除此之外,国内的福建南部、台湾、广东、广西、海南、四川均有分布。而车桑子丛枝病主要分布在我国干热河谷地区。
2.4.2 潜在危害性 引起车桑子丛枝病的病原为植原体。植原体寄主范围广,危害严重;受害植物近千种,在我国由植原体引起的泡桐丛枝病、枣疯病、苦楝丛枝病、桑萎缩病、莴苣黄化病等是一类毁灭性病害,长期以来对我国经济作物和绿化树种造成了巨大损失。
2.4.3 寄主植物的经济重要性 在我国干热河谷地区,凡是车桑子生长的地方均能发现车桑子丛枝病的存在。车桑子是我国干热河谷地区植被恢复的重要树种。车桑子丛枝病的蔓延将影响车桑子生长和生态环境建设,从而威胁着我国干热河谷地区的植被恢复。
2.4.4 传播扩散的可能性 车桑子丛枝病的传播途径主要有3种。一是木虱传播。其靠飞行和借助风力可以进行远距离传播。二是接穗传播。嫁接换种或育苗时,无意间选取了病树上的接穗引起丛枝病传播蔓延。三是苗木传播。苗木从疫区调进。种植了带病苗木引起传播蔓延。
2.4.5 危险性管理难度 抗生素防治车桑子丛枝病有一定效果,考虑到车桑子丛枝病的发生面积较大、侵染来源较多,且该病具有隐症现象,该病难以在短时间内得到控制。
2.4.6 评估分析 综合分布情况、潜在危害性、寄主植物的重要性、传播扩散的可能性和危害性管理难度等几个方面的描述,对车桑子丛枝病的各个风险评估指标进行赋分(表4)。

表4 车桑子丛枝病风险评估指标及赋值

续表
根据风险分析指标体系采用的量化计算公式(表2),对车桑子丛枝病进行各项评判指标和风险性R计算;其中分析区域内分布情况P1=2.05;传入、定殖和扩散的可能性P2=2.277 2;潜在危害性P3=0.884;受害寄主经济重要性(受害对象的重要性)P4=2.0;危险性管理难度P5=2.47;风险综合评价值R=1.900 8,达到中度危险级别。
3 结论与讨论
利用植原体16S rDNA通用引物,对攀枝花市米易县草坝子丛枝车桑子植株和健康车桑子植株进行巢式PCR检测,可扩增出1.2 kb的特异条带,在看似健康的车桑子叶片中都能检测到植原体的存在,说明车桑子丛枝病存在潜伏期。测序序列均与植原体有同源性关系,且与植原体的16S rI-B亚组同源性最高;对云南红河州两县的车桑子健康植株进行巢式PCR检测,没有扩增出1.2 kb的特异条带,反应米易县车桑子丛枝病的危害程度较高;通过对攀枝花米易县车桑子丛枝病进行风险评估,其风险综合评价值R=1.900 8,这种病害达到中度危险级别。车桑子作为干热河谷地区重要的固沙保土、植被恢复的重要树种,车桑子丛枝病是危害车桑子的一种严重病害。患车桑子丛枝病的植株不能像其它作物一样直接铲除,因此相关部门应该给予重视。为了控制这种病害蔓延,建议林业、农业部门统一认识,协同防治,确保防治效果,把疫区控制在最小范围。从构建的系统进化树观察可知,检测序列属于16S rI-B亚组,并且与翠菊黄化病、苦楝丛枝病、白蜡树丛枝病等16S rI-B组各植原体株系在同一进化枝上。于少帅 等[7]通过多位点序列分析将不同地区的苦楝丛枝分为4个进化类群,而干热河谷不同地区的车桑子丛枝是否也分为不同的类群还需进一步研究。本次只研究米易县的车桑子丛枝病,干热河谷地区的车桑子丛枝病是否存在明显的地区专化型,是否存在不同地区的遗传多样性,要回答这些问题还需通过扩大样品的检测数量、测定核糖体蛋白(rp)基因、延伸因子(tuf)基因等较16S rDNA具有较大变异性的基因以获得更多分子生物学信息来加以证实[8]。

