髓源树突细胞源性外泌体对实验性自身免疫性重症肌无力大鼠NK及NK T细胞的影响
杜通 杨春林 李亨 张民 刘儒涛 岳龙涛 李晓丽
重症肌无力(myasthenia gravis,MG)是一种由乙酰胆碱受体(acytylcholine receptor,AChR)抗体介导、细胞免疫依赖及补体参与的、累及神经-肌肉接头突触后膜上AChR的自身免疫性疾病。外泌体(exosomes)可由树突细胞(DCs)、T淋巴细胞、B淋巴细胞、肿瘤细胞等多种细胞分泌而来,可携带其来源细胞的成份。DCs源性外泌体稳定、易保存,可作为一种免疫干预手段来治疗免疫性疾病。研究发现,自然杀伤(natural killer,NK)细胞和NK T细胞在抗肿瘤免疫、保护性免疫应答及免疫调节中发挥重要作用[1-2]。NK细胞及NK T细胞在自身免疫性疾病的中作用目前尚不完全明确,尤其是其在MG/实验性自身免疫性重症肌无力(EAMG)中还存在一定争议。本研究探讨了他汀类药物诱导的髓源树突细胞(BMDCs)源性外泌体是否能够通过影响NK细胞和NK T细胞来发挥其对EAMG的免疫调节作用。
1 材料和方法
1.1实验动物雌性Lewis大鼠10只,购于北京维通利华实验动物技术有限公司,6~8 周龄,体质量140~160 g,在SPF级动物房条件下饲养。
1.2主要试剂人工合成的大鼠来源的AChR α亚基97-116(R97-116)肽段(DGDFAIVKFTKVLLDYTGHI),购自西安联美生物科技有限公司;阿托伐他汀由北京嘉林药业股份有限公司提供;重组大鼠粒细胞巨噬细胞-集落刺激因子(rrGM-CSF)和重组大鼠白细胞介素4(rrIL-4)购自美国Peprotech 公司;H37Ra结核杆菌购自美国Difco公司;不完全福氏佐剂、二甲基亚砜、MEM均购自美国Sigma-Aldrich公司;PE标记的抗大鼠CD3抗体、FITC标记的抗大鼠CD161a抗体和抗大鼠干扰素γ(IFN-γ)抗体购自BioLegend公司;PE标记的抗大鼠白细胞介素10(IL-10)抗体购自Pharmingen公司;RPMI1640购自北京HyClone公司;胎牛血清(FCS)购自美国Gibco公司。
1.3方法
1.3.1 EAMG模型制备:取人工合成的大鼠来源的R97-116肽段溶于H37Ra株热灭活结核杆菌和不完全福氏佐剂中,双后足垫皮下注射免疫大鼠,每只大鼠用量为200 μL[3]。免疫当天记为0 d,免疫后第11天于大鼠背部脊柱两侧皮下强化免疫1次。从免疫当天至发病高峰期(免疫后第42天),采用双盲法隔天称重并观察大鼠症状。肌力测量采用Lennon评分标准。轻度肌无力者给予疲劳试验,即让大鼠重复抓握笼顶30 s后再测量肌力。具体分级如下:0级,正常肌力;1级,活动轻度减少,抓握力或叫声减弱,尤其在重复抓握后更加明显;2级,抓握前即出现震颤、低头、隆背、抓握力弱;3级,抓握前即有严重的肌无力表现,无力抓握,频死状态;4级,死亡。
1.3.2 BMDCs制备及表型分析:无菌条件下取发病初期EAMG大鼠的股骨和胫骨(n=10),用无菌PBS冲洗髓腔,然后在无菌滤网上进行研磨制备单个核细胞(mononuclear cells,MNC)悬液,经破膜后置于75 cm2培养瓶中培养1 h 40 min,留取贴壁细胞;加入完全培养液(含10 ng/mL rrGM-CSF和10 ng/mL rrIL-4)于37℃、5%(体积分数)CO2条件下继续培养10 d,收集悬浮的细胞进行计数,按1×106/mL水平种于培养板中(完全培养基中的FCS为经超高速离心去除外泌体成份的血清),分别加入阿托伐他汀溶液(终浓度10 μmol/L)和等体积的DMSO,记为他汀BMDCs和对照BMDCs。培养48 h后通过荧光显微镜观察不同组BMDCs的形态学变化,再分别收集细胞培养上清和相应组的BMDCs。分别取他汀BMDCs和对照BMDCs洗涤后,加入PE标记的抗大鼠CD80抗体(BioLegend,San Diego,CA,USA),FITC标记的抗大鼠CD86(BioLegend)和FITC标记的抗大鼠主要组织相容性复合体Ⅱ(MHC-Ⅱ)抗体(eBioscience,San Diego,CA,USA),4 ℃下孵育30 min,洗涤后经流式细胞仪检测CD80+、CD86+和MHC-Ⅱ+细胞的百分比。
1.3.3 外泌体的提取及鉴定:将不同组的BMDCs培养上清进行梯度离心(n=30),分别以300g(5 min)、1200g(20 min)和10 000g(30 min)离心以去除细胞和碎片;随后按100 000g离心1 h,离心2遍;最后将提取的外泌体悬于PBS中,并通过K5600 MicroSpectroPhotoMeter(北京凯奥技术发展有限公司,中国)进行定量分析。按文献[4]实验方法,采用电镜观察外泌体形态,表现为一种直径约30~100 nm的微囊泡结构;采用流式细胞术检测外泌体表面共刺激分子的表达情况,发现他汀Dex和对照Dex均可表达相应BMDCs来源的共刺激分子CD80、CD86和MHC-Ⅱ。
1.3.4 动物分组:利用随机数字表将10只EAMG大鼠随机分为他汀Dex治疗组和对照Dex治疗组,每组5只。于免疫后的第5天和第13天分别给予尾静脉注射相应的外泌体(每只大鼠每次注射10 μg),观察大鼠症状直至发病高峰期(免疫后第42天)。
1.3.5 淋巴结MNC悬液的制备:在发病的高峰期,无菌条件下取腹股沟淋巴结,在放有无菌滤网的培养皿中研磨淋巴结,制备MNC悬液,计数后调整细胞水平为2×106个细胞/mL。
1.3.6 流式细胞术检测:取1×106个淋巴结MNC,加入PE标记的抗大鼠CD3抗体、FITC标记的抗大鼠CD161a抗体、FITC标记的抗大鼠IFN-γ抗体(Biolegend)、PE标记的抗大鼠IL-10抗体(Pharmingen,San Diego,CA,USA),4℃避光孵育30 min,洗涤后通过流式细胞仪检测各组EAMG大鼠淋巴结MNC中NK细胞、NK T细胞及IFN-γ+、IL-10+细胞的表达情况,结果以占淋巴结MNC的百分比表示。
1.3.7 血清抗R97-116 IgG抗体及其亚型检测:采用ELISA法进行检查。首次免疫后第42天分别处死2组EAMG大鼠,留取心脏血血清。用R97-116(5 μg/mL)包被平底的96孔酶标板,4℃保湿过夜。用含有0.05%(质量浓度)Tween 20和10%(体积分数)FCS的PBS 200 μL封闭酶标板,37℃孵育1.5 h。将待测血清标本(1∶100稀释)加至孔中,每例标本设置3复孔,孵育2 h。后加入生物素标记的兔抗大鼠IgG(1∶3000;北京博奥森生物有限公司,中国)、IgG1、IgG2a和IgG2b(1∶500;BioLegend)孵育1 h。加入辣根过氧化物酶标记的链霉亲和素,孵育30 min。洗板后加入四甲基联苯胺底物显色。用酶标仪测定450 nm处吸光度〔D(λ)〕值。
1.4统计学处理采用SPSS17.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,两均数间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1BMDCs及其源性外泌体的特征BMDCs经与阿托伐他汀和DMSO共培养48 h后的形态学如图1所示,与DMSO相比,阿托伐他汀与BMDCs共培养后能够明显抑制EAMG大鼠BMDCs的树突生长,进而影响BMDCs的正常形态。流式细胞术检测发现,与对照BMDCs组比较,他汀BMDCs组表面表达共刺激分子CD80和CD86明显降低(CD80:t=28.1,P<0.01;CD86:t=9.6,P<0.01),而MHC-Ⅱ分子表达无统计学差异(t=-0.96,P=0.41)(图2)。
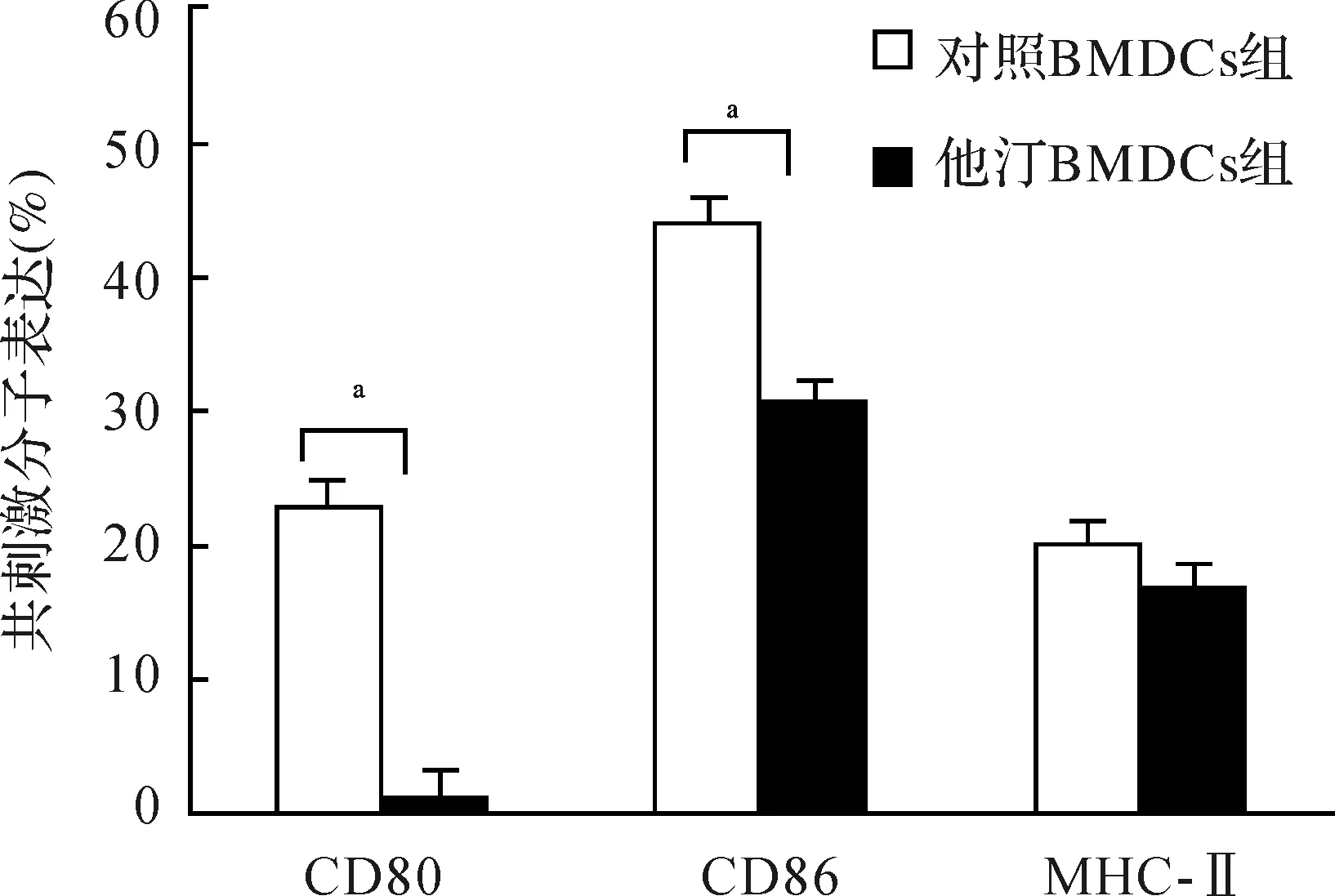
注:MHC-Ⅱ:主要组织相容性复合体Ⅱ;aP<0.01 图2 流式细胞术检测两组BMDCs表面CD80、CD86和MHC-Ⅱ分子表达(n=10)
2.2EAMG大鼠临床症状比较与对照Dex治疗组比较,他汀Dex治疗组EAMG大鼠临床症状明显缓解(P<0.05)。结果见图3。
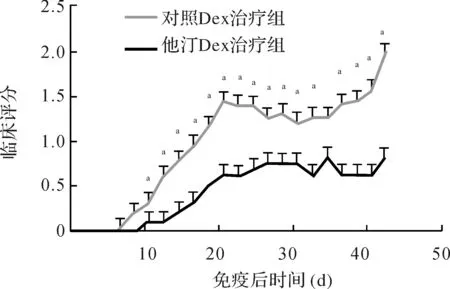
注:EAMG:实验性自身免疫性重症肌无力,表1、图4同;aP<0.05 图3 EAMG大鼠免疫后不同时间临床评分比较(n=5)
2.3流式细胞术检测他汀Dex能够上调EAMG大鼠淋巴结MNC中NK细胞(CD3-CD161a+)数量(P<0.05),但对NK T细胞(CD3+CD161a+)数量却无统计学影响(P>0.05)。他汀Dex治疗组IFN-γ+细胞数较对照Dex治疗组降低(P<0.05),而IL-10+细胞数在两组之间比较无统计学差异(P>0.05)。结果见表1。
2.4各组EAMG大鼠血清抗R97-116IgG抗体及其亚型水平他汀Dex治疗组血清抗R97-116 IgG抗体及其亚型IgG2a、IgG2b抗体水平明显低于对照Dex组(IgG:t=3.75,IgG2a:t=2.33,IgG2b:t=2.92;均P<0.05),而对其亚型IgG1抗体水平无统计学影响(t=-0.31,P=0.76)(图4)。

注:aP<0.05 图4 两组EAMG大鼠血清抗R97-116 IgG抗体及其亚型抗体水平比较(n=5)
3 讨论
DCs作为一种免疫调节细胞,可诱导免疫反应或免疫耐受,但也具有一定的局限性,如不易保存等。DCs源性外泌体可携带MHC-Ⅰ/Ⅱ、CD80、CD86、CD40(与抗原提呈和T细胞刺激作用相关)等与DCs相似的分子。外泌体可通过这些分子与相应的受体细胞相互作用,进而产生一系列的免疫应答反应。研究表明,未成熟BMDCs源性外泌体携带较低水平的MHC-Ⅱ分子及共刺激分子,能够延长肠移植大鼠的存活率[5]。未成熟DCs源性外泌体因低表达MHC-Ⅱ、CD86和细胞间黏附分子-1(ICAM-1),能够明显减少抗原特异性T细胞的活化[6]。经基因修饰的BMDCs来源的外泌体可改善胶原蛋白诱导的关节炎,这种作用主要是由于其表面低表达的MHC-Ⅱ和高表达的FasL分子分别影响抗原提呈和细胞凋亡所致[7]。

表1 流式细胞术检测两组EAMG大鼠淋巴结MNC中NK细胞、NK T细胞及IFN-γ+、IL-10+细胞的表达(±s,%)
注:MNC:单个核细胞;NK:自然杀伤细胞;IFN-γ:γ干扰素;IL-10:白细胞介素10
作者团队前期研究发现,他汀类药物诱导的BMDCs分泌的外泌体(他汀Dex)可通过IDO/Treg途径及部分依赖于FasL/Fas途径来诱导EAMG大鼠的免疫耐受[4]。
他汀类药物是一种3-羟基-3甲基戊二酸单酰辅酶A还原酶的抑制剂,不仅可抑制胆固醇的合成,而且具有免疫调节的作用[8]。他汀类药物可抑制人类DCs表面成熟相关性分子如CD83、CD40、CD86和人类白细胞相关抗原-DR的表达,降低其诱导T细胞增殖的能力[9-10];还能够以剂量依赖性的方式抑制小鼠BMDCs表面共刺激分子MHC-Ⅱ和CD40的表达[11]。作者研究发现,阿托伐他汀在体外能够抑制BMDCs的成熟,影响其形态学及降低表面共刺激分子CD80、CD86的表达;经体外培养的BMDCs分泌的外泌体成份,在电镜下表现为直径约30~100 nm的微小囊泡,经流式细胞术鉴定,显示其可表达与来源BMDCs相似的CD80、CD86及MHC-Ⅱ分子[4]。以上结果提示可成功提取BMDCs源性外泌体。经他汀类药物诱导后的BMDCs所分泌的外泌体则具有耐受性BMDCs的特征,即表现为耐受性外泌体(他汀Dex),同样可诱导EAMG大鼠的免疫耐受,但其对EAMG大鼠体内NK细胞及NK T细胞的影响尚未见报道。
NK细胞是一种异质性多功能的免疫细胞,参与了多种自身免疫性疾病的发生和发展过程[12-13]。有报道显示,NK细胞可产生IFN-γ和肿瘤坏死因子α(TNF-α)等炎性因子,这些炎性因子可上调抗原提呈细胞MHC-Ⅰ和MHC-Ⅱ分子表达;另一方面,IFN-γ诱导的单核细胞因子,可招募NK细胞并活化T细胞[14-15]。NK T细胞是一类新的免疫调节细胞,可通过分泌IL-4、IL-10和IFN-γ、TNF-α调节Th型细胞的分化,并且通过激活细胞毒效应细胞在天然免疫和后天免疫中发挥重要作用[16]。NK及NK T细胞在自身免疫性疾病,尤其是MG和EAMG中的作用机制还存在一定争议。研究发现,清除实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)中的NK 细胞,可导致中枢神经脱髓鞘病变加重,表明NK细胞在EAE中起保护作用[17]。而在EAMG小鼠模型中,NK1.1+细胞能够特异性导致抗AChR IgG2b含量增加,从而促进EAMG的进展[18]。另有研究发现,在爆发型MG患者中,其NK细胞的功能降低[19]。本研究结果显示,经他汀Dex治疗的EAMG大鼠临床症状较轻,血清抗R97-116 IgG抗体水平较低,这与NK细胞上调有关,表明NK细胞在EAMG中起保护作用。本研究结果还显示,他汀Dex治疗后能够下调IFN-γ+细胞数,而IL-10+细胞数却无统计学变化,提示他汀Dex可通过除NK及NK T细胞以外的途径发挥作用。本文研究与部分既往研究结果不一致,可能与动物模型不同有关,其具体的作用机制还有待于深入研究。
综上所述,本研究结果显示,阿托伐他汀在体外能够成功诱导耐受性BMDCs的产生,这些耐受性BMDCs能够分泌他汀Dex,将这些他汀Dex注射于EAMG大鼠体内后,能够明显缓解EAMG的病情。重要的是,这些他汀Dex在体内可通过上调NK细胞数量进而发挥其诱导EAMG免疫耐受的作用。

