抗艰难梭菌毒素纳米抗体在乳酸乳球菌中重组表达及其功能分析
武国松 李杉
(华南理工大学生物科学与工程学院,广州 510006)
艰难梭菌(Clostridium difficile)为革兰氏阳性厌氧芽孢杆菌,是抗生素药物相关性腹泻的主要致病菌[1-2];由于近年来抗生素的广泛使用,特别是强毒菌株(027/NAPI/BI)的出现,使得艰难梭菌感染(Clostridium difficileinfection,CDI)在国内外呈上升趋势[3];CDI常见病症为假膜性结肠炎,外周白细胞明显增多,腹泻,发热等,严重的会出现急性肾衰竭和低血压甚至死亡,复发率高达40%[4]。
目前用万古霉素、非达霉素作为感染的一线治疗方案,然而抗生素药物易进一步破坏肠道微生态,加重菌群失衡,从而引起反复感染[5]。1989年在骆驼的血清中发现一种天然缺失轻链只含有重链的抗体[9]。具有相对分子质量小(分子量只有15 kD左右)、稳定性强、抗原结合性能好、易表达及免疫原性低等特点。这种只由重链可变区构成的单域抗体被称为VHH抗体(Variable domain of heavy chain of heavy-chain antibody,VHH)[6],亦被称为纳米抗体(Nanobody,Nb)。纳米抗体具有多种优势[12-13],在食品及药物开发等领域拥有广阔的前景。
本实验室已获得了从驼羊血清中分离的抗艰难梭菌毒素的基因E3和AA6,通过短小的连接序列(Linker)将E3及AA6串联在一起,从而转化成二价双特异的形式,相比单价纳米抗体,二价纳米抗体具有更高的抗原识别能力及抗原亲和力[7]。从而增强其对毒素B的抑制效率,为治疗艰难梭菌感染奠定基础。
乳酸菌是治疗性蛋白载体,自身具有免疫佐剂作用,能够在强胃酸环境下生存,不需要对抗原进行复杂的处理。乳酸菌高效表达系统NICE(The nisin controlled expression,NICE)是在乳链菌肽(Nisin)诱导下由 nisA 启动子控制目的基因表达的[8]。nisin可以在含有 nisRK的菌中高度诱导克隆在 nisA启动子之后的基因而自身不会产生内毒素。当在菌的对数生长期时加入微量的 nisin,目的基因的浓度依赖诱导将会发生,且诱导作用与 nisin的浓度在一定范围内成正比,诱导效率可高1 000倍以上[9]。
本研究应用NICE系统构建质粒pNZ8148-E3-AA6,获得重组乳酸乳球菌NZ9000/ pNZ8148-E3-AA6,诱导表达纳米抗体,通过SDS-PAGE 和Western blot鉴定表达产物,亲和层析法纯化目标蛋白,并对所获得重组二价纳米抗体进行初步活性鉴定,可以中和艰难梭菌毒素TcdB的细胞毒性。本研究成功在乳酸乳球菌中表达具有抑制TcdB细胞毒性的纳米抗体,旨在为治疗艰难梭菌感染提供一个潜在方法,具有一定的应用前景。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基 乳酸乳球菌NZ9000,质粒pNZ8148(氯霉素抗性)由江南大学生物工程学院张娟博士惠赠。M17培养基:购自青岛海博生物技术有限公司;GM17液体培养基(M17培养基中含 0.5%葡萄糖);G-SGM17液体培养基:M17干粉培养基37.25 g/L,蔗糖0.5 mol/L,甘氨酸2.5%,115℃高压灭菌20 min,待冷却至50℃以下时加入0.22 μm滤膜过滤的葡萄糖溶液,其终浓度为0.5%。细胞培养相关试剂:DMEM(Dulbecco’s Modified Eagle Medium)细胞培养基(Gibco),胰蛋白酶(0.25%Trypsin,Gibco),PBS缓冲液(双螺旋生物科技,上海),胎牛血清(FBS,Gibco),青霉素和链霉素双抗(Gibco),二甲基亚砜(DMSO,Sigma)
1.1.2 主要试剂及仪器 PrimerSTAR Max聚合酶、DNA Marker 购自宝生物工程(大连)有限公司。限制性内切酶NcoⅠ和SacⅠ、T4DNA 连接酶购自Thermo公司。CCK8检测液购自背景索宝来生物科技有限公司,质粒小提试剂盒以及胶回收试剂盒购自TIANGEN公司。革兰阳性菌质粒小提试剂盒购自北京索莱宝科技有限公司,BCA Protein Assay Kit购自Thermo公司,nisin购自 Sigma公司。非洲绿猴肾细胞株(Vero细胞,实验室保存)。其他试剂均为分析纯。PCR仪Bio-Rad公司,凝胶成像仪Bio-Rad,荧光倒置显微镜(Olypus IX71,日本)。Spectramax M5酶标仪购自美谷分子仪器(上海)有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据E3和AA6的基因序列,在E3基因序列的 3′端添加Linker(G4S)密码子,在AA6的3′端添加6个His标签,利用Primer 5.0 设计扩增基因的引物:E3-F1:5′- CATG CCATGGCTATGGCGGCCGCTTCCCAG-3′(下划线处为NcoⅠ酶切位点),E3-R1:5′-ATCGAGCTCTTAG TGGTGGTGGTGGTGGTGTGATCCGCCTCCGCCTTGT GGTTTTGGTGTCTTGGGTTCC-3′(下划线处为SacⅠ酶切位点)。AA6-F2 :5′-ATCGAGCTCATGGCGGCC GCTCAGTTGCA -3′(下划线处为SacⅠ酶切位点),AA6-R2 :5′-CCCAAGCTTTTAGTGGTGGTGGTGGTG GTGTTGTGGTTTTGGTGTCTTGGGTTCTGA-3′(下划线处HindIII酶切位点),引物由生工生物工程(上海)服务有限公司合成。
1.2.2 重组表达载体的构建及蛋白小量表达 PCR分别扩增E3、AA6纳米抗体编码基因,酶切依次将AA6、E3连接至载体pNZ8148 上,双酶切及测序鉴定获得质粒pNZ8148-E3-AA6。按Holo等[10]方法制备乳酸乳球菌 NZ9000感受态细胞。将连接产物通过电穿孔转化法转化到NZ9000感受态细胞中,设置电压2 000 V,电脉冲时间为1.5-5.0 ms。电转细胞在GM17 恢复培养基(含20 mmol/LMgCl2,2 mmol/L CaCl2)30℃培养2 h后,取100 μL涂布到GM17氯霉素抗性平板上,30℃厌氧培养24-48 h。双酶切进行鉴定,重组菌株为NZ9000/ pNZ8148-E3-AA6。
30℃静置培养过夜的重组菌按照1∶100的比例转接至5 mL GM17培养基中(氯霉素终浓度为10 ug/mL),测定不同时间点重组乳酸乳球菌 NZ9000/pNZ8148-E3-AA6的OD600值,在培养至菌液 OD600值为0.4-0.5时加入终浓度为 1 ng/mL 的诱导剂 nisin进行诱导表达,12 h时收集菌体。收集的菌体经超声破碎后,SDS-PAGE和 Western-blot鉴定。
1.2.3 重组乳酸乳球菌的大量表达 将诱导后的菌液500 mL离心,每克湿菌体用3 mL 5 mmol/L咪唑缓冲液重悬,菌体用高压破碎仪进行破碎,4℃12 000 r/min离心30 min 收集上清液。将上清液加入预先用5 mmol/L咪唑缓冲液平衡的Ni-NTA 层析柱内,分别用100(20% buffer B)mmol/L、150(30%buffer B)mmol/L咪唑缓冲液洗脱,并收集洗脱液,SDS-PAGE 电泳检测目的蛋白分离纯化效果,透析至1×PBS溶液,使用BCA 蛋白浓度测定试剂盒测定蛋白浓度。
1.2.4 CCK8法检测二价纳米抗体E3-AA6蛋白对毒素TcdB的抑制实验 在细胞变圆实验中,用不同浓度梯度TcdB处理Vero细胞,并且在显微镜下观察细胞的形态变化。分别统计细胞变圆率,通过观察统计得出,当毒素TcdB浓度为0.0125 ng/mL时,24 h变圆率约为70% 左右,选定此浓度为对照实验施加毒素浓度。将对数生长期Vero细胞,用含10%胎牛血清的DMEM培养基配制1×105/mL细胞悬液,按每孔个细胞约1×104个(100 μL)加入到96 孔细胞培养板中,过夜培养后,进行毒素中和实验。分别设置3个实验组:空白组、对照组、实验组。空白组施加完全培养基,对照组施加完全培养基和0.0125ng/mL TcdB,实验组为Vero细胞同时施加加0.0125 ng/mL TcdB和12.5、25、50 μg/mL的重组纳米抗体蛋白,每个浓度设置3次平行实验。培养2 h,6 h,12 h,18 h和24 h后每孔加入10 μL CCK8 检测液,37℃孵育2 h后,酶标仪在450 nm检测其吸光度值。
1.2.5 统计学处理 采用 Origin 9.1.软件及SPSS 22.0软件进行数据分析,数据以x-±s表示。
2 结果
2.1 重组乳酸乳球菌蛋白表达与鉴定
根据重组乳酸乳球菌的生长曲线确定菌液 OD600为 0.4-0.5时,加入nisin,终浓度为1 ng/ mL。将12h诱导培养的重组乳酸乳球菌,超声破碎处理后进行SDS-PAGE(图1-A)可见经诱导的重组菌在32 kD处有与预期大小一致的条带,未诱导的重组乳酸乳球菌未见相应条带,说明经诱导的目的蛋白在重组乳酸乳球菌中获得表达。
Western-blot、Anti-His-tag抗体检测结果(图2)显示,诱导的重组乳酸乳球菌在32 kD处有特异性条带,表明目的蛋白在重组乳酸乳球菌中获得表达,通过镍柱亲和层析纯化目的蛋白,SDS-PAGE检测(图1-B),BCAProtein Quantification Kit测定其蛋白浓度为 720 μg /mL。
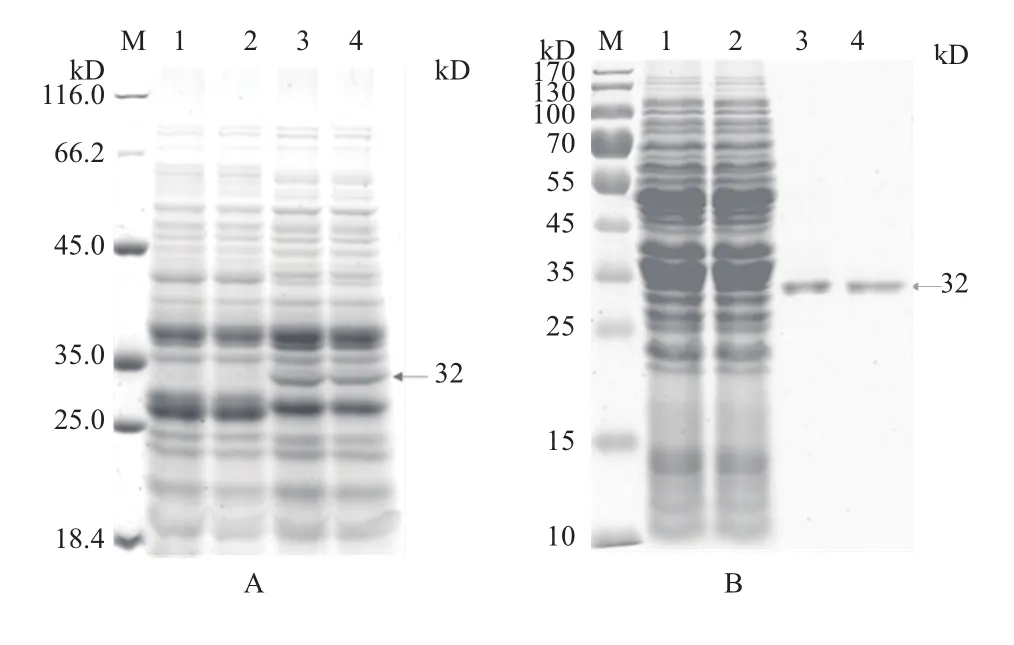
图1 表达产物的 SDS-PAGE分析
2.2 二价纳米抗体E3-AA6蛋白对毒素TcdB的抑制
CCK8法实验结果(图3)表明二价纳米抗体E3-AA6对TcdB有抑制作用,并且TcdB的抑制作用与纳米抗体的浓度呈现一定的正相关,根据公式:抑制率(%)={1-[OD(实验组)-OD(空白)]/[OD(对照组)-OD(空白)]}×100,计算得出当二价纳米抗体E3-AA6浓度为50 μg /mL时,对TcdB的抑制率在24 h时为39%。

图2 表达产物的Western-blotting分析

图3 纳米抗体E3-AA6对毒素TcdB的抑制效应
3 讨论
艰难梭菌广泛存在于自然环境及动物粪便中,是人体肠道中的正常菌群。由于广泛应用广谱抗生素、免疫抑制剂或化疗药物等药物,人体肠道微生物菌群平衡被扰乱,艰难梭菌大量繁殖,引发艰难梭菌感染,导致严重腹泻和肠道炎症甚至死亡。
目前针对艰难梭菌感染,常见的CDI治疗是抗生素治疗[11],甲硝唑用于CDI轻中度患者,万古霉素用于CDI重度患者,菲达霉素是一种大环内酯类抗菌药物,对艰难梭菌有杀菌活性,但是对其他革兰氏阳性菌作用有限,一般用于治疗复发患者[12]。但近年高毒素菌株出现,药物的敏感性降低,甲硝唑和万古霉素可进一步破坏肠道微生态平衡,艰难梭菌感染复发率很高,且治愈后复发率高达25%-60%[13]。因此抗生素药物需要向窄谱,不可吸收,可重复给药,安全性高等方向发展[14]。另一种新型CDI治疗方式是粪菌移植法,其原理是将健康供体的粪便经过过滤后注入到患者的结肠中,达到重新恢复正常结肠菌群的目的[15-16]。
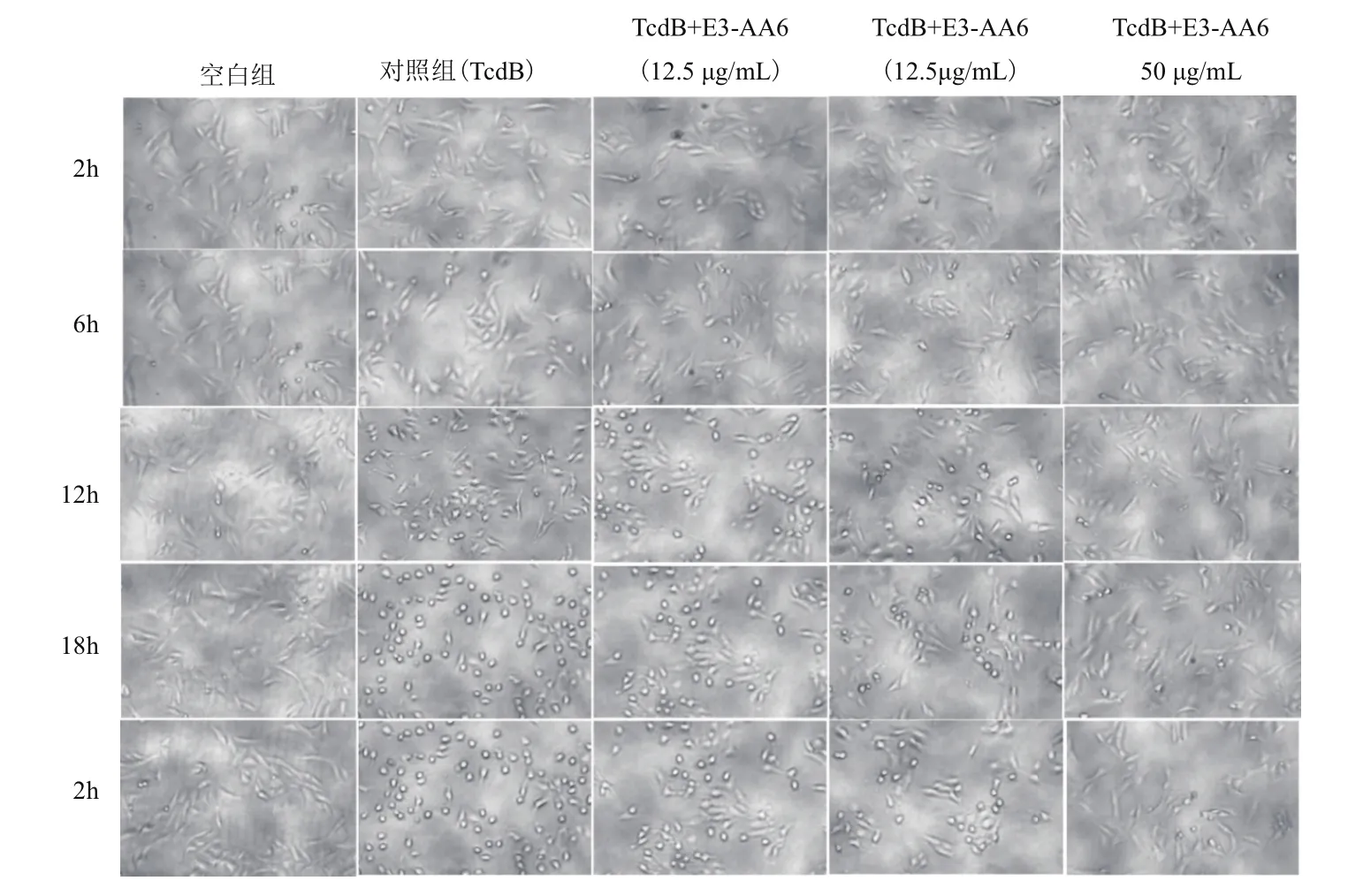
图4 不同浓度E3-AA6对毒素TcdB 的抑制作用
纳米抗体因其分子量小、高特异性等特性,在治疗艰难梭菌感染方面有着天然优势[17]。本实验室获得了从驼羊血清中分离的抗艰难梭菌毒素的基因E3和AA6,蛋白分子量分别为15 kD左右,通过Linker连接,设计成双特异性纳米抗体,通过乳酸乳球菌表达系统,获得了32 kD的纯化蛋白。在细胞毒素实验中,施加0.0125 ng/mL TcdB,Vero细胞24 h的变圆率为70%,施加50 μg/mL二价纳米抗体E3-AA6,细胞变圆率明显降低,通过CCK8试剂盒测定细胞活性,抑制率达到39%。证明二价纳米抗体E3-AA6对艰难梭菌TcdB有一定的中和作用。结合乳酸乳球菌可通过胃进入到肠道,直接作用于艰难梭菌,为今后的体内实验提供实验依据。
4 结论
本研究成功构建了抗艰难梭菌毒素的重组表达载体pNZ8148- E3-AA6,通过NICE系统实现了二价纳米抗体E3-AA6稳定表达;在对Vero细胞变圆实验及CCK8实验中,E3-AA6能够有效的中和艰难梭菌毒素TcdB。

