冬凌草毛状根的优化培养及其提取物的肿瘤细胞增殖抑制活性检测
陈婉琪 张鸿 王进峰 陈俊杰 林晓文 罗结华 许源陈艳芳 陆幸妍
(1. 广东药科大学生命科学与生物制药学院,广州 510006;2. 广东省生物技术候选药物研究重点实验室,广州 510006;3. 广东省药物新剂型重点实验室,广州 510006)
冬凌草,学名碎米桠[Rabdosia rubescens(Hemsl.)Hara.],唇形科香茶菜属,具清热解毒、消炎止痛、抗肿瘤等功效[1]。从冬凌草提取出的冬凌草甲素是贝壳杉烯二萜类有机化合物,已证实对多种肿瘤细胞有杀伤功效[2-3],且无明显毒副作用,目前已用于临床抗肿瘤研究[4]。
毛状根培养技术是20世纪80年代后期发展起来的植物组织培养新技术,是将发根农杆菌(Agrobacterium rhizogenes)的Ri质粒中T-DNA区(即转移区)整合到植物细胞DNA组上,诱导出毛状根并建立毛状根培养系统[5]。植物毛状根培养技术能有效改善植株生长缓慢、有效成分积累不足,以及某些植物在分化程度低时因缺乏阶段调控而无法合成某些药用次生代谢产物的局限性[5],且不依赖外源植物激素、合成次生代谢产物能力较强且稳定性好,尤其适用于发酵罐培养,故被认为是较好的获得植物次生代谢产物的规模化生成原材料[6],可作为保障与提升重要药用植物品质,应对中药野生资源短缺及品质严重退化的有效途径[7]。
本文报道冬凌草毛状根的诱导培养及其提取物的抗肿瘤活性检测,以期为利用毛状根规模化生产冬凌草甲素药物打下基础。
1 材料与方法
1.1 材料
1.1.1 冬凌草植株 济源冬凌草,采自河南省济源市王屋山,经广东药科大学中药学院中药学马鸿雁副教授鉴定为真品,本实验室无菌苗保种。
1.1.2 发根农杆菌菌株 发根农杆菌ATCC11325(广东省微生物菌种保藏中心 编号:GMI1. 141)、发根农杆菌ATCC15834,由华南师范大学生命科学学院施和平教授惠赠,本实验室保种。
1.1.3 癌细胞株 人肝癌细胞株BEL-7402、人肺癌细胞株A-549、人胃癌细胞株SGC-7901、人胃癌细胞株HGC均来自广东药科大学生命科学与生物制药学院实验室。
1.1.4 主要试剂及仪器设备 Aladdin冬凌草甲素分析标准品(上海融禾医药科技有限公司 批号:H1616026 纯度≥98%)、总DNA提取试剂盒(Magen公司)、1640 培养基(Gibco)、DMEM 培养基(Gibco)、DMSO(Gibco,纯度≥99%)、CCK-8试剂盒(南京建成生物工程研究所)、全自动酶标仪(Thermo Multiskan MK3,赛默飞世尔科技公司)、高效液相色谱仪(Dionex UltiMate 3000,戴安中国有限公司)、液相色谱柱(Kromasil 100-5-C18,4.6 mm×250 mm,5 μm)、甲醇(Labscience 纯度:色谱纯)等。
1.2 方法
1.2.1 冬凌草毛状根的诱导及扩增培养 将活化后的发根农杆菌按1%接种量接种到含YEB培养基中,摇床培养30 h,菌液用于侵染。
取冬凌草无菌苗合适部位切成约1.0 cm2的外植体,置于预培养基(MS+0.2 mg/L NAA)中暗培养24 h后取出,放入MS液体培养基稀释5倍的发根农杆菌菌液中分别浸泡10、20、30 min,取出吸干外植体表面多余的菌液,放回原预培养基中黑暗共培养。2 d后将外植体转入含400 mg/L头孢菌素的除菌生根培养基中暗培养[8-9]。发根后将外植体上生长至2-3 cm的毛状根与外植体分离,除菌培养后将其接种至无抗生素液体培养基中扩增培养。
1.2.2 毛状根的PCR检测 分别称取适量冬凌草植株根系与新鲜的冬凌草不定根,提取样品DNA。
rol B与rol C基因引物及其序列见表1[10]。PCR反应总体积为20 μL,扩增参数为:94℃预变性5min,94℃变性5 min,53.5℃退火复性5 min执行37 循环,72℃延伸 45 s,72℃使延伸充分 10 min,4℃急冷。扩增后的PCR产物用2%的琼脂糖凝胶电泳,用gel red染色进行分析。

表1 rol B与rol C基因引物及其序列
1.2.3 毛状根的生长曲线绘制 参考《植物细胞工程》[11],分别配制4种基本培养基:N6、B5、MS、1/2MS,121℃灭菌25 min,冷却到室温备用。
按0.5 g/100 mL接种量将长势良好的毛状根接种于蔗糖浓度为3%的B5培养基中,80 r/min,25℃暗培养,每隔10 d取样一次,每次随机取样三瓶,将毛状根清洗后置于55℃烘箱中烘干至恒重,测其干重,以每升培养液中毛状根的干重绘制其生长曲线。
1.2.4 毛状根的提取物制备及冬凌草甲素测定 精密称取粉碎过60目筛的干粉10 g,加入12倍体积的95%乙醇超声波提取3次,每次30 min,将提取液合并减压旋蒸至乙醇挥干,得毛状根粗提物。
以预处理后的大孔吸附树脂湿法装柱(柱长:10 cm,内径:1.5 cm)。取毛状根粗提物适量加甲醇溶解后,加少量大孔吸附树脂拌匀,挥干溶剂,以1/6量于树脂干法上样,先水洗至无色,再用60%乙醇为洗脱剂,按15倍树脂体积洗脱,蒸干流动相,得毛状根提取物。
取毛状根粗提物适量,加5 mL甲醇超声溶解,过滤除菌,制成上样液。
冬凌草甲素对照品溶液按中华人民共和国药典(2010版)[14]制备。采用C-18反向硅胶柱(C185 μm,250 mm×4.6 mm),流动相甲醇-水为55:45(V/V),进样量20 μL,1 mL/min恒速洗脱,检测波长为239 nm。
分别取冬凌草甲素标准贮备液适量,用甲醇稀释,制成质量浓度分别为50.8 μg/mL,60.96 μg/mL,121.92 μg/mL,203.2 μg/mL,508 μg/mL,812.8 μg/mL,1016 μg/mL的系列溶液;所得数据以冬凌草甲素的峰面积(A/AU)对浓度(C/μg)其进行线性回归,得回归方程为A=0.468C-0.398 4,(r=0.999 7)。结果表明,冬凌草甲素含量在50.8 μg/mL-1 016 μg/mL范围内线性关系良好。
1.2.5 CCK-8法检测毛状根提取物对体外培养肿瘤细胞的增殖抑制 取冬凌草毛状根提取物,加入DMSO超声溶解后加入培养基调整提取物终浓度为0.5 mg/mL和1 mg/mL,且DMSO终浓度为0.4%,过滤除菌得试液。
分别取对数生长期的四种癌细胞株,按1×105个/mL的细胞浓度,接种至96孔培养板中,每孔100 μL,置CO2孵箱中,37℃培养24 h,细胞贴壁后弃去培养上清液,加入上述毛状根提取物试液,每孔100 μL,6个复孔,同时设培养基空白对照孔,继续培养40 h;后弃去含药培养基,加入按10倍(V:V)稀释的CCK-8检测液,每孔110 μL,37℃孵育2 h后,测定各孔在450 nm处的吸光度值,按下列公式计算细胞抑制率。

1.2.6 统计学分析 应用SPSS及OriginPro 8对实验数据进行整理分析,多组比较采用单因素方差分析,结果以x-±SD表示,以P<0.05为差异有统计学意义。
2 结果
2.1 冬凌草毛状根的诱导扩增
发根农杆菌ATCC11325和ATCC15834分别以10、20、30 min侵染冬凌草叶片、茎部和叶柄。其中ATCC11325侵染的外植体均未能诱导生根,而ATCC15834侵染外植体组,诱导培养5 d,于外植体叶柄和部分茎部切口处萌出白色带绒毛的毛状根(图1-A)。待毛状根长至2-3 cm,将其切离外植体进行除菌培养(如图1-B),每周转接1次,3-4次后即可完全除菌。当毛状根长出明显分叉,将其转移至液体培养基中(图1-C)。不定根呈白色、多纤毛,在无激素培养基上非向地性生长,经多次传代,仍生长快速(图1-D)。

图1 发根农杆菌ATCC15834诱导冬凌草毛状根
2.2 毛状根的PCR检测
电泳结果(图2)显示,冬凌草毛状根总DNA的PCR产物中含有与ATCC15834的PCR产物中相同大小的条带,而从冬凌草非转化根的总DNA中扩增不到该条带。

图2 冬凌草毛状根rol B和rol C基因的PCR扩增产物的凝胶电泳图
2.3 培养基组成及培养时间对冬凌草毛状根生长速率的影响
冬凌草毛状根在不同的基本培养基中增殖倍数分别是 B5>1/2 MS>MS>N6,其中 B5 中毛状根鲜重达到最大值(表2),N6中毛状根基本不生长且褐化;B5、1/2 MS和MS中根的形态基本一致(图3)。
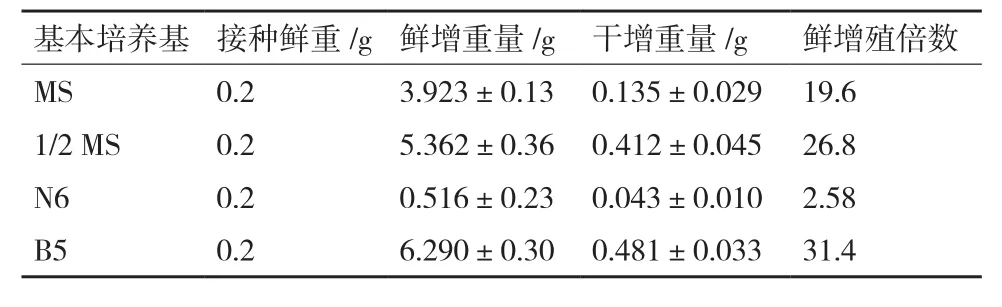
表2 四种不同培养基对毛状根的增殖倍数的影响

图3 不同培养基液体培养的毛状根
使用含3%蔗糖的B5培养基作为冬凌草毛状根的扩增及冬凌草甲素合成的最适培养基对毛状根进行培养,由图4可见,毛状根呈现“S”型增长,对数生长中期约为25 d,约70 d进入平台期。

图4 冬凌草毛状根生长曲线
2.4 毛状根中冬凌草甲素的测定
用HPLC法测定提取物中冬凌草甲素含量,结果显示:与冬凌草甲素标准品(图5-A)对比,毛状根超声粗提物(图5-B)及大孔树脂纯化提取物(图5-C)中均含有与冬凌草甲素标准品保留时间一致的成分,其含量分别约为0.017 1% 和 0.002 2%。

图5 冬凌草甲素含量测定的HPLC图
2.5 冬凌草毛状根提取物抗肿瘤活性检测
表3为不同浓度DMSO下人肝癌细胞BEL-7402的生长抑制率。与空白对照组相比,当DMSO≤0.4%,抑制率无显著性差异。
表4为不同含量的毛状根提取物对4种肿瘤细胞BEL-7402、A-549、SGC-7901、HGC的增殖抑制率。结果显示,与阴性对照组(DMSO 0.4%)相比,毛状根提取物浓度高于1 mg/mL时,对四种肿瘤细胞的抑制率达95%以上。
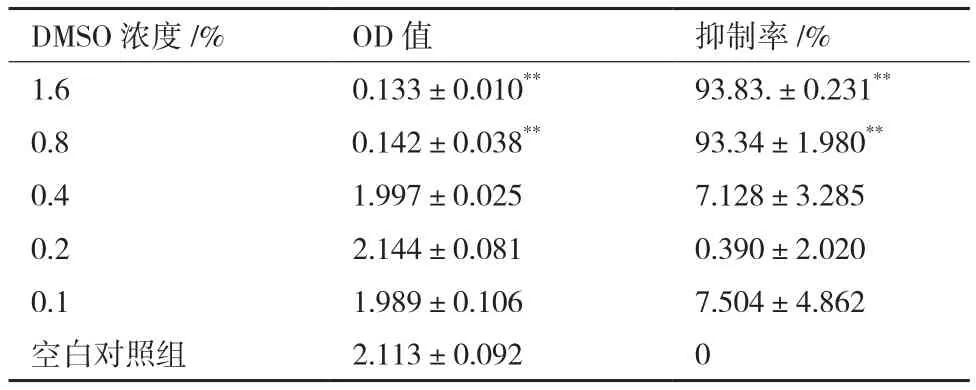
表3 不同浓度DMSO对人肝癌细胞BEL-7402生长的影响

表4 毛状根提取物对人肝癌细胞BEL-7402、人肺癌细胞株A-549、人胃癌细胞株SGC-7901和人胃癌细胞株HGC的抑制率
3 讨论
毛状根的诱导状况与发根农杆菌的种类、菌液浓度、外植体来源及大小诱导部位的选择、诱导条件等有关[15-16]。发根农杆菌对外植体的发根诱导有一定的选择性,不同发根农杆菌的致病力不同[17]。本实验用发根农杆菌ATCC11325和ATCC15834分别诱导冬凌草毛状根,结果发现,ATCC11325侵染不同部位的外植体均无法成功诱导冬凌草毛状根。推测原因为不同发根农杆菌的致根能力有一定特异性,与其所携带Ri质粒类型[18]和受体植物的种类有关[19]。此外,也不排除由于ATCC11325比ATCC15834对冬凌草外植体细胞的损伤更大导致其无法增殖和诱根。用ATCC15834感染外植体并暗培养5 d左右,大部分不定根均从叶柄及茎部的切口处萌发,而叶片表面未发现不定根,这可能是植株中处于形态学下端的部位一般生长素含量较高,故叶柄及茎部的毛状根萌发率较叶片高,且适量生长素可使诱导毛状根生成的ro1 B、ro1 C基因的表达增强[20];也可能是不同部位的外植体分化能力不同,一般分化能力强的外植体由于处于转化的敏感期,其诱导分化能力较高[21]。
影响毛状根增殖速度的因素有很多,不同植物种类有不同的最适培养基,在由不同组成成分的液体培养基中毛状根增殖的速度存有一定的差异,其他培养条件对毛状根生长及其次生代谢物质的积累也有很大的影响[22-23]。本实验中将冬凌草毛状根接种到4种液体培养基中培养,实验结果表明毛状根在B5培养基中增殖倍数最高,培养45 d后增殖倍数为31.4倍,其次是1/2 MS和MS培养基,N6最差,几乎没有增殖。本研究通过考察不同因素对冬凌草毛状根的诱导、生长及其中冬凌草甲素生物合成的影响,确定含3%蔗糖的B5培养基为冬凌草毛状根的扩增及冬凌草甲素合成的最适培养基。
本实验测定了毛状根生长曲线呈现“S”型,1-10 d新接种的毛状根适应培养环境,为毛状根的生长迟缓期;10-45 d毛状根快速生长,其中25 d 左右为对数中期,期间冬凌草毛状根生长迅速,培养基变为澄清的黄色液体,推测可能合成一些分泌类物质;55 d 后毛状根生长变缓,且部分褐化,培养基色泽渐浓,可能是营养成分不足和生长空间挤压所致;70 d 后进入平台期,该期的毛状根鲜重少量增加,干重基本稳定,培养基颜色变浓,呈褐色。因此,处在对数期的冬凌草毛状根生长速度快,故可以选择25 d左右进行毛状根的继代培养。
发根农杆菌侵染植物伤口后将其Ri质粒的T-DNA区DNA片段插入整合至植物细胞基因组,促使植物伤口处产生不定根,其中可表达部分的植物基因,如多糖类物质及次生代谢产物等,其中不乏抗癌有效成分。采用高效液相色谱法测定冬凌草甲素含量,结果显示,与冬凌草甲素标准品对比,毛状根超声粗提取物及毛状根大孔树脂纯化提取物中均含有与冬凌草甲素标准品保留时间一致的成分。DMSO作为助溶剂广泛用于药物干预性实验。据文献报道,当DMSO含量低于1%,对人肝癌、食管癌、宫颈癌及神经母细胞瘤细胞生长与繁殖均无影响[24]。本研究结果显示,当DMSO≤0.4%,对肿瘤细胞不显示非特异性毒性,与文献报道基本相符。此外,当毛状根提取物浓度为1 mg/mL时,对4种癌细胞株的生长抑制率达95%以上。基于HPLC法检测出毛状根提取物中含有冬凌草甲素,而冬凌草甲素为冬凌草抗肿瘤药用组分已被证实[2-3],故初步推断,冬凌草毛状根提取物抗肿瘤活性关键成分为冬凌草甲素。
4 结论
本研究首次成功诱导了冬凌草毛状根,证实了该毛状根中含有冬凌草甲素,且该毛状根提取物具有抑制肿瘤细胞增殖活性,为后续开展冬凌草毛状根冬凌草甲素应用研究及冬凌草遗传性状的改造奠定技术基础。

