糖氧剥离对海马神经元Furin、BDNF表达水平的影响
陈燕 张兆辉 张琦 王翠芳
Furin在神经系统有丰富的表达并参与脑源性神经营养因子(BDNF)、血管生长因子(VEGF)的成熟过程[1]。在BDNF的成熟过程中Furin的切割在调控形成具有生物活性的BDNF过程中起关键作用[2]。并且我们的前期研究发现Furin在急性缺血缺氧病理过程中介导了星形细胞BDNF细胞内的分泌成熟过程[3]。BDNF广泛分布于中枢神经系统,在大脑皮层、海马等部位含量较丰富,对神经元的存活、分化、生长发育起着重要作用。研究已经发现在很多病理状态下神经元分泌的BDNF的表达水平发生变化。本实验进一步观察在海马神经元糖氧剥离后不同时间点Furin、BDNF的表达水平变化以明确Fuirn是否介导的BDNF的表达水平变化过程。
1 材料与方法
1.1 材料 新生SD大鼠1~2 d龄,由武汉大学实验动物中心提供。Furin、BDNF抗体及GFAP抗体(abcam),多聚赖氨酸(sigma),Neurobasal 培养基、B27及D-Hank,s液(Gibco公司)。
1.2 原代神经元培养 将新生24~48 h的SD乳鼠浸入75%冰浴乙醇消毒,取出全脑,在解剖显微镜下在小脑端轻轻拨开大脑皮层露出新月形海马,去软脑膜、血管网后将海马组织剪成小组织块,静止2 min后去上清,然后加入0.125%胰蛋白酶消化5 min,胎牛血清终止消化,细胞筛过滤,收集细胞悬液;离心后加种植培养基(90% DMEM-F12+10%FBS)重悬,细胞计数,接种于培养皿;24 h后将种植培养基全量换成维持培养基(97% Neruobasal 1%B27+1% l-谷氨酰胺),以后每3d维持培养基半量换液。
1.3 OGD模型建立 神经元培养到第7 d,去培养基加不含血清的无糖DMEM,将细胞培养板移入潮湿密闭容器,持续泵入95%N2和5%CO2混合气体,37恒温处理3 h,低氧诱导后的海马神经元在再灌注0,12,24、48、72 h五个时间点收集细胞总蛋白。
1.4 蛋白免疫印迹检测Furin、BDNF蛋白表达水平 以再灌注0 h为对照组,将已收集的低氧诱导后的海马神经元总蛋白进行蛋白定量(BAC assay,按试剂盒说明操作),用12%SDS-PAGE分离目的蛋白Furin、BDNF,以管家蛋白GAPDH校正上样量;将需检测蛋白标本上样,电泳,转膜,封闭,孵抗体。其中各抗体稀释度依次为抗Furin抗体,抗 BDNF多克隆抗体(1∶1 000),二抗(1∶3 000),内参GAPDH(1∶5 000);ECL发光试剂发光、显影、定影,Bio-Rad凝胶成像系统采集图像;检测重复3次。
1.5 统计学处理
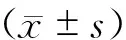
2 结 果
以氧糖剥离再灌注0 h为基数1,对不同再灌注时间点BDNF、Furin总蛋白的灰度值比值进行标准化比较。从图1中可见BDFN的表达水平随着再灌注时间的延长而逐渐下降。在最初12 h的再灌注时间内BNDF的表达水平下降约30%,再灌注24 h下调约50%,48 h下调约70%,72 h下调约70%,与对照组比较有明显差异(12 h,P=0.04;24 h,P=0.04;48 h,P=0.003;72 h,P=0.001)。从图2中可见Furin的表达水平随着再灌注时间的延长而逐渐升高。在最初12 h的再灌注时间内Furin的表达水平上调约1.3倍,与对照组比较无明显差异(12 h,P=0.08),再灌注24 h上调约2.1倍,再灌注48 h上调约2.5倍,再灌注72 h上调约3.14倍,与对照组比较有明显差异(24 h,P=0.005;48 h,P=0.004;72 h,P=0.004)。
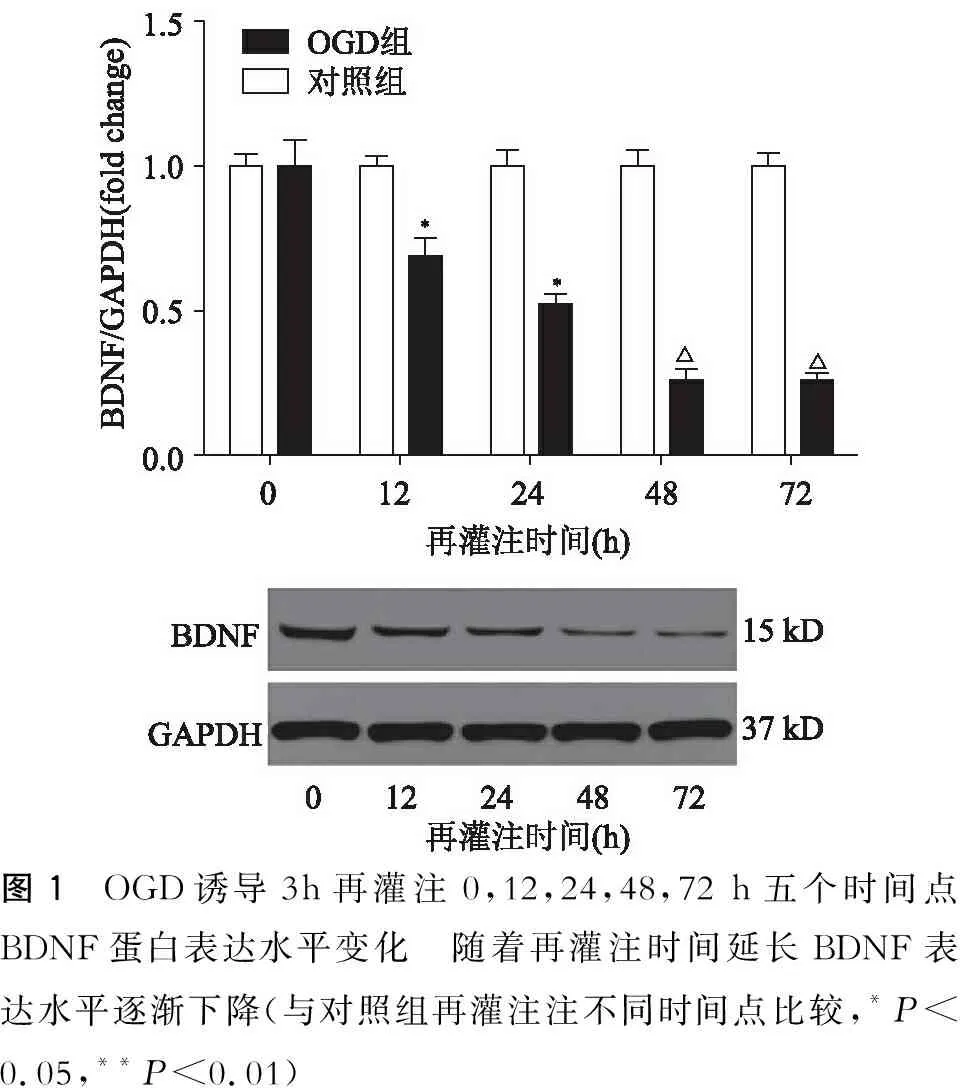
图1 OGD诱导3h再灌注0,12,24,48,72 h五个时间点BDNF蛋白表达水平变化 随着再灌注时间延长BDNF表达水平逐渐下降(与对照组再灌注注不同时间点比较,*P<0.05,**P<0.01)

图2 OGD诱导3 h再灌注0,12,24,48,72 h五个时间点Furin蛋白的表达水平变化 随着再灌注时间延长Furin表达逐渐上调(再灌注12h与对照组比较无明显差异,P>0.05;再灌注24,48,72 h与对照组比较有明显差异,P<0.01)
3 讨 论
Furin是原蛋白转化酶家族成员之一,其切割底物广泛。研究表明Furin是BDNF细胞内分泌通路上的关键性切割酶。BDNF前体蛋白经Fuirn的切割后形成具有生物活性成熟的BDNF。并且研究表明神经营养因子蛋白前体与成熟的神经因子具有绝然相反的生物学效应,即蛋白前体诱导神经元死亡,而成熟的神经营养因子促进神经元生存,参与突触可塑性调节。由此可见Furin在决定神经营养因子生物效应中起关键性作用。来源于癌细胞的研究结果表明Furin在低氧条件下表达水平上调。
BDNF最初以pro-BDNF的形态在内质网内合成,pro-BDNF在细胞内通过Furin切割后形成成熟的mBDNF,在病理状态下BDNF的表达水平发生变化,即在癫痫模型中发现BDNF表达水平上调,并且发现原蛋白转化酶PC1介导了BDNF的表达水平上调过程[4];在神经退行性疾病中如AD患者中皮质和海马分泌的BDNF表达水平下调,BDNFmRNA表达水平下调[5];在精神心理性疾病如抑郁海马分泌的BDNF的表达水平也是下调[6]。在各种病理状态下BDNF表达水平变化的细胞内机制不同,并且大多数情况下其具体的细胞内分泌通路调控并不十分清楚。另外,在不同的细胞类型中BDNF的细胞内调节通路可能也不一样。
对缺血缺氧这一病理状态下我们的前期研究发现Furin介导了OGD诱导激活的星形细胞的BDNF表达水平的上调过程,这一过程可能参与急性脑缺血时星形细胞的内源性神经保护机制[3]。为进一步明确在缺血缺氧的神经元内是否同样Furin也参与的BDNF的表达水平变化过程。本研究利用OGD诱导模型模拟急性脑缺血时海马神经元观察其细胞内BDNF的表达水平变化。在OGD诱导再灌注后海马神经元BDNF的表达水平随再灌注时间延长呈逐渐下调而Furin的表达呈逐渐上调。从初步研究结果分析Furin没有参与OGD时海马神经元内BDNF的表达水平变化过程。其原因可能在于原蛋白酶家族其他成员参与了这一条调控过程。原蛋白转化酶家族成员共有7个,分别为Furin,PACE4,PC5/6,PC1/PC3,PC4,PACE4,LPC/PC7,其切割底物存在交叉。另外,研究发现在坐骨神经损伤时PC1,PC5,Furin和PC7均参与雪旺氏细胞的BDNF表达水平上调过程[7]。在后续的研究中我们将进一步研究海马神经元内的BDNF的细胞内分泌过程的酶切调节机制。

