金属硫蛋白2对脂多糖诱导急性肝损伤的保护作用及可能机制*
曾江华,刘海荣,蒋仕秋,范加维,刘 信,戴小珍,刘月明△
1.成都医学院第一附属医院 烧伤整形科(成都610500);2.成都医学院第一附属医院 科研中心(成都 610500); 3.成都医学院 基础医学院(成都 610500)
重症烧伤、创伤常常伴随感染和炎症反应,肝脏是炎症反应的重要靶器官,在疾病的发生发展过程中起着关键作用。其中,肝脏内各种炎症指标的增多及各种异常活化的炎性细胞介导的过度炎症反应是致病关键[1]。单核巨噬细胞是联系其他免疫细胞引起炎症反应发生、发展的主要效应细胞,一方面在清除病原微生物、抗原提呈、调节免疫、促进组织修复等方面具有明显作用[2],另一方面单核巨噬细胞过度活化则是介导炎症损伤、氧化应激的重要原因[3]。维持单核巨噬细胞的正常功能是临床炎症性疾病的一个重要研究方向。
金属硫蛋白(MT)是一类分子量较小(约6~7 kDa),富含半胱氨酸为特征的细胞内应激蛋白,普遍存在于生物界,具有高度可诱导特性。哺乳动物MT主要有MT1、MT2、MT3、MT4共4种亚型。其主要亚型MT2在各种组织中均有表达,以肝、肾含量最丰富,是目前研究MT的主要形式。研究[4-6]已经表明,MT2在调节体内微量元素代谢、重金属解毒、清除自由基、调节细胞增殖凋亡等方面具有明显作用。随着研究不断深入,发现MT2具有调节炎症反应,参与组织损伤的保护作用。Inoue等[7]认为MT2是一种抗炎介质。MT2调节炎症反应的具体机制尚不完全清楚,多认为与其抗氧化效应相关,LPS诱导的氧化损伤是单核巨噬细胞过度活化的重要因素,有理由认为MT2可能参与单核巨噬细胞的功能调节,从而对急性肝损伤产生保护效应。本研究采用脂多糖(lipopolysaccharides,LPS)诱导的MT2敲基因小鼠及与之对应的野生型小鼠急性肝损伤动物模型,观察两种基因型小鼠血清指标、病理组织改变、肝脏巨噬细胞迁移活化及炎症因子TNF-α、IL-6表达变化,探讨MT2对LPS诱导急性肝损伤的保护效应及可能机制。
1 材料与方法
1.1 动物与分组
选取6~8周龄健康雌性MT2敲基因C57/6小鼠及对应野生型小鼠各12只。小鼠购于上海南方模式生物科技股份有限公司,饲养于成都医学院科研中心动物房,体质量18~22g,SPF级,自由饮食,饲养环境:12 h人工白天黑夜循环,室内温度和湿度分别维持在(22±2)℃和(50±2)%。
1.2 仪器与试剂
谷草转氨酶(AST)、谷丙转氨酶(ALT)检测试剂盒(南京建成生物工程研究所),LPS(abcam 英国),MT2、丙二醛(MDA)、超氧化物歧化酶(SOD) ELISA试剂盒(上海酶联生物科技公司),肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6) ELISA试剂盒(贝赛维斯生物科技公司),总RNA提取试剂盒(北京索莱宝科技有限公司),iScriptTMcDNA Synthesis Kit、SsoAdvancedTMUniversal SYBR®Green Supermix(BIO-RAD 美国),Anti-F4/80 antibody(Cell Signaling Technology 美国),通用SP试剂盒、DAB kit(北京中杉金桥生物科技有限公司),酶标仪(Thermo 美国),石蜡切片机(CUT500德国),成像光学显微镜(Olympus 日本),PCR仪、荧光定量PCR仪(Bio-Rad 美国)。
1.3 方法
1.3.1 动物分组及造模 敲基因小鼠及野生型小鼠采用随机数字表法分成对照组和LPS组。每组含敲基因小鼠及野生型小鼠各6只。LPS组:按10 mg/kg体质量剂量给予敲基因小鼠及野生型小鼠腹腔注射LPS,于染毒后24 h处死小鼠。对照组:给予等体积的生理盐水。
1.3.2 标本采集及制备LPS 染毒后观察各组小鼠死亡率及生活状态,4%水合氯醛(0.15 mL/20 g)腹腔注射麻醉后心脏取血、提取肝脏组织待检。1)血清制备:心脏取血后,4 ℃冰箱静置30 min后,以3 000 r/min,离心半径6.5 cm,离心15 min得血清,采用ELISA法检测血清中MT2、TNF-α、IL-6、SOD、MDA的含量,微板法检测血清中AST、ALT的活性,所用试剂和方法按照说明书严格操作。2)总RNA提取:取部分肝脏组织液氮冷冻后反复研磨,加入适量裂解液裂解后,按照总RNA提取试剂盒说明书严格操作。3)组织标本制备:取小鼠肝脏左叶,10%中性甲醛固定,乙醇梯度脱水,石蜡包埋,3 μm切片,用于苏木素伊红染色及免疫组化。
1.3.3 实时荧光定量 PCR检测肝脏MT2、TNF-α、IL-6表达,根据美国Bio-Rad公司cDNA合成说明书完成cDNA第一链合成。以cDNA为模版扩增MT2、TNF-α、IL-6基因的基因编码片段,内参为GAPDH,引物信息如下(表1)。扩增条件为95 ℃预变性30 s,(95 ℃变性5 s、60 ℃退火、延伸30 s)×40个循环,65 ℃延伸5 s。同一样本设置3个复孔,内参照采用GAPDH。扩增完毕后进行融解曲线分析,融解曲线在产物Tm处表现为单峰,表明扩增特异性良好。因为目的基因与内参基因的扩增效率一致,其相对定量值使用比较Ct法进行计算,计算公式为2-△△Ct。

表1 引物序列
1.3.4 免疫组织化学染色将切片 脱蜡、复水,3%H2O2封闭内源性过氧化物酶,10%山羊血清封闭非特异性吸附位点,随后滴加1∶250兔抗鼠F4/80一抗4 ℃过夜,次日依次滴加1∶300山羊抗兔IgG工作液和1∶300辣根酶标记链霉卵白素工作液,37 ℃孵育30 min;DAB显色,复染,镜检,照相。
1.4 细胞计数及图片处理
在10×20倍显微镜下,每只老鼠选取3个横切面,各5个视野。用LAS V4.5图像采集系统拍照,ImageJ软件计数每张图片中F4/80+巨噬细胞的数量及F4/80蛋白免疫阳性面积百分比。
1.5 统计学方法
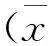
2 结果
2.1 LPS对两种基因型小鼠大体行为的影响
与对照组相比,LPS组两种基因型小鼠均出现倦怠、厌食、行动能力下降,并随着给药时间延长呈加重趋势。未见两种基因型小鼠在上述行为间存在差异。
2.2 LPS对两种基因型小鼠体内MT2含量的影响
实时定量PCR及ELISA分别检测两种基因型小鼠肝脏及血清中MT2表达情况。结果如下所示,对照组野生型小鼠血清中MT2的含量明显高于敲基因小鼠,差异有统计学意义(P<0.001)。注射LPS后野生型小鼠血清中MT2的含量明显增加(P<0.001),对敲基因小鼠MT2无影响。通过荧光定量PCR检测肝脏组织中MT2的表达,结果显示,与上述结果一致,表明本动物模型构建成功(图1)。

图1两种基因型小鼠血清及肝脏中MT2含量
注:A:两种基因型小鼠LPS染毒前后血清中MT2含量;B:两种基因小鼠LPS染毒前后肝脏中MT2mRNA表达水平。与对照组比较,###P<0.001;相同处理后,与敲基因型小鼠比较,*P<0.05、***P<0.001
2.3 LPS对两种基因小鼠血清ALT、AST活力的影响
对照组中敲基因小鼠和野生型小鼠血清酶ALT、AST活性基本相近。LPS染毒后,两种小鼠血清酶活性均明显升高,与对照组相比,差异有统计学意义(P<0.001),其中敲基因小鼠较野生型小鼠增加更明显,差异有统计学意义(P<0.05)。由此表明,MT2对LPS诱导的肝细胞损伤具有明显保护效应(表2)。

表2 两种基因型小鼠血清中转氨酶活性(U/L,±s)
注:与对照组比较,###P<0.001;相同处理后,与敲基因型小鼠比较,*P<0.05
2.4 LPS对两种基因型小鼠血清MDA、SOD的影响
注射LPS之前两种基因型小鼠血清中MDA、SOD含量相近,注射LPS后两种基因型小鼠血清中MDA含量明显升高,SOD活性降低,差异有统计学意义(P<0.001);与野生型小鼠相比,敲基因小鼠血清中MDA增加更明显(P<0.001),而SOD降低更明显(P<0.05)。表明 LPS诱导的急性肝损伤中,MT2改善了小鼠体内氧化应激状态(表3)。

表3 两种基因型小鼠血清中MDA、SOD活性±s)
注:与对照组比较,###P<0.001;相同处理后,与敲基因型小鼠比较,*P<0.05、***P<0.001
2.5 LPS对两种基因型小鼠血清及肝组织中IL-6、TNF-α表达的影响
对照组中两种基因型小鼠血清中IL-6、TNF-α含量接近。注射LPS后,两种基因型小鼠血清IL-6、TNF-α含量明显升高(P<0.001),其中敲基因小鼠较野生型小鼠增加更明显(P<0.05)。实时荧光定量PCR检测肝组织中IL-6、TNF-αmRNA表达水平,结果与上述结果一致。表明MT2对炎性细胞因子分泌具有调控作用(图2)。

图2 两种基因型小鼠血清及肝脏中炎性细胞因子水平
注:A:两种基因型小鼠LPS染毒前后血清IL-6含量;B:两种基因型小鼠LPS染毒前后血清中TNF-α含量;C:两种基因型小鼠LPS染毒前后肝脏中IL-6 mRNA表达水平;D:两种基因型小鼠LPS染毒前后肝脏中TNF-α mRNA表达水平。与对照组相比较,###P<0.001;相同处理后,与敲基因型小鼠比较,*P<0.05、**P<0.01
2.6 LPS对两种基因型小鼠肝脏组织学的影响
对照组中敲基因小鼠与野生型小鼠肝脏结构清晰,肝索排列整齐,肝细胞形态规整,以中央静脉为中心呈辐射状,肝小叶结构完整。注射LPS后,与野生型小鼠相比,敲基因小鼠肝细胞出现明显空泡变性,肝细胞坏死,中央静脉血栓,肝窦、汇管区及肝静脉周围明显炎症细胞浸润(图3)。
2.7 LPS对两种基因型小鼠肝脏F4/80+巨噬细胞数量及F4/80蛋白表达的影响
对照组中两种基因型小鼠肝脏中仅有少量F4/80+巨噬细胞分布,F4/80蛋白表达较低,注射LPS后两种基因型小鼠肝脏中F4/80+巨噬细胞数量及F4/80蛋白表达明显增加(图4A)。分析两种基因型小鼠F4/80+巨噬细胞数量及F4/80蛋白免疫阳性面积百分比发现,对照组中两种基因型小鼠差异无统计学意义(P>0.05),LPS组中敲基因型小鼠增加较野生型小鼠增加更明显(P<0.01或P<0.001)(图4B~4C)。表明MT2对单核巨噬细胞的迁移具有明显调控作用。

图3 肝脏HE染色情况
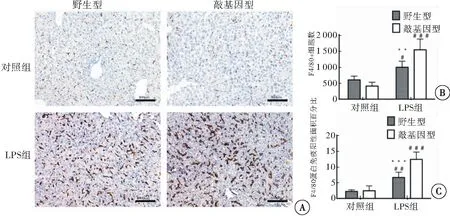
图4 肝脏F4/80+巨噬细胞免疫组化染色结果
注:A:两种基因型小鼠LPS染毒前后肝脏F4/80+巨噬细胞免疫组化染色;B:ImageJ软件计数两种基因型小鼠肝脏F4/80+巨噬细胞数量统计分析结果;C:ImageJ软件计数两种基因型小鼠肝脏F4/80蛋白免疫阳性面积百分比统计分析结果。与对照组比较,#P<0.05、##P<0.01、###P<0.001;相同处理后,与敲基因小鼠比较,**P<0.01、***P<0.001
3 讨论
重症烧伤、创伤常常导致脓毒症,诱发机体产生严重的炎症反应,LPS在炎症反应中起重要作用,也是急性肝损伤的主要诱因,致肝损伤的机理主要通过诱导过度炎症因子引起肝细胞的凋亡及坏死[8-9]。活化的巨噬细胞是炎症因子的主要来源,在急性肝损伤中扮演重要角色。如过度活化的巨噬细胞产生的TNF-α在LPS介导的急性肝损伤中的作用远大于LPS的直接损伤。其次,巨噬细胞还通过分泌趋化因子招募大量的中性粒细胞,后者释放ROS和蛋白酶,间接导致肝细胞坏死[10]。肝脏是全身最大的固有巨噬细胞群,其固有巨噬细胞约占体内总巨噬细胞的80%~90%[11]。巨噬细胞在各种病因引起的肝损伤中均起关键作用,如药物性肝损伤[12]、酒精性肝病[13]、非酒精型脂肪肝[14]、病毒性肝炎[15]等。基于此,本研究通过LPS诱导急性肝损伤动物模型证实MT2对急性肝损伤的保护效应,并联系巨噬细胞的迁移活化探究MT2对急性肝损伤保护效应的可能机制。
病理染色结果显示,经LPS染毒后两种基因型小鼠均出现不同程度的肝细胞坏死,中央静脉血栓,肝窦、汇管区及肝静脉周围明显炎症细胞浸润,表明动物模型构建成功。其中,MT2的缺失明显加重LPS引起肝细胞变性、坏死及炎症细胞浸润程度。血清转氨酶的活性是反应肝脏损伤程度的重要指标之一,并与损伤程度呈正相关[16-17],MDA是脂质过氧化的最终代谢产物,是反应机体氧化应激状态的常用生物标志物[18],SOD是内源性氧自由基清除剂,其含量高低可间接反应组织损伤的程度。本研究发现,MT2可明显降低肝损伤小鼠肝脏病理改变程度及血清中AST、ALT、MDA含量,明显升高血清中SOD活性。表明MT2做为细胞内一种强抗氧化剂,可明显增加机体抗氧化能力,改善机体氧化应激状况。F4/80是成熟巨噬细胞高度特异表面标记物,本研究采用F4/80标记巨噬细胞,通过观察两种基因型小鼠在LPS介导的急性肝损伤模型中巨噬细胞分布情况,结果显示,注射LPS后两种基因小鼠肝脏F4/80+巨噬细胞数目及F4/80蛋白表达明显增加,其中敲基因小鼠较野生型小鼠增加更明显。Wesselkamper等[19]在研究镍介导的急性肺损伤模型中也发现,MT2敲基因小鼠支气管肺泡灌洗液中巨噬细胞明显多于野生型小鼠。活化的巨噬细胞是炎症介质的主要来源,本研究通过对两种基因型小鼠血清及肝脏中促炎细胞因子IL-6、TNF-α的检测发现,LPS染毒后敲基因小鼠血清及肝脏中IL-6、TNF-α含量均明显高于野生型小鼠。说明MT2通过影响巨噬细胞的迁移活化,减少促炎细胞因子的产生,进而调节炎症反应,发挥其组织损伤保护效应。
综上所述,MT2做为细胞内一种强效抗氧化剂参与急性肝损伤的保护作用机制,除了增强内源性抗氧化剂活性外,还可能与调节巨噬细胞迁移活化影响炎症反应相关。这些结果有助于阐明MT2调节炎症的可能机制,但其调节巨噬细胞迁移活化的机制需待进一步研究。

