甜菜组织培养与植株再生体系的建立
伍国强,刘海龙,李智强
(兰州理工大学生命科学与工程学院,甘肃 兰州730050)
甜菜(Beta vulgaris L.)属藜科(Chenopodiaceae)二年生草本植物,是我国及世界的第二大糖料作物,其糖产量仅次于甘蔗,占世界总产糖量的30%左右[1-2]。甜菜全身是宝,制糖后产生的副产品甜菜粕仍含有糖分,且富含多种无机盐和含氮化合物,适口性好,具有较高的饲用价值[3];同时甜菜粕也是一种生产纤维素的优质资源,将其转化后进行乙醇的规模化生产,既能够实现资源的充分利用,也有利于甜菜产业的可持续发展[4-5]。
当前甜菜育种主要依赖其种属间的杂交[6]。在过去的数十年间,科研人员通过杂交育种手段使栽培甜菜的品质得到了大幅度提高[7]。然而,由于近年来甜菜优良种质资源日趋匮乏,使得传统育种方法在培育高产、抗逆性强的甜菜品种的难度逐渐增大[8]。利用基因工程技术提高作物品质或抗逆性,培育新品种是当前作物育种研究的热点之一。然而,无论利用农杆菌侵染法、基因枪法,还是显微注射法,都需要以植物的组织培养技术作为依托[9]。目前,研究人员已经以甜菜子叶、下胚轴、叶片和叶柄等作为外植体,通过直接或间接的器官发生途径和体细胞胚发生途径获得了再生植株[10-13];但植株再生过程中仍然存在愈伤组织分化率和生根率偏低等困难,导致基因遗传转化过程中的效率极低[14]。此外,已建立的甜菜再生体系中所用甜菜品种基因型复杂多变,大多体系不能在需要改良的甜菜品种上重复进行。因此,有必要对当地栽培的优良甜菜品种的组培诱导体系进行改良和优化。
Wu等采用隶属函数法建立了甜菜农学和生理学指标耐盐抗旱性的综合评价体系,并筛选出了适合于我国北方干旱、半干旱地区及盐渍化地区栽培的品种 “甘糖7号”[15-16]。该品种是以多粒二倍体雄性不育系MS2007-2A为母本,多粒二倍体授粉系P2007为父本,按3∶1比例配制杂交选育而成的,具有适应性广、抗逆性强等特点[17]。然而,目前还未有人对“甘糖7号”的组培体系进行系统研究。鉴于此,本研究以“甘糖7号”甜菜品种的叶柄为材料,对其愈伤组织诱导和植株再生条件进行研究,以期为糖料作物甜菜抗逆遗传改良及其基因工程育种提供参考。
1 材料与方法
1.1 种子处理及无菌苗的获得
挑取甜菜“甘糖7号”均匀饱满的种子(由甘肃武威市三农种业科技有限公司提供),加入浓硫酸浸泡2 h后,用自来水冲洗4~5次后晾干备用。将上述处理后的甜菜种子置于超净工作台中,用75%酒精消毒1~2 min,再用3%次氯酸钠消毒10 min,无菌水冲洗4~5次后接种于MS固体培养基(3%蔗糖、0.8%琼脂)上使其萌发,约30 d后获得甜菜无菌苗(图1 A),采集甜菜叶柄用于愈伤组织诱导。
1.2 愈伤组织的诱导
以MS+3%蔗糖+0.8%琼脂为基本培养基,分别添加(1)4 mg/L 6-BA+0.5 mg/L NAA;(2)5 mg/L 6-BA+0.5 mg/L NAA;(3)6 mg/L 6-BA+0.5 mg/L NAA;(4)7 mg/L 6-BA+0.5 mg/L NAA作为愈伤组织的诱导培养基。每个培养皿接20~30个外植体,每种培养基4个重复。20 d后观察统计愈伤组织诱导情况,并选择生长良好的愈伤组织进行继代培养,继代周期为15 d。愈伤组织诱导率=(形成愈伤组织外植体数/接种外植体数)×100%。
1.3 愈伤组织的分化
以MS+3%蔗糖+0.8%琼脂为基本培养基,分别添加(1)4 mg/L 6-BA+0.5 mg/L NAA;(2)5 mg/L 6-BA+0.5 mg/L NAA;(3)6 mg/L 6-BA+0.5 mg/L NAA;(4)7 mg/L 6-BA+0.5 mg/L NAA;(5)4 mg/L 6-BA+1 mg/L NAA;(6)5 mg/L 6-BA+1 mg/L NAA;(7)6 mg/L 6-BA+1 mg/L NAA ;(8)7 mg/L 6-BA+1 mg/L NAA 作为愈伤组织分化的培养基。选取直径约1 cm生长良好,且颜色为淡黄色,疏松易碎的愈伤组织接种于上述培养基上光照培养,每个培养皿(组培瓶)转接8个愈伤组织块,每种培养基4个重复。45 d后观察,统计不定芽分化情况;继代周期为20 d。不定芽分化率=(分化出不定芽愈伤组织块数/接种愈伤组织块数)×100%。
1.4 生根培养基的筛选
待愈伤组织分化出的不定芽生长至1~2 cm时,将不定芽从愈伤组织上切下分别转接至(1)MS+0.05 mg/L NAA;(2)MS+0.1 mg/L NAA;(3)1/2MS+0.05 mg/L NAA;(4)1/2MS+0.1 mg/L NAA进行生根培养。45 d后观察生根情况;继代周期为20 d。生根率=(生根的芽数/接种的芽数)×100%。
1.5 炼苗移栽
将根系发达、叶片展开的健壮再生幼苗在人工气候箱内打开瓶口,炼苗一周左右,再从培养瓶中取出再生苗,用无菌水冲洗附着在根表面的培养基,移栽至灭菌的蛭石中,置于培养室培养。
1.6 培养条件
人工气候箱温度恒定保持(24±2)℃,光周期为16 h/d。培养间昼夜温度为25℃/20℃,光周期为16 h/d,相对湿度70%~80%。
2 结果与分析
2.1 愈伤组织的诱导
将甜菜叶柄接种到愈伤组织诱导培养基上5~7 d,叶柄开始膨大,15~20 d后,叶柄切口处形成致密紧凑的绿色或黄绿色的愈伤组织 (图1 B)。从表1结果可以看出,所选取的愈伤组织诱导培养基均可以诱导出愈伤组织,其中在MS+4 mg/L 6-BA+0.5 mg/L NAA诱导率最高,达到88.2%。再经1~2次继代后,部分愈伤组织逐渐转变为疏松易碎的黄绿色愈伤组织,后期研究发现,疏松易碎的黄绿色愈伤组织的分化率较高,而紧凑致密的愈伤组织则无法分化出不定芽。此外,随着6-BA浓度的增大,愈伤组织诱导率逐渐下降,褐化外植体增多,说明过高浓度的6-BA会抑制愈伤组织的形成。因此,本研究将MS+4 mg/L 6-BA+0.5 mg/L NAA为诱导愈伤组织的最佳培养基。

图1 甜菜的组织培养和植株再生Fig.1 Tissue culture and plant regeneration of sugar beet
2.2 愈伤组织的分化
将诱导出的疏松易碎的黄绿色愈伤组织轻轻地转接至分化培养基上。经过3~5次继代培养之后,可以看见少量淡绿色的松散的愈伤组织中长出深绿色的小颗粒,部分愈伤组织上已经有芽长出(图1 C);继续培养一段时间,这些绿色小颗粒逐渐发育成不定芽,且周围有更多的不定芽分化出来(图1 D)。在此过程中,一些不定芽出现了玻璃化现象。究其原因可能是细胞分裂素6-BA浓度过大,使得细胞分裂的速度超过了干物质生产和积累的速度;也有可能是不定芽诱导过程中继代次数较多,愈伤组织或不定芽中积累了过量的激素,从而产生玻璃化苗。此外,有一些愈伤组织褐化后在其表面长出灰白色的松散细胞团,这类愈伤组织继续培养后依然不能分化,但含水量似乎并未减少。也有一些愈伤组织质地更加坚硬致密,多次继代后也无法分化出不定芽,而且愈伤组织变得极为干燥,坚硬。从表2可以看出,仅MS+4 mg/L 6-BA+0.5 mg/L NAA和MS+5 mg/L 6-BA+0.5 mg/L NAA上有不定芽生成,而在其他培养基上则没有芽长出。将细胞生长素NAA的浓度提高至1 mg/L时,所对应分化培养基上仍然没有不定芽生成。此外,MS+4 mg/L 6-BA+0.5 mg/L NAA上的分化率为9.4%,高于MS+5 mg/L 6-BA+0.5 mg/L NAA的3.1%。因此,本研究中将MS+4 mg/L 6-BA+0.5 mg/L NAA作为诱导芽分化的最佳培养基。
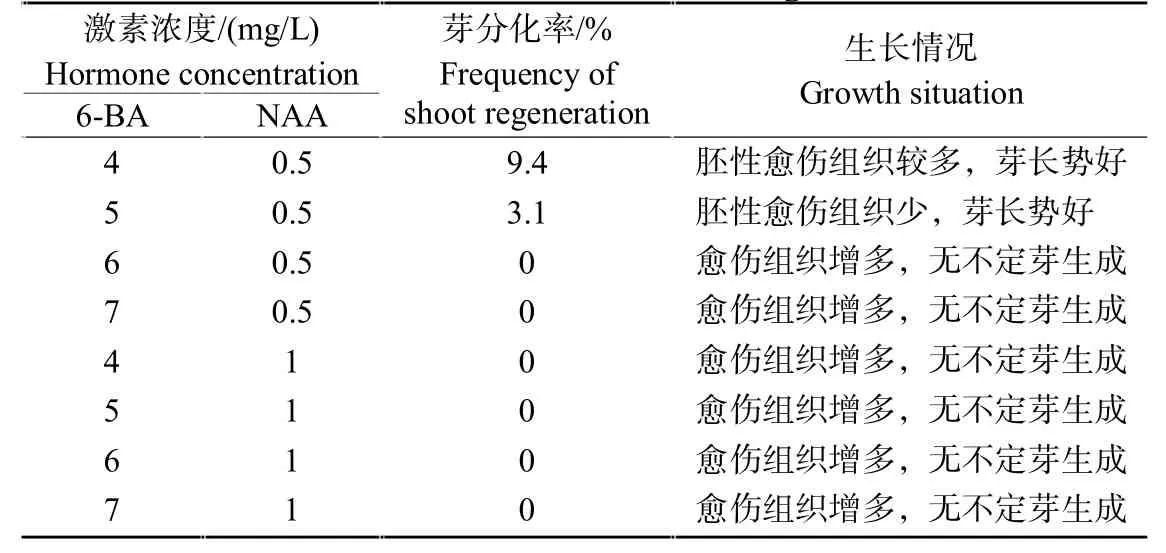
表2 不同浓度激素对甜菜愈伤组织分化的影响Table 2 Effects of different concentration of hormones on the callus differentiation of sugar beet
2.3 甜菜再生幼苗的生根培养与移栽
从基部切下长至1~2 cm的不定芽,接种到生根培养基中。2~3次继代后,幼根从无根苗基部长出,继续培养后,须根逐渐增多(图1 E,F)。从表3可以看出,在所设计生根培养基中,仅MS+0.1 mg/L NAA培养基上可以生根,生根率达到33.3%。
待主根木质化且有一定数量的须根长出之后,将组培瓶瓶盖敞开一小部分;1~2 d后,将瓶盖再开一部分,让再生苗逐渐适应自然环境。炼苗一周后,用无菌水将再生苗根部培养基冲洗干净,移入采用1/8 MS浸泡的灭菌蛭石中。为了保持一定温度和湿度,移栽再生苗的育苗盆使用保鲜膜进行多层覆盖。10~15 d的培养后,再生苗开始长出新的叶片,逐渐除去覆盖的保鲜膜。45 d后,再生植株正常生长(图1 G)。

表3 不同生根培养基对甜菜不定芽生根的影响Table 3 Effects of different rooting media on adventitious shoot rooting of sugar beet
3 讨论
利用植物组织培养技术通过体细胞胚途径或器官发生途径直接或间接获得再生植株是生物技术育种、原生质体培养、体细胞杂交及基因转化研究的基础[18]。本研究前期曾参考席德慧[19]和郝秀英[20]等在甜菜组培和植株再生过程中的激素浓度,以甜菜“甘糖七号”下胚轴、子叶、真叶和叶柄为外植体进行预实验,发现甜菜下胚轴在所设定的培养基上容易褐化,且材料来源有限;子叶虽然可以在培养基上形成愈伤组织,但形成的愈伤组织几乎全部是紧凑致密型的愈伤组织,无法继续分化出不定芽;真叶由于叶片较薄,在培养基上容易卷曲且伤口较小,形成愈伤组织的效果不佳。因此,本试验选取甜菜叶柄作为外植体,对其愈伤组织诱导和植株再生过程进行了研究。结果表明,叶柄在MS+4 mg/L 6-BA+0.5 mg/L NAA的培养基上可以快速且高效地诱导出愈伤组织。诱导出的愈伤组织有两种类型:一类是绿色致密且坚硬的愈伤组织,这类愈伤组织在继代过程中不易褐化,随着继代次数的增加质地更为坚硬,但始终无法分化出不定芽;而另一类为黄绿色的松软易碎的愈伤组织,在继代过程中容易受褐化影响,可以分化出大量芽点但整体分化率不高,可能是甜菜本身不定芽分化能力低造成的,这一结果也与Zhong等[11]和Kagami等[12]所得到的结果类似。
不定芽的分化是甜菜组织培养过程中的关键环节[21]。现有报道中诱导甜菜愈伤组织和不定芽的培养基在激素种类和浓度大小方面均存在差异,通常是在愈伤组织诱导培养基上获得大量愈伤组织,然后转接到分化培养基上诱导不定芽,在一定程度上增加了愈伤组织褐化的几率。但也有研究表明,一些植物中愈伤组织和不定芽的诱导可以在含相同激素组合的培养基完成[22-23]。如李莹等[22]以红甜菜嫩茎为外植体,在含1 mg/L BA的MS培养基上诱导愈伤组织并成功分化出不定芽;苏彩霞等[23]以3种番茄的下胚轴为材料,分别在含有6-BA和IAA的同一种MS培养基上诱导愈伤组织和不定芽,并最终获得了再生植株。本研究在前期获得大量愈伤组织后,参考郝秀英等[20]所报道的激素配比,在含0.5~3 mg/L 6-BA,0.5 mg/L的MS培养基上诱导不定芽。遗憾的是,愈伤组织在上述培养基中未能分化出不定芽。然而,在愈伤组织继代过程中发现,少量愈伤组织在愈伤组织诱导培养基上可以分化出不定芽。因此,在随后不定芽诱导过程中并未重新设计分化培养基,而是通过连续继代的方法获得了不定芽,不仅降低了愈伤组织褐化的概率,而且消除了愈伤组织转接至新培养基上的适应期,理论上缩短了不定芽的分化周期,加速了甜菜植株再生的过程。此外,研究发现,甜菜茎节和叶子预处理后培养在激素浓度合适的培养基上可以通过器官发生途径形成再生植株[20]。然而,在本研究中不定芽的分化则需通过愈伤组织来形成,并未观察到直接器官发生方式形成不定芽,产生不同结果的原因可能是本研究中未对外植体进行预处理,也可能是取材部位不同,外植体再生能力存在一定差异。
Zhong等[11]研究发现,甜菜再生苗在MS和1/2 MS培养基上都可以生根,且在添加NAA后,1/2 MS培养基上的生根率远高于MS培养基,可达到70%。Hasino等[24]也以1/2MS为基本培养基成功诱导出不定根,从而建立了甜菜遗传转化体系。在本研究中,甜菜再生苗在含有NAA的1/2MS培养基上并不能生根,这与之前研究中降低培养基中无机盐的浓度可以提升大多数植物的生根能力的结论不一致[25],可能是由于本实验中所设生长素浓度过小,未达到甜菜再生苗生根所需激素水平;亦或是所用甜菜品种基因型不同,生根能力不同所致。令人意外的是,甜菜再生苗可以在含0.1 mg/L NAA的MS培养基上生根,生根率可达到33.3%,由此说明基本培养基中无机盐浓度、激素种类及浓度对生根均有影响。因此,在选择生根培养基时需对上述因素进行综合考虑。
4 结论
本研究以甜菜叶柄为材料,建立了甜菜愈伤组织诱导和植株再生体系。结果表明,甜菜叶柄在MS+4 mg/L 6-BA+0.5 mg/L NAA的培养基上可高效快速地脱分化形成愈伤组织,愈伤组织诱导率高达88.2%。但在愈伤组织的分化过程中仍存在不定芽诱导率较低等困难,在分化培养基上不定芽诱导率最高仅为9.4%。此外,本研究还对不定芽的生根进行了诱导,发现不定芽可以在含0.1 mg/L NAA的MS培养基成功生根,生根率达到33.3%;这为之后甜菜分子育种改良及基因功能探索提供了可能。
致谢:本研究所使用的甜菜种子由甘肃武威市三农种业科技有限公司段生福先生无偿提供,致以衷心谢意!

