兔肺VX2肿瘤微波消融多模态成像实验研究
林晓南, 林征宇, 缪仙花, 苏怀盈, 陈 健
微波消融(MWA)具有升温快、消融范围大、热沉效应影响小等优点,是肺肿瘤热消融治疗常用手段[1]。本研究通过对比观察兔肺VX2肿瘤MWA术中红外热成像表现、术后CT、MR影像表现及病理表现,分析兔肺肿瘤MWA消融灶红外热成像-CTMR-病理相关性。
1 材料与方法
1.1 建立兔肺VX2肿瘤模型
VX2瘤株制备——腿部荷瘤兔(福建医科大学动物实验中心惠赠)腿部肌内注入氯胺酮1 mL/kg全身麻醉、术区2%利多卡因局部麻醉后固定于自制手术台,切取鱼肉样肿瘤组织置于1∶50头孢氨苄溶液培养皿,眼科剪将瘤块制成约1 mm×1 mm×1 mm大小备用。
兔肺VX2肿瘤种植——15只新西兰大白兔禁食6 h,全身麻醉并穿刺部位备皮,俯卧固定于Somatom Emotion 16层螺旋CT机(德国Siemens公司)扫描床,CT导引下将16 G穿刺针穿入肺组织,拔出针芯,沿针鞘推入VX2肿瘤块2~3块,并以0.9%氯化钠溶液1 mL封闭针道后拔针。术后20 d复查兔肺部CT观察成瘤情况,随机处死1只成瘤兔行病理证实。
1.2 兔肺VX2肿瘤MWA术
术前CT先行胸部CT平扫(120 kV,120 mAs,层厚 1.5 mm,FOV180 mm×180 mm),证实成瘤后即行 Espree 1.5 T MR机(德国 Siemens公司)扫描(TSE-T2WI-FS 序列:TR 3 800.0 ms,TE 78.0 ms,层厚 3.0 mm,层间距 0.6 mm,FOV 25 mm×20 mm;T1-Vibe 序列:TR 6.0 ms,TE 2.5 ms, 层厚 3.0 mm,FOV 25 mm×20 mm)。
术区备皮,CT导引下逐步进针,将MWA天线(15 G,150 mm,南京维京九洲医疗器械研发中心)贯穿肿瘤灶,并超出远端0.5 cm;调整红外热成像仪(杭州远洲医疗公司)距离及角度,镜头中心线与消融区体表垂直,镜头至体表距离保持130 cm,实时监控红外热成像;设定MWA功率45 W,消融时间3 min,采集温度场变化数据。
1.3 术后影像和病理学检查
术后CT扫描观察肿瘤消融效果,随后即刻行MR检查(序列同术前),观察消融灶MR表现。处死瘤兔,取出肺标本,沿MWA天线针道剖开,行组织病理学检查,检测术后CT上瘤灶最大径(DCT)、T1-Vibe高信号瘤灶最大径(DT1)、病理上肺组织凝固坏死区最大径(D凝固);检测术后CT上磨玻璃影(GGO)最大径(DGGO)、TSE-T2WI-FS 高信号最大径(DT2)、红外热成像41℃等温区最大径(DIR)和病理上热损伤区最大径(D损伤)。
1.4 统计学处理
采用SPSS 22.0软件作统计学分析。所有数据均用 t检验,以均数±标准差表示,P<0.05 为差异有统计学意义。
2 结果
2.1 成瘤情况及影像学表现
15只实验兔中11只见肺内孤立性成瘤灶(5只肿瘤病灶位于左肺下叶,6只位于右肺下叶),最长径 10.3~13.1 mm,平均(11.7±0.9) mm;2 只见胸膜广泛转移;2只肺内未见明确肿瘤病灶。处死1只成瘤兔,证实为VX2肿瘤。CT检查显示肺内孤立性结节灶,病灶边缘可见浅分叶改变,边界清楚;MR检查显示病灶形态与CT所见大致相仿,与胸壁肌层信号对照,病灶于TSE-T2WI-FS序列上呈稍高信号,T1-Vibe序列上呈边界清晰等信号影(图1)。
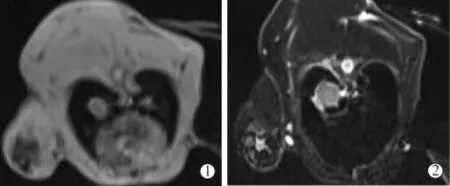
图1 兔肺VX2肿瘤种植成功MR表现
2.2 MWA术中红外热成像表现
术区体表平均温度在MWA开始前约32℃,开始后逐渐提升,热场大致呈同心圆状由中央向外辐射,中央温度最高(图2),消融完成时温度达顶峰,术区体表最高温平均值为(46.82±0.32)℃。
2.3 MWA术后影像学表现
术后CT平扫显示瘤灶密度略减低,周围可见片状GGO覆盖原病灶,边界不清(图3①);MR平扫T1-Vibe序列显示病灶较消融前信号增高,病灶边界较前模糊,周围可见少许淡片状略高信号(图3②),TSE-T2WI-FS序列显示消融灶中央信号减低,外周可见斑片状高信号影覆盖,信号不均(图3③)。
2.4 MWA术后病理学表现
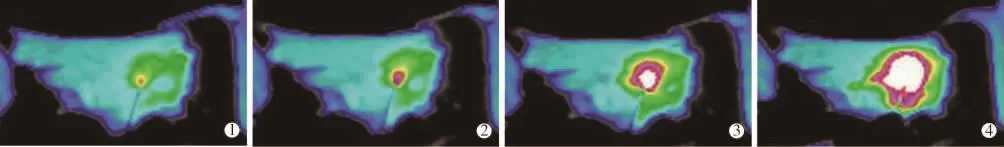
图2 MWA术中红外热成像表现
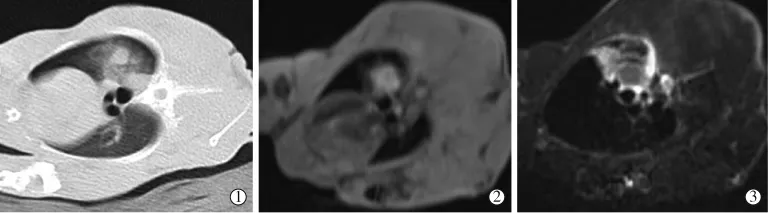
图3 MWA术后CT、MR表现

表1 DCT、 DT1、 D凝固、 DGGO、 DT2、 DIR、 D损伤测量值
瘤兔肺标本大体病理:消融灶中心可见一空心针道影,沿针道将消融灶水平剖开,病灶由内向外层次分明,中央为灰黄色肿瘤组织凝固性坏死区,周围可见一类圆形暗褐色肺组织凝固性坏死区,最外周为片状暗红色充血水肿热损伤区域(图4①)。光学显微镜(HE染色)下病理:肿瘤组织凝固坏死区表现为肿瘤细胞大面积坏死,细胞核结构完全破坏,仅残留细胞轮廓;肺组织凝固性坏死区表现为细胞核结构破坏,残留肺组织细胞轮廓;热损伤区肺泡内可见大量渗出性液体,部分肺泡完全填充,液体内含碎裂红细胞和各类炎性细胞,与正常肺组织分界欠清(图 4②)。 DCT、DT1、D凝固、DGGO、DT2、DIR、D损伤检测值见表1,DCT、DT1与D凝固间成对样本 t检验结果见表2,DGGO、DT2、DIR、D损伤间两两比较结果见表3;结果显示DCT与D凝固间差异无统计学意义(P>0.05),DT1、DCT与 D凝固间差异均有显著统计学意义(P<0.000 1),DIR与 D损伤间差异无统计学意义(P>0.05),DGGO、DT2与 D损伤间差异均有统计学意义(P<0.000 1)。
3 讨论

图4 MWA术后病理学表现

表2 DCT、 DT1与D凝固成对样本 t检验
近年MWA在肺部原发性和继发性肿瘤治疗中发挥越来越重要作用[2-3]。但肺肿瘤热消融术后有一定的复发率。Okuma等[4]报道对CT导引下热消融治疗肺恶性肿瘤进行长达9年随访,发现肿瘤直径>2.0 cm时复发率高达32%。肺部过度消融易引发感染、气胸、肺不张、支气管胸膜瘘等并发症[5]。因此,准确判断消融后凝固性坏死和热损伤边界,对降低局部复发率、减少并发症至关重要[6-7]。
目前肺部肿瘤热消融术后即刻疗效评价主要以 CT 为主,GGO 覆盖范围超出肿瘤边缘 0.5~1.0 cm是肿瘤完全消融标志[8]。但消融术后肿瘤周围GGO覆盖区包括凝固坏死的肿瘤组织、凝固性坏死的肺组织及周边炎性渗出的肺组织[9]。本研究证实,CT上GGO范围大于凝固性坏死区,但小于热损伤区;微波天线穿刺过程中易发生肺内出血,CT表现为斑片状密度增高影,常掩盖GGO,影响疗效评估。因此,仅以CT扫描判断肺部肿瘤MWA术后疗效存在一定局限性。由于VX2瘤株易得,在肺部成瘤率高[10],本实验采用其研究肺肿瘤MWA局部疗效及热场分布。
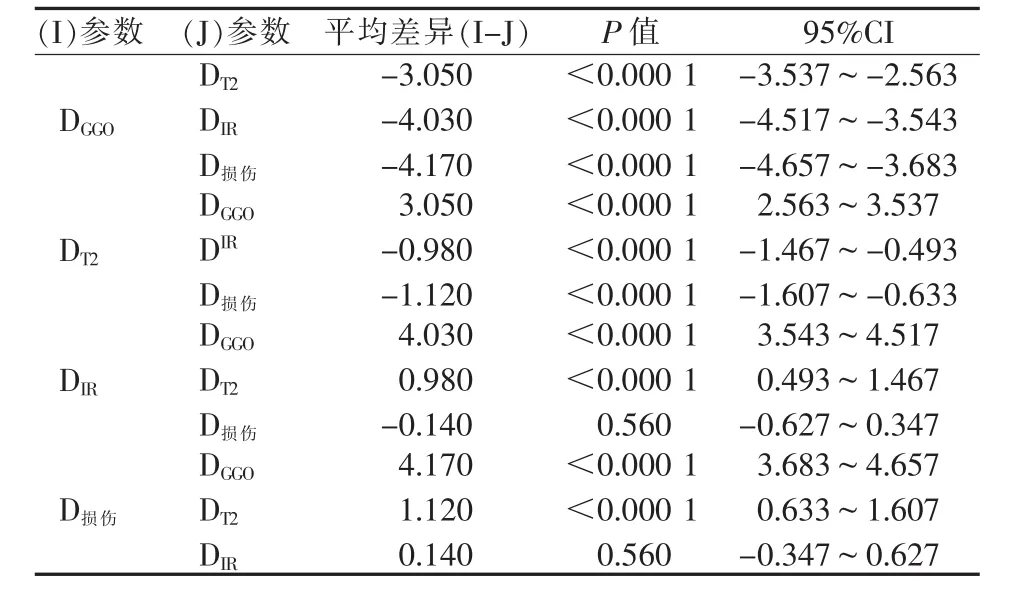
表3 DGGO、 DT2、 DIR、 D损伤间两两比较结果
高温消融后凝固性坏死区水含量明显下降,表现为T1WI信号升高、T2WI信号下降。周围热损伤肺组织水肿区域水含量升高,T1WI表现为比肺部气体稍高信号、T2WI上呈明显高信号。热消融治疗后,凝固坏死区包含凝固坏死的肿瘤组织及凝固坏死的肺组织[11-12]。本研究中T1-Vibe序列上消融灶信号较高,范围与凝固性坏死区一致,TSE-T2WI-FS序列上由于水含量下降,坏死区显示为低信号,其周围可见大片状混杂高信号影,虽然高信号区与热损伤区差异有统计学意义,但两者范围大致吻合。因此,MR评价MWA术后疗效优于CT。
MWA术后损伤主要由温度升高引起,因此显示肺内热场分布可有效预测消融疗效和热损伤范围。MR测温技术可测得扫描范围内感兴趣区温度,但却有局限性。MR测温技术需要专门软件,对呼吸、心跳、运动产生的伪影十分敏感,肺组织含有大量气体也会影响测温准确性,且具有一定延时性、非实时监测,因此并不完全适用于肺部肿瘤热消融治疗实时温度监测[13]。MWA时机体内部温度变化通过血液循环和组织间热传导传递至体表,红外线扫描装置可实时采集机体向外辐射热能,通过计算机后处理软件以不同色阶代表不同温度,整合成一张红外热成像图,反映体表温度。本研究中41℃等温线最大径与病理上热损伤区无明显统计学差异,大于CT扫描时GGO最大径和MR扫描时TSET2WI-FS序列高信号最大径。对术中正常肺组织热损伤范围监测上,CT/MR检查通过肺组织热损伤后肺泡内出血或渗出间接反映热损伤范围,红外热成像技术可无创、实时、直接监测体表温度变化,具有一定价值。
总之,多模态成像应用可更为精确地评估热损伤范围,有助于缓解MWA时消融不足与消融过度间矛盾。

