弥散加权成像在早产儿缺血缺氧性脑病中的临床应用
张 妮,沈丹丹,周学军,葛 敏,花 烨,蒋佳珅,贾中正
(南通大学附属医院影像科,江苏226001)
新生儿缺血缺氧性脑病(hypoxic ischemic encephalopathy,HIE)指围生期、新生儿期窒息引起缺氧、脑血流减少或暂停而导致的脑损伤,也是导致新生儿围产期死亡及严重神经系统发育异常的主要原因之一。目前随着新生儿抢救及护理技术的不断提高,早产儿的成活率明显提高,但是同时早产儿脑损伤的发病率也在逐渐增加。我国每年大约有149万早产儿出生,占所有新生儿的11%[1],因此早产儿成为脑损伤及神经系统发育异常的高危人群。由于早产儿大部分脑损伤存在可逆性,所以早期诊断、早期干预治疗是提高早产儿存活率及降低致残率的关键。
HIE的临床诊断标准存在一定的主观性,有时不足以客观、明确诊断HIE[2]。目前最常用的辅助检查方法是颅脑超声、CT及常规磁共振成像(magnetic resonance imaging,MRI),颅脑超声及CT的组织分辨率及病灶检出率均不如MRI[3-5],CT还存在放射暴露的缺陷。由于早产儿脑富含水分及髓鞘化不完全,常规MRI对HIE的早期发现有一定的局限性,对HIE脑组织损伤程度的判断也比较模糊[6]。因此,寻找早期无创诊断早产儿HIE的方法十分重要。弥散加权成像(diffusion weighted imaging,DWI)可在微观水平上观察脑组织中水分子弥散状态,DWI的表观弥散系数(apparent diffusion coefficient,ADC)可以用于定量分析脑组织中水分子弥散程度。有研究表明,DWI对HIE一周内脑损伤极为敏感,可以预测患儿的预后及神经系统损伤情况[7-10]。
本研究选取2015年12月—2017年2月我院新生儿科确诊的28例HIE早产儿,重点探讨DWI对早产儿HIE的诊断价值,获取HIE脑损伤诊断的阈值,为临床诊断早产儿HIE提供参考依据。
1 资料与方法
1.1 一般资料 HIE早产儿28例均符合HIE诊断标准[11],其中男性17例,女性11例;出生体重1.1~2.5 kg,平均 2.0 kg;胎龄 30+1~35+4周,平均 33 周;日龄 1~30 天,平均 13 天;矫正胎龄为 33+3~36+5周,平均35周。同时选取45例正常早产儿作为对照,其中男性28例,女性17例;出生体重0.8~2.4 kg,平均1.8 kg;胎龄28+2~35+4周,平均33周;日龄1~34天,平均13天;矫正胎龄为33+1~36+6周,平均35周。本研究通过医院伦理委员会批准,所有早产儿在MRI检查前均获得监护人的同意并签订知情同意书。
1.2 MRI仪器设备及扫描方案 使用GE Signal HDxt 1.5T MR 扫描仪,采用标准的8通道相控阵头颅线圈。早产儿扫描前静脉推注苯巴比妥10 mg/kg镇静,待熟睡后进行扫描。用儿童专用耳塞保护听力,并用海绵垫固定颅脑。常规MRI检查包括SET1WI、SSFSE-T2WI及DWI成像。扫描参数如下:SE-T1W(ITR/TE=380 ms/11 ms,slice=3.5 mm,FOV=160 mm×160 mm);SSFSE-T2WI(TR/TE=2 500 ms/120 ms,slice=3.5 mm,FOV=160 mm×160 mm);DWI(TR/TE=5 300 ms/86.5 ms,slice=3.5 mm,FOV=160 mm×160 mm,b=1 000 s/mm2)。
1.3 图像后处理 所有数据采用GE公司提供的后处理软件,自动获得ADC图。选取11个感兴趣区(region of interest,ROI),分别为双侧额、顶叶深部白质、基底节区、内囊后肢、丘脑腹外侧核及脑桥,内囊后肢的ROI大小为0.15~0.20 cm2,其他ROI大小均为0.3~1.0 cm2,测量左右两侧各感兴趣区的ADC值,取平均值。
1.4 统计学处理 采用SPSS 20.0及MedCalc 12.7统计软件进行数据分析,计量资料以均数±标准差(±s)表示,符合正态性数据组间比较采用独立样本t检验,采用受试者工作特征曲线(ROC曲线)分析鉴别HIE患儿与正常早产儿的最佳ADC阈值及其灵敏性和特异性。P<0.05为差异有统计学意义。
2 结 果
2.1 HIE早产儿与正常早产儿各部位ADC值比较HIE患儿顶叶深部白质区的ADC值较正常早产儿高,差异有统计学意义(P<0.05),而额叶深部白质、基底节区、内囊后肢、丘脑腹外侧核及脑桥的ADC值与正常早产儿相比,差异均无统计学意义(均P>0.05),见表 1。

表1 HIE早产儿与正常早产儿各部位ADC值比较(10-3mm2/s)
2.2 顶叶深部白质ADC值鉴别HIE早产儿与正常早产儿的ROC曲线分析 当顶叶深部白质的ADC值为1.84×10-3mm2/s时,鉴别HIE患儿与正常早产儿的灵敏性为50.0%,特异性为84.4%(P<0.01)。见图1。
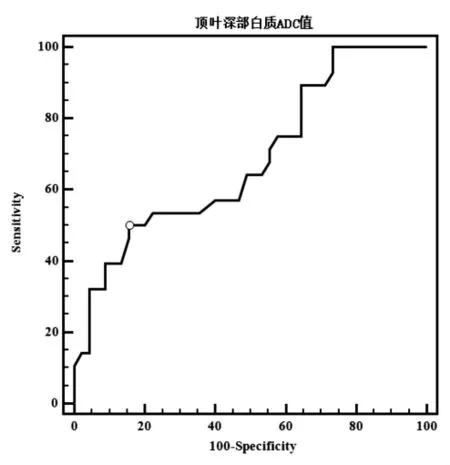
图1 顶叶深部白质ADC值鉴别HIE患儿与正常早产儿的ROC曲线
3 讨 论
HIE是导致早产儿脑损伤的主要原因之一。胎儿在32~41周,尤其36周以后,髓鞘形成的白质体积将以5倍速度迅速增长,同时少突胶质细胞前体细胞对缺血缺氧极其敏感[12-13],因此早产儿脑更易受到缺血缺氧的影响而发生损伤[14]。严重者可出现脑室周围白质软化(periventricular leukomalacia,PVL)及多囊脑软化,而严重的基底节区损伤可导致新生儿喂养困难、抽搐及四肢瘫痪,从而导致早产儿致残率及死亡率的增加。所以在早产儿脑发生不可逆性损伤前及早诊断与治疗对改善HIE患儿预后至关重要。
DWI作为一种观察脑内水分子弥散运动的无创性检查方法,可以间接反映脑组织细胞密度及髓鞘形成等信息,同时通过ADC值定量分析水分子弥散程度的变化,可以发现新生儿早期脑损伤。本研究测定了不同部位的ADC值,其中顶叶深部白质的ADC值在HIE患儿与正常早产儿中差异有统计学意义,而额叶深部白质、基底节区、内囊后肢、丘脑腹外侧核及脑桥区的ADC值差异均无统计学意义,这可能与HIE不同阶段的选择性易损区有关[15]。Barkovich等[16]研究基底节区损伤的HIE患儿时发现,Dv降低最早出现在丘脑腹外侧核,随后3~5天壳核及皮质的Dv值有所降低,6~7天时则出现在皮层下白质,表明HIE在发生发展的不同时段,不同部位发生着不同的微观结构改变。同时选择性易损区也与HIE患儿的脑成熟度、缺血缺氧的严重程度及持续时间密切相关[17]。本研究HIE患儿行MRI检查时平均日龄为13天,符合新生儿HIE脑缺血损伤的发展规律。
在本研究中,顶叶深部白质、基底节区、内囊后肢及丘脑腹外侧核的ADC值均稍高于正常组,与张福勇[18]报道的ADC值的变化类似。新生儿HIE发病初期(生后7天内),主要表现为细胞毒性水肿,DWI上为高信号,ADC值降低;但随着病情的发展1周左右,HIE由细胞毒性水肿发展为血管源性水肿,ADC值逐渐增加。在本研究28例HIE患儿中,大多数(24例)HIE患儿在出生后7天以上,所以结果显示顶叶深部白质ADC值略高于正常早产儿。HIE脑损伤处于亚急期,主要表现为血管源性水肿,细胞膜发生破裂,细胞外的自由水增多,水分子弥散受限程度减轻,ADC值增加[19-20]。还有一种可能是新生儿脑组织缺血缺氧导致少突胶质细胞成熟及髓鞘形成受阻,细胞外空间增大,细胞内外的水分子弥散受限程度减轻,ADC 值增加[21-23]。
有关DWI诊断早产儿HIE切峰阈值的研究报道很少。本研究结果显示,当顶叶深部白质的ADC值为1.84×10-3mm2/s时,鉴别HIE患儿与正常早产儿的灵敏性为50.0%,特异性为84.4%,与以往DWI诊断足月儿HIE的灵敏性范围类似[6,24],但本结果显示更高的特异性。
本研究存在一定的局限性。首先,研究的样本量相对较小,且MRI检查时多数早产儿日龄较大,不能完全反映HIE患儿早期脑损伤。其次,早产儿HIE的诊断标准参考足月儿HIE诊断指南,但是足月儿与早产儿脑结构存在一定的差异性,可能会导致部分指标受到早产的影响(如脐动脉血pH<7.0)[25]。在未来的工作中需增加样本量进一步明确DWI对早产儿HIE的诊断效能。
总之,顶叶深部白质ADC值可以作为诊断早产儿HIE的有效阈值,说明DWI可以提高诊断早产儿HIE的准确率,为临床诊疗提供重要的参考价值。

