利用红外光谱与原子力显微技术揭示纳米级大豆肽结构及其与溶解性的关系
,, ,*,,晓婉, ,
(1.哈尔滨商业大学食品工程学院,黑龙江省食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.东北林业大学林学院,黑龙江哈尔滨 150040;3.黑龙江正大实业有限公司,黑龙江哈尔滨 150001)
蛋白质的溶解性是蛋白质固有的性质,对其应用有着重要的影响,如果经加工处理后蛋白质的水溶性降低,则它的乳化性、起泡性等其他性质也将有不同程度的下降。天然态大豆蛋白,主要构成为球蛋白,这种蛋白质分子非极性基团朝向分子内部,形成疏水键;极性基团位于分子内部的,相互作用形成氢键和盐键,朝向分子表面的,可与极性水分子相互作用[1]。大豆蛋白这种结构使其易溶于水,在pH7.0的环境下大豆蛋白溶解度可达到90%以上。但是大豆蛋白经加热等加工处理后,因变形使其溶解度下降,严重影响到大豆蛋白功能特性发挥,降低大豆蛋白利用价值[2]。对蛋白质分子进行修饰改性能显著提高大豆蛋白溶解性,改善大豆蛋白功能特性[3]。
经过研究发现限制性酶解生成大豆肽具有良好溶解性,在等电点附近都能呈现较好溶解性。Sara等[4]用菠萝蛋白酶对大豆蛋白进行改性,溶解度显著提高。采用中性蛋白酶改性大豆蛋白,也能提高其溶解度。Walsh等[5]对大豆蛋白采用Alcalase蛋白酶进行限制性水解,试验结果得出其溶解度在pH3~5条件下明显提高。孙焕[6]利用两种酶水解大豆分离蛋白,显著增大其溶解性。
本研究采用胃蛋白酶对大豆分离蛋白(Soybean protein isolate,SPI)进行酶法水解,利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)和原子力显微镜(Atomic force microscope,AFM)对蛋白质的二级结构含量变进行分析,从而揭示SP二级结构含量及形态结构与溶解度的关系。为制备高溶解性氨基酸饮品的应用提供方法和理论指导。
1 材料与方法
1.1 材料与仪器
SPI 辽宁阜新市维远蛋白科技有限公司;胃蛋白酶(3000 U/g) 上海紫一试剂厂;NaOH、HCl 分析纯,天津市大陆化学试剂有限公司。
Nicolet 6700型傅里叶红外光谱仪 天津港东科技发展有限公司;F-7000型原子力显微镜 HITACHI公司;G1-21M型高速离心机 上海安亭科技仪器厂;LGJ-10型真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 SP的制备 称取SPI加入蒸馏水配制成浓度5%(w∶v)的悬浊液,再置于90 ℃水浴热处理15 min,冷却至室温后,用0.1 mol/L HCl将溶液pH调至2.0,按照加酶量120 U/g加入胃蛋白酶,搅拌均匀后置于35 ℃恒温水浴锅中保持24 h,再升温至90 ℃保温15 min灭酶,冷却后,用0.1 mol/L HCl或NaOH调节pH至4.5,将酶解液经4000 r/min离心15 min后取上清液,进行喷雾干燥,得到大豆肽粉末。
1.2.2 红外光谱定量分析 将SP和SPI置于干燥器内充分干燥,准确称取0.1 g,将SP和SPI放在样品台的衰减全反射技术(Attenuated total reflection,ATR)附件上,调节压力塔至合适位置,进行测试。吸收光谱的波数范围选择450~4000 cm-1,分辨率4 cm-1,波数精度0.01 cm-1,经32次扫描,环境温度设为25 ℃[7]。
1.2.3 原子力显微镜分析 将SP和SPI样品分别溶于去离子水中,配制浓度为100 μg/L的溶液,取一滴蛋白溶液分散于新剥离干净的云母片上,室温下自然晾干,原子力显微镜测量条件如下:采用敲击式AFM进行测量,使用Nanoscope软件对AFM图像对SP和SPI的表面的形貌图和相位图进行分析和处理[8]。
1.2.4 溶解性测定 参照Qi的方法[9],略有改动。先配制2%(w∶v)的SP或SPI溶液,再进行磁力搅拌1 h,然后在4500 r/min离心10 min,采用凯氏定氮法,测定上清液中的氮含量,根据公式(1)测定计算样品的溶解性。

式(1)
1.3 数据处理
采用Microsft Office Excel 2003软件对数据进行处理和绘图,结果表示为平均值±标准偏差(n=3)形式,采用SPSS软件中单因素ANOVA对数据进行显著性分析,显著性水平设定为p<0.05。本文利用Peak Fit 4.12软件对酰胺I带1700~1600 cm-1波段的图谱进行分析。
2 结果与讨论
2.1 红外光谱定量分析
通过红外定量分析,讨论SPI和SP的二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲结构含量的差异,由红外光谱定量处理所得到的数据拟合结果如图1所示。

图1 SPI及SP的定量分析FT-IR光谱图Fig.1 Qualitative analysis of SPIand SP by FT-IR SPectra
本文主要分析在450~4000 cm-1的波数范围的透光率,其中包含蛋白质构象变化最重要的两个区域,即酰胺I和酰胺III区域。在蛋白质的二级结构分析中酰胺I带相对来说更具有价值[10],为准确得到SPI和SP的二级结构各组分含量的变化,得到结果如图2所示。
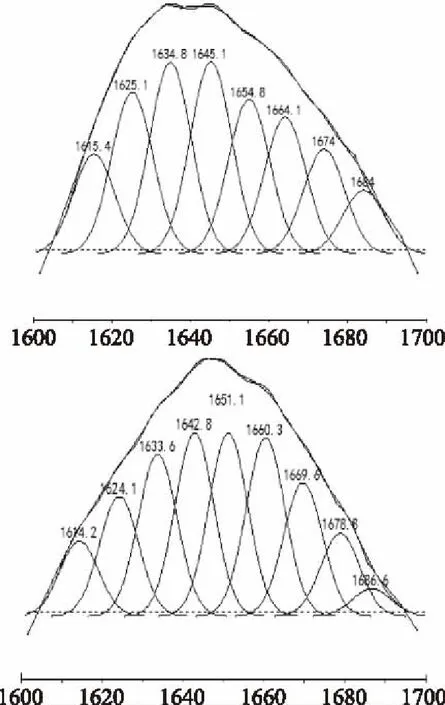
图2 SPI和SP酰胺I带拟合结果Fig.2 Result of SPI and SP fitting use of the amide I
酰胺I带各子峰与二级结构对应关系为:1640~1618 cm-1和1690~1670 cm-1为β-折叠;1660~1650 cm-1为α-螺旋;1650~1640 cm-1,为无规则卷曲;1700~1660 cm-1为β-转角[11]。根据图2确定各子峰与不同二级结构对应关系,由其积分面积计算各二级结构的相对百分含量,酰胺I带二级结构拟合结果如表1所示。
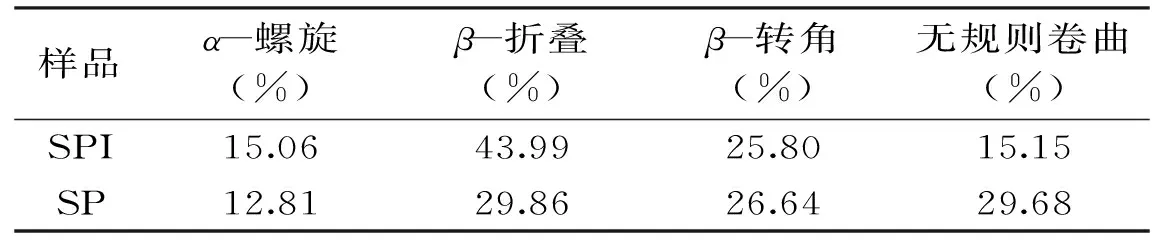
表1 SPI及SP的酰胺I带拟合二级结构结果Table 1 Result of the secondary structure of SPI and SP with a fitting use of the amide I
由表1可知,与SPI相比,SP的有序结构α-螺旋和β-折叠结构含量分别降低了2.25%和14.13%,而无序结构的β-转角和无规则卷曲含量分别提高了0.84%和14.53%,证明胃蛋白酶水解SPI得到SP的过程为有序结构向无序结构转化过程。已有研究得到类似结论,如Zhao等[12]利用Alcalase酶水解SPI得到SP,发现SP比SPI的有序结构含量低5.00%,无序结构含量高6.00%。由表1发现,SPI二级结构主要是以β-折叠结构为主,其含量为43.99%,而SP的β-折叠结构含量比SPI低14.13%。有研究发现蛋白质中β-折叠是由肽链上连续存在许多疏水性残基形成的肽链间平行的氢键缔合结构,所以β-折叠在结构中存在大量的氢键使肽链之间紧紧地聚集在一起[13],同时疏水键也增加,导致β-折叠结构所占蛋白结构含量高的蛋白质溶解度低[14]。SP比SPI中β-折叠结构在整体二级结构中占的比例小,氢键含量低,疏水性残基含量低,导致SP的溶解性越高。SP的β-转角结构含量比SPI含量高0.84%,有研究发现亲水性氨基酸增加会导致β-转角结构增加[15],因此SP侧链的亲水氨基酸残基暴露比SPI的高,其溶解性较优于SPI。
虽然SPI的主要结构为β-折叠结构,并不能证明SPI为全β-蛋白折叠结构,由于SPI的β-折叠含量大于40.00%,α-螺旋含量也大于5.00%,所以不属于全β-蛋白结构,SPI的α-螺旋含量大于15.00%,且β-折叠含量大于15.00%,所以SPI为α,β-蛋白结构,而SP是以无规则卷曲和β-折叠的含量为主的蛋白结构,其中无规则卷曲结构氢键比有序结构的少,使蛋白质分子展开,空间结构松散[16],埋在蛋白质分子内的极性氨基酸基团暴露在蛋白质分子的表面,与水分子通过氢键和静电力相互作用,导致蛋白质溶解度增加[17]。
2.2 原子力扫描电镜分析
原子力扫描电镜是一种能在空气环境中观察蛋白形貌的有效手段,是间接观察到蛋白是分散和聚集形式的仪器[18]。用Nanoscope软件分析得到SPI和SP高度图和相位图,如图3所示。
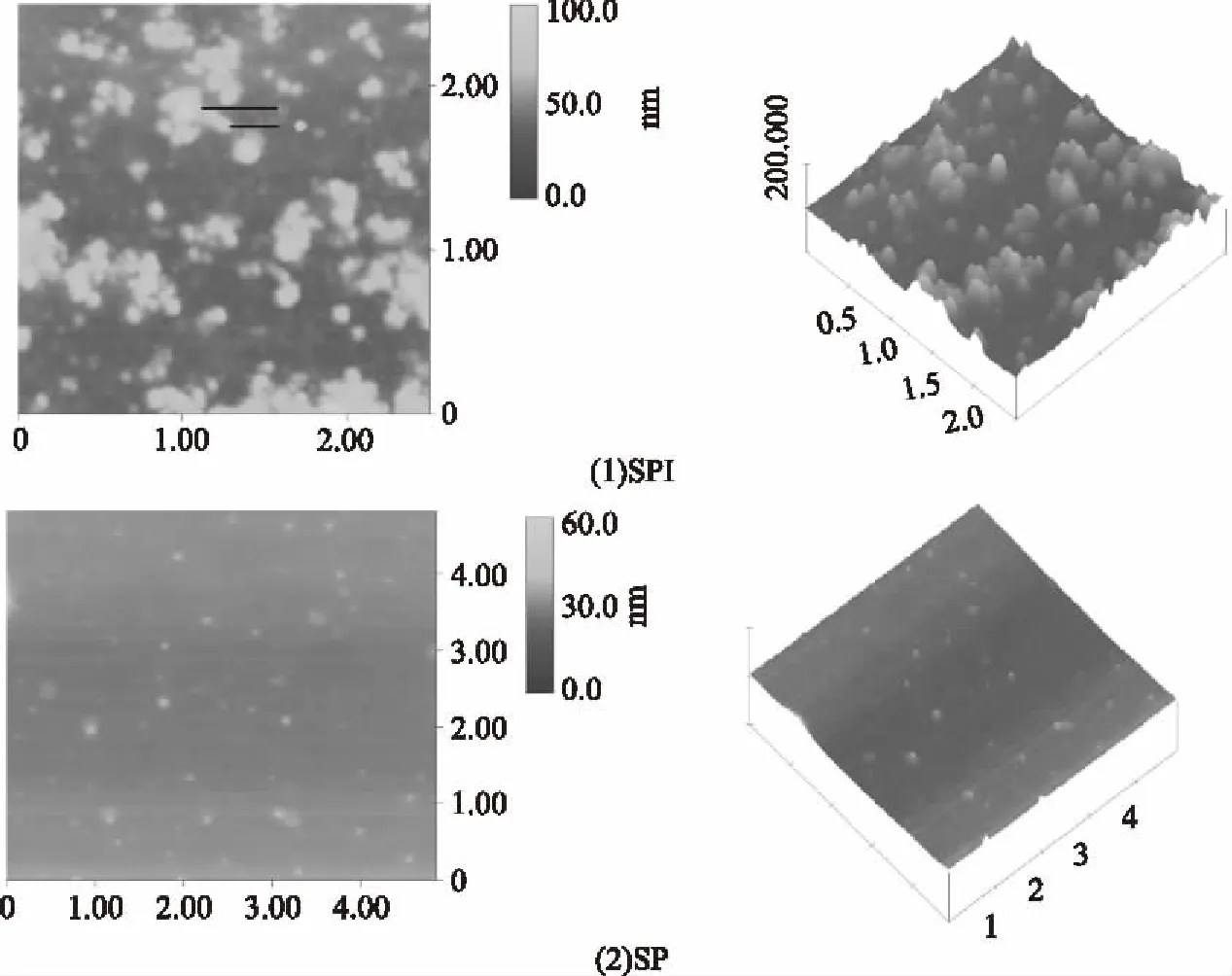
图3 SPI和SP的原子力显微镜图Fig.3 AFM Spectra of SPI and SP
由图3可知,SPI颗粒明显,表面不平滑,出现分子聚集现象,并呈现α亚基结构的花骨形和α′亚基或β亚基结构的虫形[19]。而SP表面较平滑颗粒较分散,以单个分子状态存在,未出现7S的亚基的聚集体。
利用Nanoscope软件Section分析,SP的粒径范围为35.82~11.09 nm,峰和峰之间有377.1 nm,而SPI粒径范围为71.64~10.69 nmn,峰和峰之间有0.275 nm。SP最大粒径仅为SPI的50%,这是因为SP比SPI内部和分子间的电荷斥力作用增加,蛋白质-蛋白质相互作用减少,由于排斥力防止聚集体的形成[20]。除了电荷斥力,研究人员还发现蛋白的分子量也是导致其粒径变化的另一原因,通过实验发现大豆蛋白分子量越小,其粒径越小,如Tang等得出大豆11S球蛋白亚基分子量小于7S球蛋白亚基,导致大豆11S球蛋白亚基直径比大豆7S球蛋白亚基小10.6 nm[21]。
2.3 溶解性的分析
蛋白的溶解性对自身其它的功能特性有直接影响,同时受条件因素的影响较大[22],SP和SPI的溶解性的不同,如图4所示。
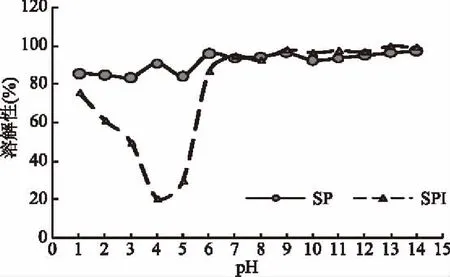
图4 SP和SPI的溶解性Fig.4 The solubility of SP and SPI
由图4可知,在碱性条件下SPI和SP都呈现较好的溶解性,但是在酸性条件下SPI溶解性下降。尤其是pH4.0时,SPI的溶解性仅为20.46%,而SP溶解度为90.64%,这是因为在蛋白质等电点附近,SPI解离成阳离子和阴离子的趋势或程度相等,成为兼性离子,呈电中性,此时蛋白分子颗粒在溶液中因没有相同电荷的相互排斥,分子相互之间的吸引作用力占主导,其颗粒极易碰撞、凝聚而产生沉淀[23]。而SP比SPI的无序结构高,氢键含量低,结构松散暴露导致阴阳离子多,其表面的亲水基团数量远大于疏水基团[22],且SP为酸碱两性电解质,也因为其体积变小,离子性增强,其侧链极性基团增加[24-25],因此不会发生沉淀。有些研究也发现SP的溶解性要优于SPI[26],如Ortiz等[27]发现SP溶解性较SPI好,SP比SPI内部和分子间的电荷斥力作用增加,蛋白质-蛋白质相互作用减少,蛋白质-水相互作用增加,排斥力增加,防止了聚集体的形成,降低蛋白质的粒径,从而增加溶解性。郭丽[28]利用Alcalase蛋白酶水解大豆β-伴球蛋白获得SP,发现在pH2.0~8.0范围内,SP具有良好的溶解性,SP比SPI溶解性高,可能是因为含有较小的分子和新暴露的氨基和羧基基团,能与水形成较强的氢键,从而更易溶于水溶液[29]。SP溶解性较高可能是因为SP的无规则卷曲含量比SPI高,SP的氢键含量低于SPI,同时有较强静电斥力作用导致分子间距离增加[30],导致SP分子未出现聚集。
3 结论
本实验主要研究SPI在胃蛋白酶水解过程中二级结构和溶解性的变化,相较于SPI,SPα-螺旋和β-折叠结构遭到破坏,向β-转角和无规则卷曲转化。同时SP具有较好的功能性质,在pH为蛋白质等电点时,SPI溶解性为20.46%,而SP溶解度高为90.64%。原子力显微镜观察时也证实了SP的粒径小于SPI,导致溶解度越高。

