白菜叶际细菌多样性与毒死蜱降解菌筛选及分离鉴定
, ,,*,,
(1.北京联合大学生物化学工程学院,北京 100023;2.中国科学院大学资源与环境学院,北京 100190;3.中国科学院生态环境研究中心,北京 100085)
叶际,即植物的地上部分,是地球上最大的微生物栖息地之一,其总面积可达4×108多平方千米[1-2]。植物叶际生存着复杂多样的微生物群落[3-4],被称为叶际微生物,包括细菌、真菌、藻类和原生动物等[5-6],其中细菌数量最多,可达106~107cfu/cm2叶面积[2]。叶际微生物与宿主植物的关系十分复杂,既有抵御病害微生物、固氮、促进生长和分解残留农药等正面作用[7-8],也有引发植物病害等负面作用[9-10]。
农药因在防治农作物病虫草鼠害方面具有高效、快速、经济、简便等特点而被广泛使用。然而,毒农药的残留问题也随之成为环境、食品等领域需要解决的突出问题[11]。农药在蔬菜初级品以及加工品中均存在,给食品安全带来了极大挑战[12]。有机磷农药作为一类广谱、高效的杀虫和除草剂常被用于果蔬等农作物的害虫防治,但其大量使用对人、动物和环境产生的危害也日趋严重[13]。毒死蜱(chlorpyrifos)作为一种有机磷杀虫、杀螨剂,由于具有杀虫谱广、毒性中等优点,逐渐取代了一些高毒农药,因此在农业生产中使用范围越来越广,用量越来越大,对土壤、大气、水等环境均造成污染[14-16]。食品中毒死蜱残留超标问题严重,影响人们膳食消费安全[17]。农药的微生物降解农药因其操作简单、降解彻底、无二次污染等优点,一直是国内外的研究热点[18],其在受污染的土壤与水体生物修复中得到了认可,具有良好的应用前景[19]。
农药残留的微生物降解一直是食品安全领域的研究热点,已报道的能降解有机磷农药的微生物包含细菌、真菌、放线菌、藻类等,其中细菌在生化上的适应能力多变,易受外界条件影响而诱发突变,属于重要的农药降解微生物之一。但是,已报道的农药残留降解菌大多数都是从土壤或水体底泥中分离富集获得[20-21],而从植物叶际分离农药残留降解菌的文献却很少。
白菜为十字花科绿叶蔬菜,属于芸苔属植物,富含纤维素、维生素和矿物质等物质[22-24]。目前白菜已成为世界上均衡膳食的重要组成成分[25]。本文选用幼苗期体型较小的白菜为研究对象,考察完整白菜叶际的细菌多样性,并从中筛选和鉴定毒死蜱降解菌,为深入研究毒死蜱降解菌的降解特性、应用和机理提供基础,有利于白菜的食用安全和人体健康。
1 材料与方法
1.1 材料与仪器
白菜 十字花科芸薹属,种植在北京市怀柔区实验基地,日平均气温约为24.2 ℃,日平均相对湿度约为63.3%。白菜生长至幼苗期后,随机选取白菜叶片,进行相关实验分析。毒死蜱乳油(480 g/L) 江苏宝灵化工股份有限公司;引物27f和1492r、LB 上海生工生物工程技术服务有限公司;2×MIX、TaKaRa、Tris-Base、QXTD和PDA 青岛高科园海博生物技术有限公司;高氏Ⅰ号培养基和琼脂 北京奥博星生物技术有限责任公司;毒死蜱标准品(1 mg/mL) 国家质量监督检验检疫总局;乙腈(HPLC级) 瑞典Oceanpak公司;N-丙基乙二胺(PSA)(粒度40~60 μm) 美国Agela Technologies公司;石墨化炭黑(GCB)(120~400 Mesh) 美国Sepax Technologies 公司;其他试剂 均为分析纯。
LB Agar培养基:LB Agar粉 40 g,蒸馏水1 L,分装,121 ℃灭菌20 min;LB培养基:LB粉25 g,蒸馏水1 L;分装,121 ℃灭菌20 min;PDA培养基:PDA粉46 g,蒸馏水1 L;分装,在115 ℃灭菌20 min;高氏Ⅰ号培养基:高氏Ⅰ号粉34 g,蒸馏水1 L;分装,121 ℃灭菌20 min;无机盐养基:K2HPO4·3H2O 0.5 g,MgSO4·7H2O 0.2 g,KH2PO40.5 g,NaCl 0.2 g,CaCl20.1 g,MnSO40.001 g,FeSO40.001 g,(NH4)2SO41.0 g,H2O 1 L;含有100 mg/L毒死蜱无机盐培养基:向无机盐养基中加入适量毒死蜱,使其浓度达到100 mg/L。
DB-5MS色谱柱(30 m×0.25 mm,0.25 μm) 安捷伦公司;C18(孔径6 nm,粒度40~60 μm) 美国Sepax Technologies公司;GC-MS-QP2010 ultra 岛津制造所;QUINTIX1102-1CN电子天平 北京塞尔里斯科学仪器有限公司;VM-10涡旋振荡器 韩国Daihan Scientific公司;THZ-C-1台式冷冻恒温振荡器 太仓市实验设备厂;SW-CJ-IFD型单人单面净化工作台 苏州净化设备有限公司制造;TGL-20M高速台式冷冻离心仪 湘仪离心机厂;EDC-810型基因扩增仪 东盛国际贸易有限公司;细菌基因组DNA提取试剂盒(DP302) 天津生化科技(北京)有限公司;MB100.49型微孔板恒温振荡器 杭州奥盛仪器有限公司;BG-Pwer 600 i型电泳仪电源 北京百晶生物技术有限公司;DY-12型电泳成像仪 Alpha Imager。
1.2 实验方法
1.2.1 白菜叶际细菌的分离 在净化工作台中取10 g白菜叶片样品放入200 mL无菌磷酸缓冲盐溶液(pH7.0)中密封好[26],接着超声波振荡(40 kHz)8 min,然后摇床培养(180 r/min,室温)30 min,再超声波振荡(40 kHz)2 min,最后在净化工作台中取出叶片样品,取菌液备用。
取10 g白菜叶片样品放入200 mL无菌磷酸缓冲盐溶液(pH7.0)中[26],先超声波振荡(40 kHz)8 min,然后摇床培养(180 r/min,室温)30 min,再超声波振荡(40 kHz)2 min,最后无菌操作下取出叶片样品,取菌液备用。
1.2.2 白菜叶际细菌数量的检测 分别用LB、PDA、高氏一号以及100 mg/L毒死蜱的无机盐培养基对白菜叶际细菌进行分离,按10倍依次稀释涂平板,30 ℃培养24 h,菌落长成后计数,挑取形态不一的菌株纯化、鉴定和保藏。
1.2.3 菌株的保藏和活化 将分离好的菌株斜面,于4 ℃冰箱内保存备用。将保存好的菌株斜面划线涂平板,30 ℃条件下培养24 h后,挑出性状保持良好的菌落,接种于液体培养基中,于180 r/min、30 ℃培养24 h后,再转接3~4代后,菌株活性基本恢复正常。
1.2.4 白菜叶际细菌DNA的提取 用细菌基因组DNA提取试剂盒提取白菜叶际细菌基因组DNA,回收DNA溶液,经由Nanodrop仪器检测其浓度。
1.2.5 16S rDNA扩增 采用细菌通用引物,27f:5′-AGAGTTTGATCCTGGCTCAG-3′;1492r 5′-TACGGYTACCTTG TTACGACTT-3′。PCR 反应体系:2×MIX 25 μL,27f(10 μmol·μL-1)1 μL,1429r(10 μmol ·μL-1)1 μL,模板是1 μL的细菌DNA,加入ddH2O至反应体系总体积为50 μL。反应条件:预变性95 ℃ 10 min,变性94 ℃ 45 s,退火55 ℃ 45 s,延伸72 ℃ 1 min,35个循环;最后72 ℃延伸10 min。1.5%琼脂糖凝胶对PCR反应产物进行电泳检测。
1.2.6 测序与比对 将叶际细菌DNA样品送至北京瑞博公司进行测序,所测序列经Blast序列比对,对菌株进行分子鉴定。
1.2.7 毒死蜱降解 挑取具有毒死蜱降解活性的菌株于含100 mg/L毒死蜱的无机盐培养基中,30 ℃活化培养24 h,即得种子液。将种子液按5%接种量接种到含有100 mg/L毒死蜱无机盐培养基中,即实验组,以未接种发酵培养液为空白组。不同处理组同时置于摇床上振荡培养24 h,培养条件为30 ℃,180 r/min。每个实验组有3个平行,分别采样测定毒死蜱残留量。
1.2.8 毒死蜱降解率检测 采用QuEChERS-GC/MS(快速、容易、便宜、有效、稳定和可靠-气相色谱/质谱联用法)检测毒死蜱降解菌对毒死蜱的降解率。
1.2.8.1 样品预处理 精确量取15 mL含毒死蜱发酵液试样于50 mL聚乙烯离心管中,加入3 g氯化钠、1.5 g无水乙酸钠及15 mL 1%乙酸乙腈溶液,漩涡1 min后,以5000 r/min离心10 min。
1.2.8.2 净化 取2 mL上清液转入装有100 mg PSA(N-丙基乙二胺)、100 mg C18(C18烷基-硅胶)、300 mg无水MgSO4和30 mg GCB(石墨化炭黑)的5 mL离心管中,漩涡1 min使其混匀,以5000 r/min离心10 min,上清液过0.22 μm滤膜,收集于自动进样瓶中,供GC-MS检测。
1.2.8.3 气相色谱条件 安捷伦DB-5MS 色谱柱(30 m×0.25 mm,0.25 μm),柱温50 ℃ 保持2 min,以10 ℃/min升温至180 ℃,保持1 min,再以6 ℃/min升温至270 ℃,保持7 min;柱流速1.0 mL/min;进样口温度280 ℃;进样方式:不分流进样,高压进样(100 kPa),1.5 min后开阀;进样体积1 μL。
1.2.8.4 质谱条件 电子轰击源(EI)电离方式,70 eV;离子源温度200 ℃;离子源电压1.20 kV。
1.2.8.5 标准曲线的绘制 取一定量的毒死蜱标准储备液(10 mg/L),用乙腈稀释成0.2、0.4、0.6、0.8、1.0 mg/L的标准液,进行标准曲线的绘制。
1.2.8.6 毒死蜱降解率的计算 计算公式:R(%)=(C0-C1)/C0×100
其中,R代表菌株对毒死蜱的降解率;C1为实验组毒死蜱浓度(mg/L);C0为空白组毒死蜱浓度(mg/L)。
1.3 数据统计分析
将Blast比对后的序列经由MEGA 5软件进行系统发育树的构建。
2 结果与分析
2.1 白菜叶际细菌分离和计数
用LB、PDA、改良高氏一号和含100 mg/L毒死蜱无机盐培养基对白菜叶际细菌进行分离,分别获得表型差异较明显的细菌菌株29株、4株、7株和11株,共获得51株表型差异较明显的细菌菌株。另外LB、PDA、改良高氏一号和含100 mg/L毒死蜱无机盐培养基上细菌的浓度分别为1.24×106、1.03×104、2.07×104和2.64×105CFU/g。可见,不同培养基筛选到的白菜叶际细菌在数量上存在多样性。
2.2 LB培养基分离白菜叶际细菌的多样性
将LB培养基上分离培养所得细菌的DNA样品测序,将所测序列经Blast序列比对,得出16S rDNA 序列相似性为99%~100%,如表1所示。将Blast比对后序列经由MEGA5软件进行系统发育树的构建,系统发育树表征了这些菌株间亲缘关系和白菜叶际细菌多样性,结果见图1。LB培养基上分离获得29株表型差异较明显的细菌,经分子鉴定,它们分别属肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)、农杆菌属(Argobacterium)、假单孢菌属(Pseudomonas)、微杆菌属(Microbacterium)和嗜麦芽窄食单孢菌(Stenotrophomonas),其中肠杆菌属为优势菌属,其在所有分离鉴定菌株中所占比例约为28.0%;而假单孢菌属次之,约为21.0%。

表1 LB培养基分离白菜叶际细菌多样性Table 1 Diversity of bacteria separated by LB medium from phyllosphere of Brassica chinensis

图1 LB培养基分离白菜叶际细菌的系统发育树Fig.1 Phylogenetic tree of bacteria separated by LB medium from phyllosphere of Brassica Chinensis
2.3 PDA培养基分离白菜叶际细菌的多样性
将PDA培养基上分离培养所得细菌的DNA样品测序,并进行Blast序列比对(表2)和构建系统发育树(图2)。系统发育树表征了这些菌株间亲缘关系和白菜叶际细菌多样性。PDA培养基上分离获得4株表型差异较明显的细菌,它们分别属肠杆菌属(Enterobacter)和泛菌属(Pantoea),其中肠杆菌属为优势菌,其在所有分离鉴定菌株中所占比例为75.0%,其16S rDNA序列相似性为99%~100%。

表2 PDA培养基分离白菜叶际细菌多样性Table 2 Diversity of bacteria separated by PDA medium from phyllosphere of Brassica chinensis

图2 PDA培养基分离白菜叶际细菌的系统发育树Fig.2 Phylogenetic tree of bacteria separated by PDA medium from phyllosphere of Brassica chinensis
2.4 高氏一号培养基分离白菜叶际细菌的多样性分析
将高氏一号培养基上分离培养所得细菌的DNA样品测序,并进行Blast序列比对(表3)和构建系统发育树(图3)。系统发育树表征了这些菌株间亲缘关系和白菜叶际细菌多样性。高氏一号培养基上分离获得7株表型差异较明显的细菌,它们均属于节杆菌属(Anthrobacter),其16S rDNA序列相似性为99%~100%。

图3 高氏一号培养基分离白菜叶际细菌的系统发育树Fig.3 Phylogenetic tree of bacteria separated by high one medium from phyllosphere of Brassica chinensis

表3 高氏一号培养基分离白菜叶际细菌多样性Table 3 Diversity of bacteria separated by High one medium from phyllosphere of Brassica chinensis
2.5 毒死蜱无机盐培养基分离白菜叶际细菌多样性及毒死蜱降解菌分离鉴定
将含100 mg/L毒死蜱的无机盐培养基上分离培养所得细菌的DNA样品进行测序,并进行Blast序列比对(表4)和构建系统发育树(图4);最后将筛选出的细菌进行毒死蜱降解实验,结果见表4。结果分离得到毒死蜱降解率较高的11株细菌,主要是沙雷氏菌属(Serratia)、假单孢菌属(Pseudomonas)、嗜麦芽窄食单孢菌属(Stenotrophomonas)和肠杆菌属(Enterobacter),其中,假单孢菌属为优势菌,其在所有分离鉴定菌株中所占比例为55%,其16S rDNA序列相似性为 99%~100%。其中对毒死蜱降解率最高的菌株是沙雷氏菌(Serratiaureilytica)M1,其降解率达到52.44%;而恶臭假单胞菌(Pseudomonasputida)M9菌株对毒死蜱的降解率最低,为29.16%。可见,筛选鉴定的11株细菌均表现出对毒死蜱具有良好的降解效果。
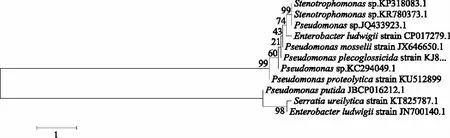
图4 毒死蜱无机盐培养基分离白菜叶际细菌的系统发育树Fig.4 Phylogenetic tree of bacteria separated by inorganic salt medium containing 100 mg/L chlorpyrifos from phyllosphere of Brassica Chinensis

表4 毒死蜱无机盐培养基分离白菜叶际细菌多样性与毒死蜱降解菌分离鉴定Table 4 Diversity of bacteria,isolation and identification of chlorpyrifos-degradating strains by inorganic salt medium containing 100 mg/L chlorpyrifos on phyllosphere of Brassica chinensis
3 结论
本文分别采用LB、PDA、改良高氏一号和含100 mg/L毒死蜱无机盐培养基对白菜叶际细菌进行分离,共获得51株表型差异较明显的细菌,这与系统发育树表征的结果一致;其中LB、PDA、改良高氏一号和含100 mg/L毒死蜱无机盐培养基的细菌浓度分别为1.24×106、1.03×104、2.07×104和2.64×105CFU/g,表明不同培养基筛选到的白菜叶际细菌在数量上存在多样性。进一步分离培养、分子鉴定和系统发育树构建,系统发育树表征了这些菌株间亲缘关系和白菜叶际细菌多样性。结果显示各培养基的优势菌分别是肠杆菌属28%、肠杆菌属75%、节杆菌属100%,假单孢菌属55%。
筛选鉴定到11株具有一定毒死蜱降解活性的菌株,分别属粘质沙雷氏菌属(Serratia)、假单孢菌属(Pseudomonas)、嗜麦芽窄食单孢菌属(Stenotrophomonas)和肠杆菌属(Enterobacter);它们均表现出对毒死蜱具有良好的降解效果,其中沙雷氏菌(Serratiaureilytica)M1菌株对毒死蜱的降解率最高,达到52.44%。不同培养基从白菜叶际分离鉴定的细菌多样性差异明显,从白菜叶际筛选鉴定出毒死蜱降解菌率较高的细菌菌株,为毒死蜱降解菌的降解特性、应用和机理研究提供了基础。

