乳品中的酵母活菌数PMAqPCR检测方法的建立及初步应用
, , , , ,,,,*, ,,,岩松, ,
(1.工商学院粮油食品深加工吉林省高校重点实验室,吉林长春 130507;2.人兽共患病研究教育部重点实验室,吉林大学人兽共患病研究所,吉林大学动物医学学院,吉林长春 130062;3.吉林广泽乳业有限公司,吉林长春 130102)
在乳品行业的发展过程中,微生物发挥了极其重要的作用,尤其在发酵乳中含有大量的益生菌,有利于乳品的消化吸收[1-2],但微生物污染也是影响乳品质量的一个重要因素,乳品常见的污染微生物为细菌、酵母菌与霉菌,微生物超标会导致乳品变质、腐败、胀袋[3],而酵母菌污染是导致乳品变质胀袋的主要原因[4]。频发的乳品安全事件不仅影响了消费者健康,还使外资乳品企业有机可乘占领国内市场,严重制约了我国乳品行业的发展[5]。为了确保乳品质量合格,国标中明确规定了乳品中微生物限量标准[4]。目前,乳品加工企业最常用微生物检测方法有微生物培养法(平板计数法)、ATP 生物发光法和仪器法等,但各技术均有不足。如平板计数法虽操作简便,成本低廉,但耗时太长,易漏检 VBNC 状态微生物[6];流式细胞仪法。虽准确快速,但仪器昂贵,检测成本高[4-7]。近年来,EMA/PMA 结合 qPCR 检测复杂环境样品中活菌的方法得到了一定的发展[8]。有研究利用PMA-qPCR检测实现了区分检测排放的生活废水中的金黄色葡萄球菌活菌数[9]。另外,有研究利用PMA-qPCR检测环境样品中的活钩虫卵的数量[10]。本研究目的是开发一种灵敏的PMA-qPCR法,可有效区分死菌与活菌,定量检测存在于培养基中的活的以及活的但不可培养的(VBNC)酵母菌[11]。
叠氮溴化丙锭(propidiummonoazide,PMA)是可以进入细胞膜损伤的死亡酵母菌中,与DNA双链发生共价交联反应的染料,结合后能抑制死菌DNA的PCR扩增,而活菌完整的细胞膜可阻止PMA进入细胞内[7]。优化PMA处理条件,建立乳品中酵母菌的PMA-qPCR活菌检测方法,再结合荧光定量PCR确定国标中酵母菌总数最大限量值所对应的Ct值范围[7],PMA-qPCR法将实时荧光定量PCR的快速和高度特异性与PMA对细胞膜损伤酵母菌的选择透过性结合起来,降低对酵母活菌总数检测的干扰和假阳性。同时与传统国标平板计数法相比[7],更加快速高效。从污染菌很少的样品中快速富集,以集菌方法代替增菌培养,结合实时荧光检测,能够缩短检验时间,提高检测效率[12]。该方法用于判断乳品中的活菌总数是否超标,为乳品的生产加工提供有效的活菌监控方法,以确保乳品的质量与安全。针对以上问题,本实验从广泽乳业的乳品样品中分离污染的酵母菌,旨在建立能区别死菌和活菌的快速PMA-qPCR检测方法。
1 材料与方法
1.1 材料与仪器
乳品 均来自广泽乳业商品巴氏乳;叠氮溴化丙锭(PMA) Biotium公司;2×PCR预混酶Easy Taq Master Mix 北京全式金公司;2×SYBR荧光定量PCR预混酶Fast Start Universal SYBR Green Master(Rox) Roche公司;酵母菌基因组DNA提取试剂盒 天根生物技术有限公司;胶回收试剂盒 Takara公司;卡那霉素 北京鼎国昌盛生物技术有限责任公司;菌株:马克思克鲁维酵母菌、库德里阿兹威毕赤酵母菌、热带假丝酵母菌 由本实验室保藏。
650 W钨丝灯 OSRAM公司;ABI7500荧光定量PCR仪 美国应用生物系统公司;紫外凝胶成像系统 UVP公司。
1.2 实验方法
1.2.1 酵母菌活菌悬液和死菌悬液的制备及国标定量检测 从YPD平板挑取酵母菌单菌落,接种于5 mL的YPD液体培养基中[7],分别加入5 μL卡那霉素和氨苄青霉素,220 r/min振摇,28 ℃恒温培养23~28 h,至OD600为0.5。
酵母菌定量检测在国标GB4789.2-2016基础上进行改良,即在平皿中加入1 mL稀释后的不同梯度稀释的菌液和11 μL卡那霉素后,倒入固体培养基,轻微晃动平板至混合均匀,静置30 min至平板凝固,28 ℃培养48~72 h。此后操作均按照此改良国标法对三种酵母菌进行平板计数。
采用改良后平板法计算活菌悬液浓度。将活菌悬液8000 r/min离心10 min,按照计数结果,将酵母菌以无菌生理盐水重悬至密度约1×103CFU/mL后,沸水浴10 min,制备死菌悬液,冷却到室温备用。
1.2.2 PMA最佳工作浓度的选择 设置PMA 6个浓度梯度1、3、5、7、9 μg/mL分别加入1 mL数量级为1×103CFU/mL的死菌悬液中[7],涡旋振荡器振荡混匀避光孵育10 min后,置于冰上用650 W灯泡充分曝光10 min,煮沸10 min,以处理后的菌液为模板进行qPCR,选取没有扩增曲线的最小抑制浓度[4],确定PMA的最佳工作浓度。
1.2.3 PMA-qPCR方法的建立
1.2.3.1 荧光定量通用引物设计 Primer Premier 5.0设计酵母26SrDNA荧光定量通用引物,Y3:5′-CGAGTTGTTTGGGAATGC-3′,Y4:5′-ACTTGTTC GCTATCGGTCTC-3′,引物由吉林库美生物技术有限公司合成,扩增产物长度90 bp。提取三种酵母菌DNA为模板进行qPCR,获得扩增目的条带,进行电泳。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,57 ℃退火40 s,40个循环。在每一循环的退火阶段收集荧光,实时检测并记录荧光信号强度,得到熔解曲线。
1.2.3.2 pMD-18T-26S标准质粒的构建 按照基因组提取试剂盒说明书提取酵母菌DNA,以此为模板进行PCR,产物进行1%琼脂糖凝胶电泳,用胶回收试剂盒对PCR产物进行胶回收。按照pMD-18T Vector使用说明书,16 ℃水浴反应连接过夜[13]。将连接产物转化进E.coliDH5α(DE3)感受态细胞后,取50 μL在含有氨苄青霉素抗性的琼脂培养基上反复涂布至均匀,37 ℃倒置培养12 h。挑取单个圆润明亮的白色菌落,于5 mL LB培养基中,37 ℃恒温180 r/min振摇12 h[13]。菌液PCR法鉴定正确的菌液进行测序,确认载体中插入片段的长度大小,同时送往生物科技公司进行克隆测序,进行序列比对。
1.2.3.3 荧光定量标准曲线的建立 按照质粒提取试剂盒的说明提取质粒后,检测浓度后计算拷贝数,用无菌生理盐水梯度稀释至1×102~1×109。以此为模板进行qPCR检测,每个数量级三个重复孔,取平均值,以pMD-18T-26S拷贝数对数与Ct值为坐标轴,建立标准曲线[13]。
1.2.3.4 PMA对qPCR的干扰性验证 对经过PMA处理和未处理的1×103CFU/mL的酵母菌分别进行qPCR,对比两组样品的溶解曲线与扩增曲线。
1.2.4 乳品中酵母菌PMA-qPCR活菌检测方法评价
1.2.4.1 灵敏度检测 取溶解曲线呈单峰且扩增曲线良好的酵母菌最小检测浓度为酵母最低检测浓度,确定 PMA-qPCR法对酵母菌个数的最低检测限。
1.2.4.2 重复性检测 按照1.2.3.3中的qPCR体系进行组间稳定性测试,据前述PCR反应条件进行荧光PCR检测。在不同的时间内分别做3次,计算扩增循环数(Ct值)的标准差与CV值[14]。
1.2.4.3 PMA-qPCR样本的前处理及加标回收实验 量取50 mL乳品于离心管中,经8000 r/min高速离心15 min[4],弃掉脂肪,重复两次,将处理过的乳品稀释液于离心管中分装,65 ℃放置2 h灭菌后[15],将乳品稀释液密封4 ℃保存。取处理好的乳品稀释液各1 mL于40个离心管中,随机添加酵母活菌与添加热致死菌[7]模拟加标乳品,编号1~40。加标乳品经PMA处理后进行qPCR,每个样本三个重复孔。将PMA-qPCR结果与改良国标计数对比。
1.2.5 实际乳品样品酵母总数PMA-qPCR检测 对从广泽乳业采集的不同批次乳品样本,采用扩大检测体积10倍并离心的方法检测浓度,并随机取一部分置于37 ℃增菌培养[16],共80个样品,编号1~80,对PMA-qPCR检测结果进行分析。
1.3 数据统计分析
使用Excel对原始数据进行初步分析,使用SPSS 22.0计算标准偏差σ来量度每组数据分布的分散程度[17]。
2 结果与分析
2.1 目的条带的扩增
用Y3和Y4引物扩增的三株酵母菌的DNA片段大小在90~100 bp处均有条带,与预期结果一致,阴性对照无条带(图1)。回收产物经测序检验结果正确,证明为目的片段。
2.2 PMA最佳工作浓度的选择
根据qPCR结果,当PMA浓度为1、3、5 μg/mL时,熔解曲线正常且均有扩增曲线(图2),说明死菌DNA未被完全结合,扩增时仍能造成假阳性;当PMA浓度为7、9 μg/mL时均没有扩增曲线(图3),说明死菌DNA被完全结合,DNA扩增被抑制,由此可得,PMA浓度为7 μg/mL时,是可以完全结合1×103CFU的酵母菌的最低抑制浓度,取7 μg/mL为最佳PMA工作浓度。

图2 熔解曲线Fig.2 Melt curve

图3 扩增曲线Fig.3 Amplification curve注:1:1 μg/mL;2:3 μg/mL;3:5 μg/mL。
2.3 PMA对qPCR的干扰性验证
对经过PMA处理和未处理的1×103CFU/mL的酵母菌分别进行qPCR,扩增曲线均正常(图4);PMA处理组Ct值为36.64±0.52,略大于无PMA组的Ct值35.99±0.53,但二者Ct值基本一致,证明PMA对qPCR的干扰极小。
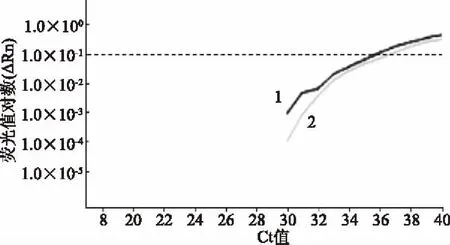
图4 扩增曲线Fig.4 Amplification plot注:1:无PMA组;2:PMA处理组。
2.4 PMA-qPCR标准曲线的建立
检测Ct值与重组质粒pMD-18T-26S拷贝数对数线性关系较好,熔解曲线呈单峰,特异性良好(图5)。标准曲线为y=-4.7564x+50.94,R2为0.9952,线性关系良好,检测范围为:1×103~1×109CFU/mL。
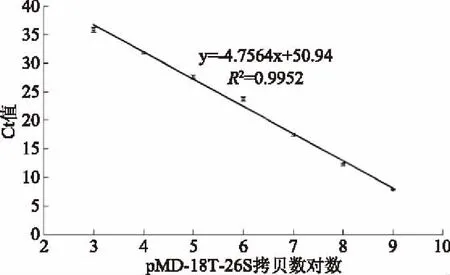
图5 标准曲线Fig.5 The standard curve
2.5 样本处理分析
PMA-qPCR检测浓缩样品与未浓缩样品酵母菌数量,浓缩组的Ct值略高于未浓缩组的Ct值,分析原因是浓缩操作过程中有少量酵母菌损失所致;随着酵母菌浓度数量级的增大,两组样品的变异系数逐渐减小,各组变异系数差异均小于10%(表1)。经浓缩策略处理,该方法灵敏度提高,方法实际检测限最低可达1×102CFU/mL酵母菌。
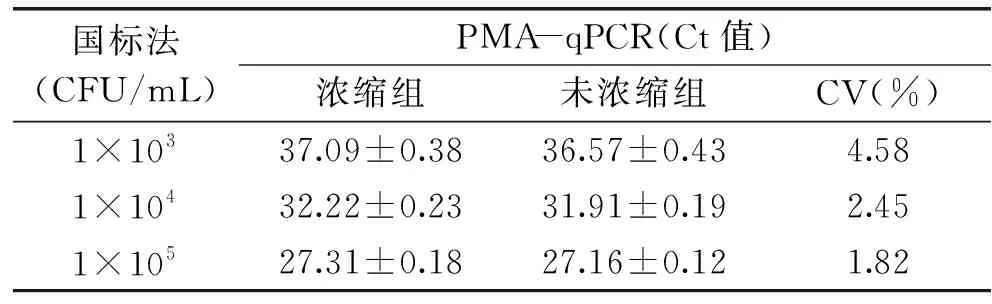
表1 浓缩与未浓缩样品结果比对Table 1 Results of concentrated and unconcentrated samples
2.6 乳品PMA-qPCR检测方法灵敏度分析
在酵母浓度为1×103CFU/mL时,溶解曲线呈单峰,且特异性良好,最低检测范围为1×103CFU/mL,检测范围为对应1×103~1×109CFU/mL,Ct值范围为8.13±0.11~36.67±0.43。
2.7 乳品PMA-qPCR检测方法重复性检验
对1×103~1×105数量级的酵母菌分别进行三次qPCR检测,对三次结果进行分析,计算平均值、标准差和变异系数,变异系数均小于10%,证明该方法重复性良好(表2)。

表2 重复性检验Table 2 Detection of duplicability
2.8 加标回收结果
乳品中酵母菌浓度分别在1×103~1×104CFU/mL范围内和在1×104~1×105CFU/mL范围内时,国标法与PMA-qPCR法检测结果重合率为分别为93.75%和95.00%(表3)。分析可得,当乳品中酵母总数处于1×104~1×105的数量级时相比较于1×103~1×104的数量级,PMA-qPCR法与改良国标法检测结果越接近,结果更加准确可信。

表3 乳品加标回收结果Table 3 Determination for dairy products
2.9 实际样品酵母菌数量检测
检测市售样品和增菌培养样品共80份,其中检测市售广泽乳业乳品20份中7份样品未检出酵母菌,且13份检出样品酵母菌数量均在国标规定范围内;检测增菌样品60份,酵母浓度多处于1×102~1×104CFU/mL,增菌培养后的样品浓缩后PMA-qPCR法检测结果与国标法重合率约为93.33%以上(表4),实际样本检测总耗时6~7 h。

表4 乳品样品检测结果Table 4 Test results of milk samples
3 讨论
3.1 运用PMA去除热损伤酵母菌的意义
自Nocker等验证了PMA可以替代EMA从样本中准确计数活细胞后,PMA与分子生物学方法结合技术已被广泛应用于环境和食品等多个领域的微生物检测研究[4,18]。如果只采用qPCR法,死亡酵母菌的DNA稳定存在,同样被qPCR检测[19],本实验应用PMA结合死菌的DNA而使其不能进行qPCR扩增,可避免假阳性情况的出现。本方法实现了对复杂乳品样本中损伤酵母菌DNA的有效去除,降低对酵母活菌总数检测的干扰,降低假阳性检测结果出现的可能性[19]。
首先需要确定酵母菌浓度在不同数量级时,所需的PMA最低抑制浓度。有研究表明,当酵母菌浓度为1×107CFU/mL时,所需PMA最低抑制浓度为15 μg/mL[4],本方法为了尽可能达到酵母菌数量国标规定检测限1×102CFU/mL,选取酵母菌浓度1×103CFU/mL时,进行PMA工作浓度的优化,确定PMA最低抑制浓度为7 μg/mL,作为本方法的最佳工作条件。但也有研究表明,由于PMA会轻微抑制PCR反应,传统上定量分析PCR采用终点法存在缺陷,而实时技术可以弥补其缺陷,可以实时地在PCR反应扩增中进行检测,只要少量的DNA模板,荧光信号经过连续的分析,就会扩增得到曲线[20]。
3.2 酵母DNA提取体系的优化
虽然根据郭冬琴等[21]的研究结果表明,荧光定量检测乳制品中的酵母菌不受食品基质的影响。但提取高质量的DNA作为模板是进行分子鉴定的基础,所以让乳品中的酵母菌DNA充分暴露是很关键的一步。常用的方法有石英砂或玻璃珠破碎和超声破碎酵母菌体[22],本方法采用最原始有效的菌体煮沸破碎法,将PMA处理后的实际样品煮沸10 min,使DNA充分暴露后再电泳等改良措施提高DNA的提取数量和质量。既不需要消耗太多成本,又可以达到良好的检测效果。
4 结论
建立了PMA-qPCR定量检测乳品中酵母活菌总数的技术。确定酵母菌为1×103CFU/mL时,PMA最佳工作浓度为7 μg/mL。将样品煮沸10 min,使酵母菌DNA充分暴露,通过qPCR使序列充分扩增,得到准确的Ct值36.67±0.43。通过浓缩实际乳品样本降低对酵母菌总数的最低检测限,最低检测限可达到1×102CFU/mL,与国标法重合率高于93.33%。

