响应面优化酶法辅助提取山楂果胶及其体外抗氧化和抗糖化活性
,,,, ,,,*
(1.辽宁大学轻型产业学院,辽宁省食品生物加工工程技术研究中心,沈阳市食品生物加工与质量控制技术重点实验室,辽宁沈阳 110036;2.辽宁省林业科学研究院,辽宁沈阳 110036)
果胶是从高等植物细胞壁中提取的一种高分子天然多糖,主要由α-1,4糖苷键连接的17种不同的单糖构成[1]。作为食品添加剂,果胶被广泛应用于糖果、冰淇淋以及焙烤食品,起到胶凝、改善质构和稳定的作用[2];作为一种天然的水溶性膳食纤维,应用于保健食品和药品中,起到润肠通便、清除体内重金属等作用[3];国外在日化产品中添加少量的果胶,具有良好持水性以及抗辐射的功能[4]。此外,通过对果胶的某些特征基团进行改性,改变其胶凝性,提高生物相容性,使其更好地应用于医疗方面[5-6]。近年来,山楂果胶及其低聚糖在生理活性及作用机制的研究方面取得了重大进展。研究发现,山楂果胶具有显著的体内外抗氧化活性[7],能够有效清除自由基,此外还具有抗肿瘤抗炎作用[8],因此在功能食品等领域具有良好的应用前景。另有研究表明,果胶经过降解产生的寡糖,也具有改善脂代谢、抗氧化以及抗癌等生理活性[8-10]。
山楂是我国特有的药果兼用树种,具有重要的药用价值[11]。我国的山楂资源丰富,主产于山东、河北、辽宁等地,经济物廉,新鲜山楂中果胶含量高达6.4%[12]。因此,利用山楂丰富的果胶资源提高其分离提取和利用率,对于减少对果胶进口的依赖、提高经济和社会效益具有重要的意义。酶法提取果胶是在微生物法的基础上,通过微生物发酵提取特定的多糖降解酶,如纤维素酶、半纤维素酶、果胶酶等降解植物细胞壁,得到果胶[13]。木聚糖酶是植物细胞壁中半纤维素主要成分木聚糖的主要降解酶,能够有效的降解木聚糖,从而释放水溶性的果胶成分,并且该酶对果胶没有降解活性,因此能够获得更多的果胶[14]。此方法与其他方法相比,具有原料利用率高、作用条件温和、能耗低以及绿色环保的优点[15]。
因此,本实验采用木聚糖酶法提取山楂果胶,在对加酶量、提取温度、pH以及提取时间进行单因素实验的基础上,通过响应面设计确定最优的酶法提取山楂果胶工艺参数,优化木聚糖酶提取果胶的工艺,并对提取的果胶进行体外抗氧化和抗糖化活性研究,以期为山楂的精深加工利用,提高其经济转化价值提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
山楂(大金星) 产自山西,经去蒂、去核、切片、50 ℃烘箱干燥,粉碎(80目)后备用;木聚糖酶(X2753-10G,2500 U/g,绿色木霉)、牛血清白蛋白(bovine serum albumin,BSA)、丙酮醛(methyglyoxal,MGO)、氨基胍(aminoguanidine)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazxyl,DPPH)、氯化硝基四氮唑兰(nitroblue tetrazolium,NBT)、还原型辅酶Ⅱ(NADPH) 均为美国Sigma公司;氢氧化钠、邻二氮菲、半乳糖醛酸、果糖 天津市大茂化学试剂厂;无水乙醇、维生素C(VC) 沈阳市新化试剂厂;其他试剂 国产分析纯。
HH.S21-6-S型电热恒温水浴锅 上海龙跃仪器设备有限公司;F-4500荧光分光光度计 美国Perin公司;H/T12MM型台式高速离心机 湖南赫西仪器装备有限公司;PHSJ-4F实验室pH计 上海仪电科学仪器股份有限公司;RE-2000A旋转蒸发器 荣阳市科瑞仪器有限公司;SHB-III循环水式多用真空泵 巩义市科瑞仪器有限公司;DHG-9030A型电热恒温鼓风干燥箱 巩义市科瑞仪器有限公司;752型紫外可见分光光度计 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 山楂果胶的提取 参照Wikiear等[14]的方法,略有修改。称取一定量的干燥山楂粉(含水量19.8%±0.2%),按料液比1∶15 (g/mL)加入蒸馏水,取一定量木聚糖酶溶解于0.2 mol/L磷酸缓冲液(pH6.0),按相应比例加入山楂溶液中,用1 mol/L NaOH溶液调节溶剂至一定pH、在一定温度以及提取时间下充分搅拌(200 r/min)提取。将提取液离心(4000 r/min,10 min)回收上清液,浓缩至原体积的一半,在预实验的基础上,边搅拌边缓慢加入2倍体积的95%乙醇,静置4 h后离心(4000 r/min,15 min)。沉淀依次用95%乙醇、无水乙醇洗脱[16],在50 ℃烘箱中干燥至恒重,所有实验平行重复三次。
1.2.2 单因素实验 以上述条件为基础,考察木聚糖酶添加量(60、65、70、75、80 U/g)、酶解温度(40、45、50、55、60 ℃)、溶剂pH(6.0、6.5、7.0、7.5、8.0)、酶解时间(2.0、2.5、3.0、3.5、4.0 h)对山楂果胶得率的影响。各因素固定水平值:加酶量70 U/g、溶液pH6.0、酶解温度50 ℃、酶解时间3.0 h。
1.2.3 响应面试验设计 在单因素试验基础之上,考虑到木聚糖酶自身的最适宜pH,以及pH>7时对果胶颜色的影响,选取木聚糖酶添加量、酶解温度、酶解时间为自变量,以果胶得率为响应值,设计三因素三水平响应面分析试验,以果胶得率作为响应指标,优化酶法提取山楂果胶的提取工艺,具体因素与水平设计见表1。

表1 响应面分析法因素及水平表Table 1 Factors and levels of response surface methodology
1.2.4 果胶得率的计算 果胶得率按公式(1)进行计算[17]:

式(1)
1.2.5 体外抗氧化能力测定
1.2.5.1 DPPH·清除活性的测定 DPPH·清除活性的测定参照Chen等[17]报道的方法进行,以VC作为阳性对照,以蒸馏水代替山楂果胶五糖作为空白对照实验,以无水乙醇代替DPPH·溶液作为样品干扰实验,按式(2)计算DPPH·清除率:

式(2)
式中:A0为空白对照实验(水代替果胶五糖溶液)的吸光度;A1为样品实验的吸光度。
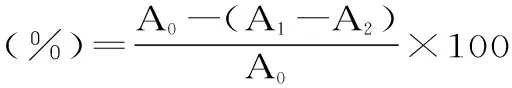
式(3)
式中:A0为空白对照实验(水代替果胶五糖溶液)的吸光度;A1为样品实验的吸光度;A2为样品干扰实验(0.2 mol/L pH7.4磷酸盐缓冲液代替NBT溶液的吸光度。
1.2.5.3 ·OH清除活性的测定 ·OH清除活性的测定参照周思思等[18]和金鸣等[19]报道的方法,以VC作为阳性对照,以PBS缓冲液代替山楂果胶五糖溶液作为空白对照实验,以PBS缓冲液代替H2O2作为样品干扰实验,按式(4)计算·OH清除率:

式(4)
式中:A0为空白对照实验(水代替果胶五糖溶液)的吸光度;A1为样品的吸光度;A2为水代替H2O2和山楂果胶五糖溶液的吸光度。
1.2.6 抗糖化活性分析 将提取的果胶溶液分别与果糖或者MGO溶液混合,按照范智益等[20]的方法建立BSA-果糖和BSA-MGO模拟反应体系,同质量浓度的氨基胍替代果胶作为阳性对照,磷酸缓冲液替代果胶溶液作为空白对照,磷酸缓冲液替代果糖溶液(或磷酸缓冲液替代MGO)作为BSA单独孵育组和BSA-果胶共孵育组。将混合以后的样品置于培养箱中37 ℃孵育6 d后,在激发波长370 nm和发射波长440 nm条件下,测定样品的荧光强度,并计算果胶对荧光性AGEs生成的抑制率。
1.3 数据处理
所有实验均进行三次重复,结果以平均数±标准偏差表示。采用单因素Duncan法进行多重比较,以DPS v7.55软件进行显著性分析。显著水平为p<0.05。
2 结果与分析
2.1 单因素实验结果
2.1.1 木聚糖酶添加量对果胶得率的影响 由图1可知,随着木聚糖酶添加量的增加,果胶得率逐渐提高,当加酶量为70 U/g时,果胶得率达到峰值,随着木聚糖酶添加量的继续增加果胶得率略有下降。由于果胶实质是由半乳糖醛酸组成的多糖,同纤维素共同组成细胞壁,经酶的降解作用后,底物充分与酶的活性中心结合,将山楂中果胶释放出来,当加酶量达到一定程度时,酶解程度已趋于最大化,该酶系中可能存在其他能够水解果胶的鼠李糖苷酶,导致果胶分子链水解,在过滤洗涤时果胶损失,得率下降,这与宋珊珊[21]和孙玉林等[22]从不同物质中提取果胶的结果一致。因此,从实验结果来看,木聚糖酶的最适添加量应为70 U/g。

图1 木聚糖酶添加量对果胶得率的影响Fig.1 Effect of the amount of xylanase on the yieid of pectin
2.1.2 酶解温度对果胶得率的影响 由图2可知,随着温度的升高,果胶得率快速升高,且在50 ℃时,达到峰值,随后温度的增加导致果胶得率下降。由于酶作为具有生物催化功能的高分子物质,其催化特性受到温度的影响很大,温度升高有助于增强果胶溶出的传质动力,增加果胶得率,但温度高于最适宜温度时,会使酶的活性下降或丧失,导致果胶得率下降。因此,最适酶解温度为50 ℃。

图2 酶解温度对果胶得率的影响Fig.2 Effect of enzymatic temperature on the yield of pectin
2.1.3 溶剂pH对果胶得率的影响 由图3可知,随着提取液pH的增大,果胶得率先缓慢增加然后迅速减小,且在pH为7.0时,达到峰值,当pH继续增大到7.5时,果胶得率略有下降。由于山楂自身的酸度极高,酶解过程中溶剂的pH过低,会导致果胶的水解过度或果胶裂解等副反应的发生。此外酶本身的稳定性也受到反应环境影响,低于或高于酶的最适pH,都会影响其稳定性,进而使酶遭受不可逆破坏,使酶的活性降低。且在实验过程中发现,pH越大,表现为提取液的颜色越深。综合以上因素,木聚糖酶提取山楂果胶的酶解pH为7.0时,更有利于提高山楂原果胶的转化率。
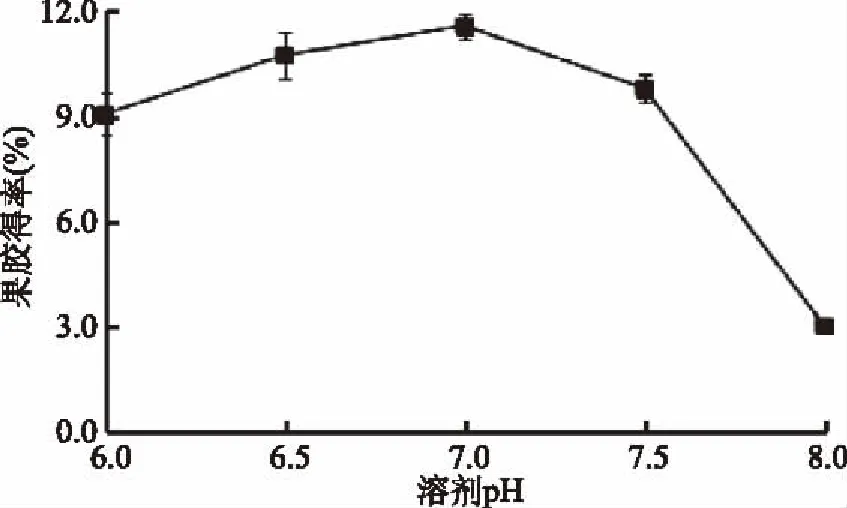
图3 溶剂pH对果胶得率的影响Fig.3 Effect of solvent pH on the yield of pectin
2.1.4 酶解时间对果胶得率的影响 由图4可知,酶解时间在2.5~3.0 h时,果胶得率随酶解时间的增加迅速增加,在3.0 h处达到峰值;当酶解时间在3.0~4.0 h时,果胶得率缓慢地下降。由于木聚糖酶是一种水解酶,其参与的反应均为可逆反应,过长的反应时间导致果胶水解占主导,反而降低果胶得率。因此,酶提果胶大大缩短了反应时间,其最适酶解时间为3.0 h。

图4 酶解时间对果胶得率的影响Fig.4 Effect of enzymolysis time on the yield of pectin
2.2 响应面试验结果
根据单因素实验结果设计Box-benhnken试验,运用Design-Expert 6.0软件进行二次多元回归拟合,得二次多元回归方程:
Y=16.69-0.43A+0.3B-0.5C-0.25AB-0.12AC-0.19BC-1.06A2-0.57B2-1.25C2
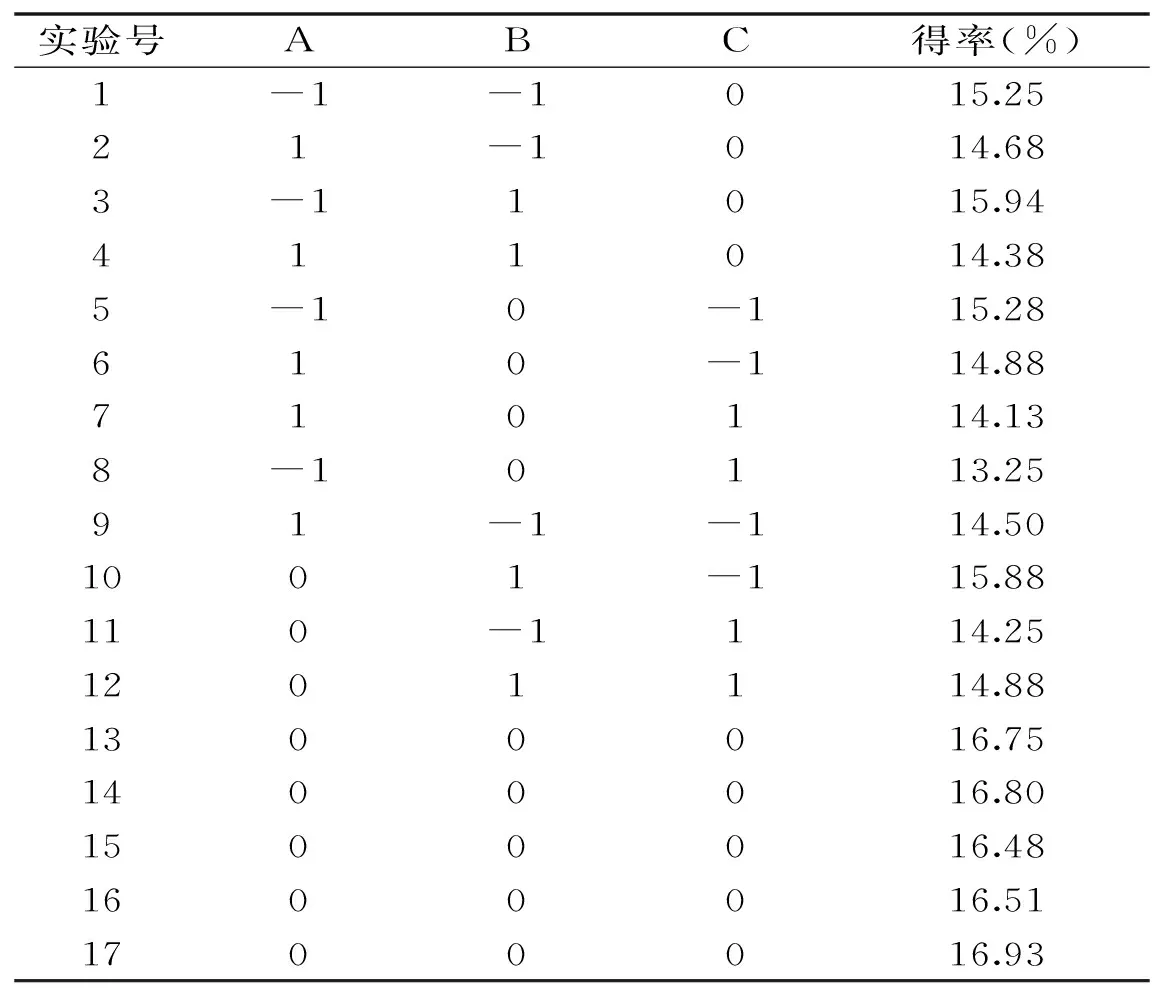
表2 山楂果胶提取的响应面试验设计与结果Table 2 Box-Behnken design with experimental results of haw pectin
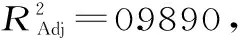

表3 方差分析Table 3 Analysis of varianc
根据回归方程的一次项自变量系数可知,各单因素对果胶得率的影响大小顺序为C>A>B。
由图5~图7可知,3D响应面图及等高线图可以直观地反映木聚糖酶添加量、酶解温度、酶解时间两两交互作用与响应值果胶得率的关系,固定其中1个变量为零水平,响应值随另两变量的改变而变化。曲面的弯曲程度、等高线的形状均能表示两因素之间的相互作用的显著程度[23]。越趋近于椭圆形表示两因素交互作用越显著,而圆形表示其交互作用不显著。等高线的疏密程度表示响应值变化的快慢。等高线中的最小椭圆的中心点即是响应面的最高点。图5~图7的结果与方差分析一致,对于果胶的提取得率,木聚糖酶添加量、酶解温度以及酶解时间之间的两两交互作用均不显著。
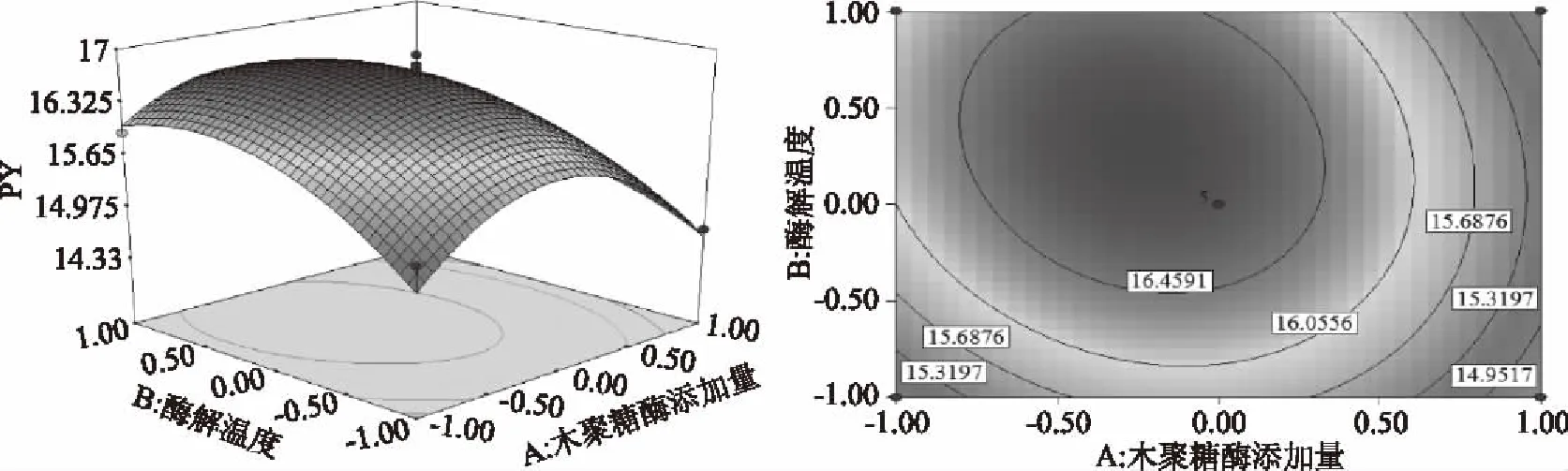
图5 木聚糖酶添加量和酶解温度对果胶得率的等高线图和响应面图Fig.5 Contour polts and response surface of response of xylanase addition and enzymatic temperature on the yield of pectin

图6 木聚糖酶添加量和酶解时间对果胶得率的等高线图和响应面图Fig.6 Contour polts and response surface of response of xylanase addition and enzymolysis time on the yield of pectin

图7 酶解温度和酶解时间对果胶得率的响应面和等高线图Fig.7 Contour polts and response surface of response of enzymatic temperature and enzymolysis time on the yield of pectin
2.3 最佳提取工艺验证
通过模型预测酶法提取山楂果胶的最佳工艺条件为木聚糖酶添加量为69.7 U/g,酶解温度50.4 ℃,酶解时间2.8 h,山楂果胶得率的预测值为16.9%。
考虑到实际操作条件的局限性,最终的优化条件为木聚糖酶添加量为70 U/g,酶解温度50.5 ℃,酶解时间3.0 h,在此条件下进行三次平行验证,得率为16.8%±0.2%,与理论预测值较接近,说明用该模型对山楂果胶的提取进行工艺优化具有一定的实际可操作性,该结果合理可靠。本研究中酶法果胶得率为16.8%,远远大于本课题组之前的冷水法(10.3%)和热水法(8.7%)[24]。
2.4 酶提法果胶的体外抗氧化能力

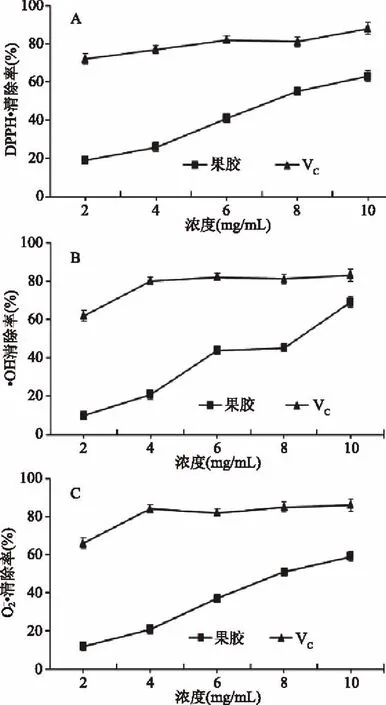
图8 山楂果胶和VC对DPPH·(A)、·OH(B)和的清除作用Fig.8 Effects of remove DPPH free radicals(A),hydroxyl free radicals(B)and free radicals of haw pectic polysaccharides and VC
研究表明,果胶的生理活性与糖组成有直接关系,其体外抗氧化活性与果胶分子中半乳糖醛酸含量成正相关[25-26],但是总的体外抗氧化活性偏低,这可能与果胶分子中单糖组成有关,具体的原因需进一步研究[27-28]。
2.5 酶提法果胶的体外抗糖化能力
在非酶促条件下,蛋白质等含游离氨基的生物分子与葡萄糖和果糖等还原糖的羰基发生一系列反应,最终生成稳定的晚期糖基化终末产物(advanced glycation end products,AGEs),该反应叫做非酶糖基化反应[29]。AGEs在体内的长期积累能诱发多种慢性疾病,例如糖尿病,阿兹海默综合征,老年性痴呆症以及动脉粥样硬化等,严重威胁人类的健康[29]。
酶法提取的山楂果胶分别在BSA-果糖(A)和BSA-MGO(B)模拟反应体系下的糖化抑制率如图9所示。在BSA-果糖模拟反应体系下,当果胶浓度从20 μg/mL增加到100 μg/mL时,其糖化抑制率从20.9%增加到55.4%,相同浓度下,从60 μg/mL开始果胶的糖基化抑制率高于阳性对照氨基胍的糖化抑制率。而在BSA-MGO(B)模拟反应体系下,虽然果胶的糖化抑制率随着浓度的增加从10.7%增加到了55.9%,但是相同浓度下其糖化抑制率始终低于阳性对照氨基胍的糖化抑制率。
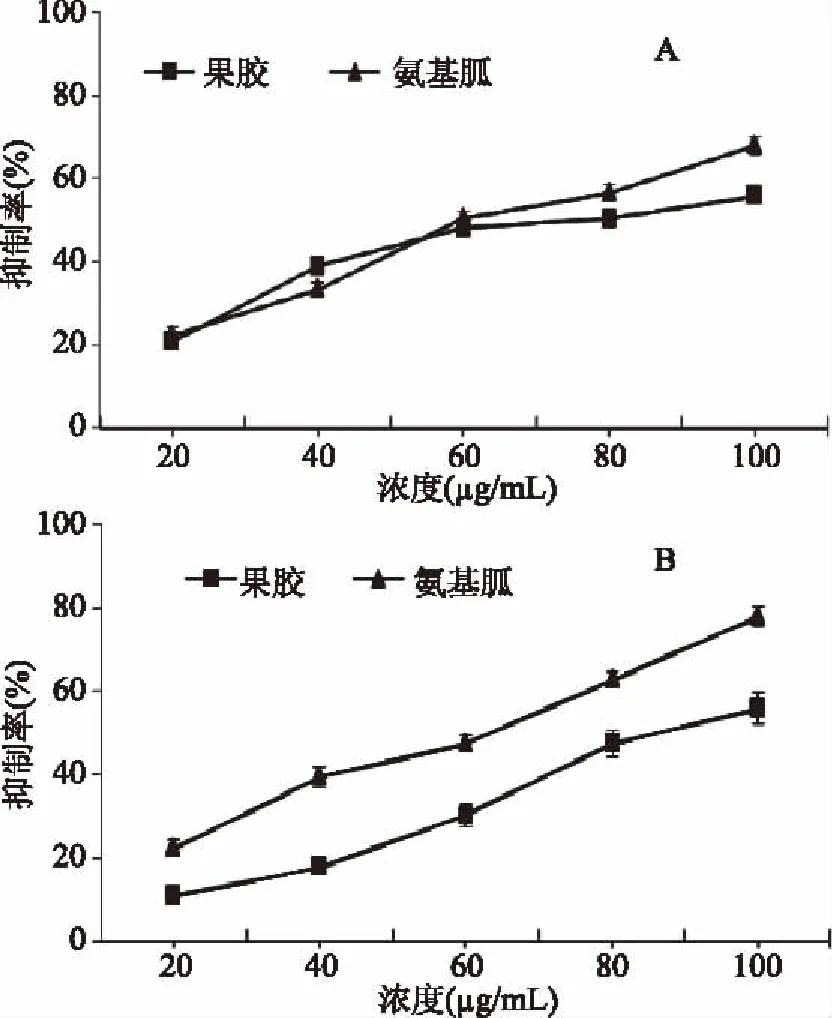
图9 山楂果胶以及阳性对照氨基胍在BSA-果糖(A)和BSA-MGO(B)模拟反应体系下的糖化抑制率Fig.9 Glycation inhibition rates of aminoguanidine and haw pectin in BSA-fructose model(A)and BSA-MGO model(B)
3 结论

综合本实验结果,响应面优化酶法提取山楂果胶,与传统冷水法(10.3%)和热水法(8.7%)得到的果胶相比,大大提高了果胶得率。本研究成果为以山楂为原料的食疗保健食品的开发提供了理论基础和科学依据,对提高我国山楂的精深加工利用效率,以及天然食源性抗氧化剂的开发,均具有巨大的经济效益和社会效益。

