武夷岩茶赤叶斑病的病原菌鉴定
武广珩 ,王东晓 , 傅仙玉 , 赵家儒 ,聂云春 ,李国平
(1.武夷学院生态与资源工程学院,武夷山 354300; 2.福建省生态产业绿色技术重点实验室,武夷山 354300;3.武夷学院茶与食品学院,武夷山 354300)
茶赤叶斑病是茶园成叶、老叶常见病害之一,我国各主要产茶省均有报道,发生普遍,局部地区发生严重[1]。该病的发生特点是病斑面积大,传播速度快,严重干扰茶树正常的生理代谢,特别是光合作用,大大减少了树体内有机物质的积累[2]。茶赤叶斑病已发现致病菌为茶生叶点霉(Phyllostictatheicola),属半知菌亚门真菌,且对不同茶树品种侵害存在差异[3]。近年来,对于茶赤叶斑病的病原报道较少,尚未发现其他致病菌。本文通过对引起武夷岩茶赤叶斑病的病原菌进行鉴定、形态观察和rDNA-ITS序列分析,以期确定茶赤叶斑病的病原菌,为该病害的防治提供治理依据。
1 材料与方法
1.1 症状观察及病菌采集
2017年7月至8月,在福建省南平市武夷学院茶学系实验茶园内观察发现茶赤叶斑病,记录并拍下茶赤叶斑病的病害症状,采集病害严重且仍有韧性的水仙品种茶叶。
1.2 病原菌的分离培养
参考张小芳等[4]用无菌手术刀切取叶片病健交界部位5 mm×5 mm的小片组织,先用75% 的酒精浸泡45 s,再用无菌水重复冲洗3次后,无菌吸水纸吸干水分。于无菌研钵中,加入适量无菌水及无菌石英砂进行研磨,组织研磨后静置10 min。用接种环蘸取研磨静置溶液,分别接种于纯PDA培养基、PDA茶汁液培养基(茶汁液为采摘新鲜茶叶150 g剪碎,加入1 000 mL蒸馏水煮沸30 min后过滤得到的滤液[5];其中,纯PDA培养基未加入茶汁,PDA茶汁液培养基则是吸取100μL、150 g/L茶汁液涂布在PDA培养基上)。将培养皿倒置于温度为25℃、光照为4 800 Lux的光照培养箱中进行培养。
1.3 病原菌纯化
培养72 h,挑取生长旺盛的菌丝进行菌种划线培养,待菌丝生长较多时再挑取菌丝点在平板中央,让其长满整个平板,置4℃冰箱中保存备用。
1.4 致病性测定
1.4.1 离体叶片接种
根据韦洁玲之前报道的接种方法[6],并做部分修改。在产孢茂密的培养基中加入适量无菌水清洗,将整皿的分生孢子洗下,加入0.2%的吐温20℃,摇匀,过滤得到孢子悬浮液,血球计数板计数后,用无菌水调整为1×108个/mL,制备成供试孢子悬浮液。摘取健康茶树新梢的嫩叶、近平展着生的二三叶[7],用75%的酒精擦拭消毒,用无菌水冲洗后晾干。将茶叶置于PDA培养基上,用接种针蘸取孢子悬浮液于茶叶上分别均匀打3~4个孔完成接种,接种8片茶叶。以接种无菌水为对照。接种完成后,置于25℃、4 800 Lux的光照培养箱中进行培养,定期观察并记录发病情况。
1.4.2 染色与拍照
按照接种后天数收集接种病菌的叶片置于Trypan Blue染液 (20 mL乙醇,10 mL苯酚,10 mL超纯水,10 mL 83% 乳酸和10 mg台盼蓝粉末)中煮沸15~20 min;染色后的叶片用水合三氯乙醛(2.5 g/mL)过夜脱色至半透明状;用超纯水洗涤后用50%甘油保存[8]。使用显微镜观察拍照。
1.5 病原菌形态学观察
用无菌接种环挑取平板上纯化后的菌体制片,在正置荧光显微镜(Leica DM2500)下观察菌丝和孢子的形态特征,并进行拍摄。根据病原菌的形态及菌落形成特征,参考相关资料进行病原菌鉴定。
1.6 病原菌分子鉴定
1.6.1 病原菌DNA的提取
从贮存的PDA茶汁培养基上刮取足量的菌丝和孢子,加入液氮研磨,采用植物基因组DNA提取试剂盒 (天根生化科技有限公司,DP130227)说明书进行DNA的提取。将收集到的DNA溶液经1%琼脂糖凝胶电泳检测后,置于-20℃冰箱保存备用。
1.6.2 rDNA-ITS序列测定和序列分析
采用真菌通用的引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’) 和 ITS4 (5’-TCCTCCGCTTATTGATATGC-3’)对病菌进行PCR扩增。PCR反应体系为:2×Tap MasterMix 25 μL,ITS1 和 ITS4 各 2 μL,模板 DNA 1μL,RNase-Free Water加至 50 μL。PCR反应条件为:94℃预变性5 min;94℃变性45 s,52℃退火 45 s,72℃延伸 90 s,35 个循环;72℃终延伸10 min;16℃保存。取5μL PCR产物用1% 琼脂糖凝胶中进行电泳检测,随后PCR产物送至生工生物工程 (上海)股份有限公司测序。将测序结果通过GenBank数据库进行序列比对,用MEGA 7软件构建系统发育树进行分析。
2 结果与分析
2.1 病害症状
赤叶斑病一般5-6月开始发病,7-8月为发病高峰期,该病害主要危害嫩叶、成叶[9]。赤叶斑病在武夷学院茶园水仙叶片的发病初期,多从叶尖或叶边缘开始产生浅褐色病斑,病斑面积较小(图1A),后扩展到半叶或全叶,形成不规则的、面积较大的赤褐色病斑,病斑边缘具有深褐色隆起线,病健交界明显(图1B),后期病斑上生有许多黑色隆起的细小粒点(图1C)。

图1 武夷岩茶水仙叶片赤叶斑病发病情况Figure 1 Disease symptom of red leaf spot disease in nature
2.2 病原菌的致病性测定
为了确认分离纯化的病原菌为茶赤叶斑病的致病菌,我们进行致病性实验。在离体叶片上人工接种分离的病原菌,接种的叶片均有发病,发病率为100%,对照组均未发病(图2A)。接种后3 d(图2B)出现浅褐色病斑,5 d病斑逐渐增大,颜色加深,7 d病斑扩展减慢,10 d病斑呈赤褐色(图2C)。该表型类似于上述武夷学院茶园水仙茶树叶片所观察的茶赤叶斑病表型。
将感染病菌的茶叶经Trypan Blue染色液染色,脱色液过夜脱色处理后,置于显微镜下观察。结果发现,病菌大多数生长在栅栏组织内,接种后3 d孢子已经萌发菌丝(图2D、2E)。孢子萌发产生的菌丝数量与长度随接种后天数逐渐增加(图2F、图2G),生长到一定程度后,菌丝和孢子梗相互缠绕形成分生孢子器(图2H)。病斑上形成的黑色粒点即病菌的分生孢子器,黑色,有孔口,呈球形或近球形(图2I)。之后,此接种发病茶叶经再分离、再纯化获得的菌株与原接种的菌株形态特征及菌落特点一致,获得了相同的病原菌,符合柯赫氏法则。上述结果证明,原接种的菌株为茶赤叶斑病的致病菌,我们将其命名为CCYB1。
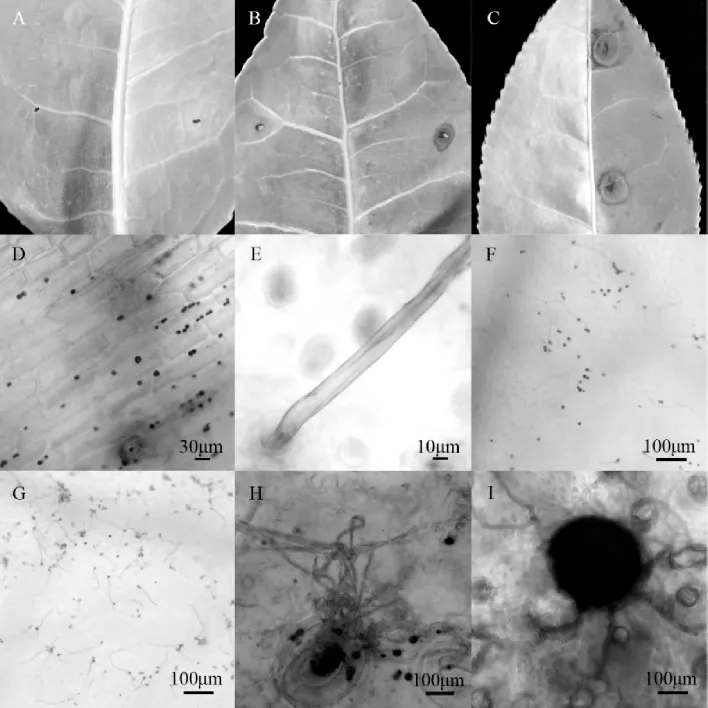
图2 接种病原菌叶片表型Figure 2 The symptoms of CCYB1 on the inoculated leaves
2.3 病原菌的培养性状与形态特征
将茶赤叶斑病菌CCYB1在不同培养基上进行划线培养,如表1所示培养3 d后观察到病菌在涂抹了100μL茶汁液的培养基上生长情况较好,培养基孢子萌发率为50%,而无涂抹的培养基孢子萌发率为0。结果表明,涂抹茶汁液更易于茶赤叶斑病菌孢子的萌发。
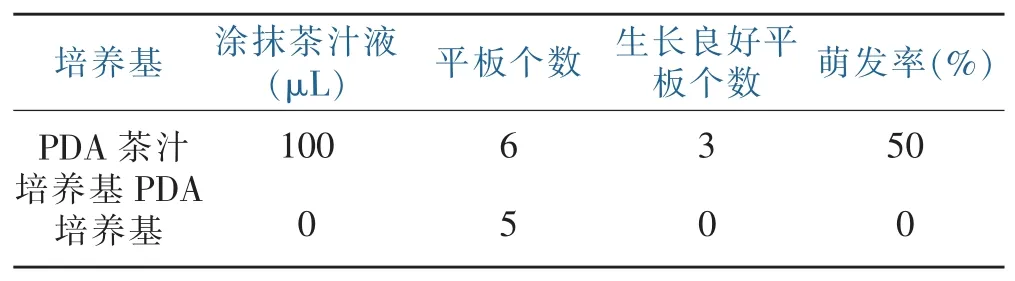
表1 茶汁对CCYB1病原菌的孢子萌发的影响Table 1 Effect of tea juice on spore germination of CCYB1
将菌株CCYB1纯化后的孢子在PDA茶汁培养基上25℃恒温培养5 d即长满直径为90 mm的培养皿。菌丝生长初期为白色绒状,产孢后逐渐变黑(图3A);生长后期平板菌落整体呈黑褐色,边缘有白色菌丝体(图3B),菌落反面为黄色(图3C)。将菌体制片,在显微镜下观察孢子的形态,发现分生孢子呈红褐色至褐黑色,单胞,呈圆形或椭圆形,两端内凹,且孢子四周光滑或稍粗糙(图3D)。
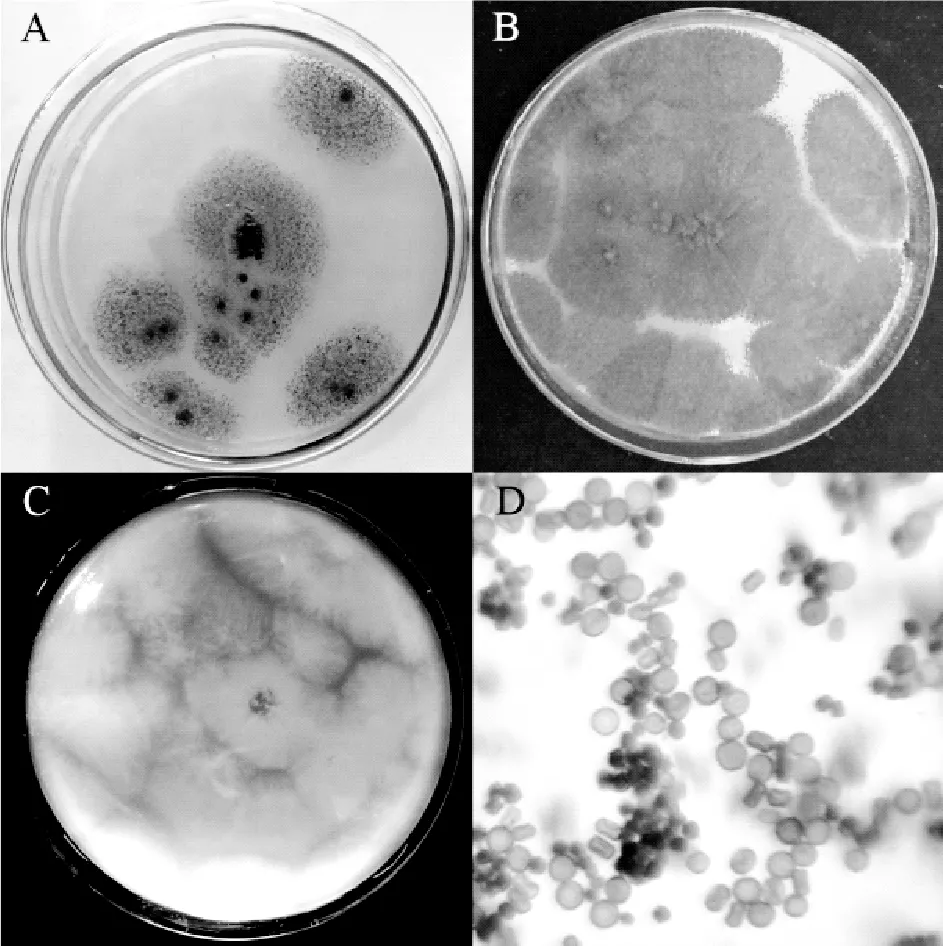
图3 CCYB1在生长情况和分生孢子形态Figure 3 The culture characteristics and morphology of CCYB1
2.4 病原菌的分子鉴定
通过对病原菌CCYB1的rDNA-ITS基因片段进行PCR扩增,获得一段603 bp片段(图4)。将测序得到的序列提交到GenBank(登录号:MG279093)。利用BLAST进行同源性比较,结果显示分离的病原菌与塔宾曲霉(Aspergillustubingensis)的相似度达100%。构建系统发育树显示(图5),分离的病原菌与Aspergillus tubingensis (KT803072.1、KP994290.1、KF434096.1 、KF434094.1、KF434093.1)聚在同一分支。再根据之前所观察的CCYB1菌落特征,查询中国微生物与病毒主题数据库,发现与数据库中塔宾曲霉相关特征吻合。综合上述病原菌的形态特征和分子鉴定结果,最终确认CCYB1是塔宾曲霉。

图4 CCYB1病原菌rDNA-ITS的PCR扩增Figure 4 PCR amplification of rDNA-ITSof CCYB1

图5 N-J算法构建进化树Figure 5 Neighbor-joining phylogenetic tree based on rDNA-ITSgene sequences
3 结论与讨论
国内外关于茶赤叶斑病的研究较少,我国的报道主要侧重于病害的发生规律、病害与叶片结构的关系以及病害防治方法,未见有涉及病原菌鉴定的详细资料。茶赤叶斑病已报道的致病菌为茶生叶点霉(Phyllosticta theicola),属半知菌亚门真菌[3]。
本研究分离纯化的CCYB1,通过致病性测定和rDNA-ITS序列的比对分析,发现作为茶赤叶斑病致病菌的CCYB1是塔宾曲霉 (Aspergillus tubingensis)。塔宾曲霉属半知菌亚门,半知菌纲,壳霉目,杯霉科,菌落在25~37℃均可生长。我们所发现的CCYB1特征是具有黑褐色菌落,较长的分生孢梗柄和较小的分生孢子,分生孢子呈红褐色至褐黑色,近球形,表面稍粗糙,上述特征与中国微生物与病毒主题数据库内的描述一致。
之前的研究尚未发现自然状况下塔宾曲霉危害茶叶的现象。本研究中的塔宾曲霉CCYB1经离体叶片针刺法接种致病菌,发现CCYB1可以侵染武夷岩茶水仙叶片,产生的赤褐色病斑,与田间茶赤叶斑病发病类似。2017年有报道发现,塔宾曲霉能够使小桐子染上叶斑病,同时还发现对环境的适应力可能与寄主小桐子的生长环境以及叶片的生理生化性质有关[10]。塔宾曲霉CCYB1的发现,为深入研究茶赤叶斑病的致病机理研究和田间防治提供了理论参考。
以往的研究还发现,塔宾曲霉能够对环境中一定浓度的Pb2+起到固定作用[11];能够通过优化发酵条件,对类黑精和蜜糖酒精废水有一定的脱色作用[12];对聚氨基甲酸酯具有生物降解作用[13]。结合上述研究,塔宾曲霉CCYB1在工业生产和废弃物循环利用方面具有实际应用的可能性,为今后环境治理提供了更多的菌种选择。

