治疗用单克隆抗体的超敏反应:表型和内型
Ghislaine Annie C. Isabwe, MD, Marlene Garcia Neuer, MS, Leticia de las Vecillas Sanchez, MD, Donna-Marie Lynch, MSN, FNP-BC, Kathleen Marquis, PharmD, PhD, and Mariana Castells, MD, PhD,Boston, Mass, Sherbrooke, Quebec, Canada, and Santander, Spain
目前mAbs在治疗中的应用量急剧增加,已成为癌症和炎症性疾病靶向治疗的基础,诱发的超敏反应(hypersensitivity reactions,HSRs)发生也相应增加,限制了这类药物继续作为一线治疗方法,以避免单克隆抗体引起的严重HRSs、严重变态反应甚至死亡[1-2]。
尽管Gell和Coombs分类有助于从发病机制方面更多地认识HSRs,但mAbs超敏反应的分类和诊断仍是一个挑战。要深入的理解药物超敏反应,须基于其表型、内型和生物标志物来进行分类[3]。表型即为临床表现,内型指由生物标志物(如皮肤试验、类胰蛋白酶及其他)定义的HSRs细胞和分子机制[4]。关键问题是mAbs HSRs的临床表现可能是由几种机制共同介导的,且其诊断和管理方案均尚未标准化。
mAbs超敏反应包括药物输注引起的相关反应、细胞因子释放反应以及Ⅰ型(IgE /非IgE)、Ⅲ型和Ⅳ型迟发反应。mAbs输注引起的相关反应和细胞因子释放反应在首次输注时即可发生,表现为轻度至重度的潮红、寒战、发热、心动过速、高血压、呼吸困难、恶心、呕吐及晕厥症状[5-8]。mAb输注相关反应和细胞因子释放反应的区别是,重复暴露时输注引起的相关反应具有自限性且对预防性用药有效[5-10]。mAbs诱发的Ⅰ型反应如利妥昔单抗和西妥昔单抗引起的HSRs的表现,通常为潮红、瘙痒、荨麻疹、气短、低血压及危及生命的严重变态反应。这些症状与肥大细胞/嗜碱性粒细胞释放的介质有关,包括类胰蛋白酶、组胺、白三烯和前列腺素,其作用可累及皮肤、呼吸、胃肠道和心血管等系统[11-12]。可溶性抗原与IgG/IgM结合形成免疫复合物并沉积在组织中,从而诱发Ⅲ型HSRs,导致局部损伤(mAbs注射后出现Arthus反应)或全身性损伤,目前已有英夫利昔单抗、依那西普和阿达木单抗引起HSRs的报道[13-15]。mAb(如利妥昔单抗)诱发的Ⅳ型迟发HSRs可表现为非重症的斑丘疹至严重反应(Stevens-Johnson综合征、中毒性表皮坏死松解症),常发生于用药后12 h至数周内,通常认为由T细胞所介导,但也可能涉及其他机制[16-19]。
脱敏疗法是一种有效的治疗方法,可使患者安全有效地维持一线治疗,对应用mAb出现Ⅰ型及细胞因子释放反应的患者可考虑采用脱敏疗法[20]。然而, 采用mAb脱敏治疗的大样本临床资料据仍很有限。Brennan等对接受利妥昔单抗、英夫利昔单抗和曲妥珠单抗后发生HSRs的23例患者进行105次脱敏治疗,发现脱敏疗法使发生HSRs后的患者能够再次使用mAbs,因此有广泛的应用前景,但每次脱敏治疗时仍存在发生HSRs的可能。
本文中我们报道的mAbs HSRs例数最多,共收集了对16种mAbs发生HSRs的患者104例,对这些HSR的表型和内型进行描述和分类,同时还收集了上述患者进行的526次以皮下及静脉注射方法进行脱敏治疗的资料,发现该疗法安全性极佳,尚未发现死亡者。尤其是我们的报道还涵盖了新的有重要影响的mAbs,如阻断程序性细胞死亡-1和人表皮生长因子受体-2单抗(派姆单抗、纳武单抗、帕妥珠单抗和曲妥珠单抗),并为这些HSRs的诊断和治疗提供了新的指南建议,同时建立了新的mAbs脱敏疗法治疗规范。
1 方法
1.1 患者选择
本研究对在布莱根妇女医院和达纳法伯癌症研究所药物超敏反应和脱敏中心接受脱敏治疗并将其作为规范治疗的患者进行分析,纳入的患者包括2014年1月1日至2016年12月31日在门诊和内科重症监护室接受任何一种mAbs脱敏治疗的所有患者,还纳入了1例2011年接受西妥昔单抗脱敏治疗的患者。该研究经布莱根妇女医院伦理审查委员会审查批准(方案号2016P001276)。脱敏疗法适用于那些在给药期间或给药后短时间内出现的、与速发型HSRs或无重症皮疹的迟发反应,且需要mAb治疗作为一线治疗的患者。
由于再次给药有再次诱发严重反应甚至致死的风险[21-22],故排除有严重皮肤不良反应-伴发嗜酸性粒细胞增高及全身症状的药疹、急性泛发性发疹性脓疱病、Stevens-Johnson综合征或中毒性表皮坏死松解症的患者。有化学性肝炎、骨髓抑制和肾脏并发症的患者也不适于接受脱敏疗法。
1.2 HSRs分类和严重程度
变态反应的症状表现为皮肤相关症状(潮红、红斑、瘙痒、风团、血管性水肿、迟发斑丘疹样皮疹)、呼吸相关症状(呼吸困难、胸闷、喘息、咳嗽、氧饱和度下降)、喉部相关症状(瘙痒、刺痒、喉部肿块、发紧、肿胀、声音嘶哑、吞咽困难、喉鸣音)、心血管相关症状(胸痛、心动过速、心动过缓、心电图改变、低血压、高血压、晕厥前兆/晕厥)、胃肠道(恶心、呕吐、腹泻、腹痛)、神经肌肉相关症状(胸痛、背痛、头痛、刺痛、视觉异常、濒死感、癫痫发作、意识丧失)及全身症状(发热、寒栗/寒战)。根据修订的Brown分类法可对HSRs的严重程度进行分级。仅限于1个器官受累者为Ⅰ级(轻度)反应,通常是皮肤;累及2个或更多器官但无生命体征改变者为Ⅱ级(中度)反应; 1个或多个器官系统受累且伴有生命体征的改变,如低血压、氧饱和度降低、喉部阻塞、癫痫发作或意识丧失者为Ⅲ级(严重)反应[23]。
1.3 皮肤试验
进一步用生理盐水将商品化的药物溶液或根据制造厂商提供的说明书复溶的溶液稀释以皮内试验。(1)表皮皮肤试验:将一滴mAb原液滴在前臂的掌侧,然后用Quintest点刺针(Bayer,Spokane,Wash)穿过液滴刺入表皮。(2)皮内注射:采用基于公开发表文献的非刺激浓度药物[24-25]或者先采用1∶1000稀释的药物0.02 ml进行皮内注射,如果试验结果阴性,再用1∶100和1∶10稀释药物。为了减少假阴性结果,应至少在初始HSR后2周进行皮肤试验。 风团直径比阴性对照(生理盐水)风团直径至少大3 mm者为阳性反应。组胺点刺(10 mg/ml)作为阳性对照[9,26]。考虑试验成本,部分mAbs未进行皮肤试验。
1.4 脱敏治疗方案和不良反应的处理
mAbs静脉注射脱敏方案由1至4号溶液(根据不同的mAbs以及制造厂商的推荐方案,每号溶液均配制于100~500 ml生理盐水中)组成。第1袋装有1/100的稀释液,第2袋为1/10稀释液,第3袋的稀释度(原液浓度)通过从总目标剂量中减去步骤1~8中给药的累积剂量来计算[1,9]。这些溶液可采取4、8、12或16步骤法给药,每一步剂量递增2.0~2.5倍,每15分钟增加输注速度,达到最后一步时维持输注速度,直至达到目标剂量。皮下注射mAbs脱敏治疗使用7步骤方案,前4个步骤用原液浓度1/10的稀释液,剩余的3个步骤用原液。每个步骤之间的间隔是30 min,每个步骤剂量加倍,直至达到目标剂量。脱敏治疗方案的示例见表1和2。
基于初始HSRs的症状,在脱敏治疗前30 min给以预防用药。西替利嗪(10 mg口服)和法莫替丁(20~40 mg口服或静脉使用是适用于所有脱敏治疗方案的标准预防用药。额外的预防用药包括阿司匹林(用于潮红)和孟鲁司特(用于支气管痉挛)。 COX-1抑制剂、对乙酰氨基酚、糖皮质激素和阿片类药物可用于预防寒栗、寒战、发热和疼痛。
必要时或根据患者病情添加其他预防性药物,包括静脉滴注、羟嗪、多塞平、非索非那定、苯海拉明、氯雷他定、沙丁胺醇、齐留通、昂丹司琼、加巴喷丁和劳拉西泮。患者在脱敏治疗前24 h应停用β-肾上腺素能阻滞药物。

表1 单克隆抗体脱敏治疗方案:派姆单抗(Pembrolizumab)静脉脱敏治疗方案(目标剂量200 mg)

表2 单克隆抗体脱敏治疗方案:奥马珠单抗(Omalizumab)皮下脱敏治疗方案(目标剂量150 mg)
如果在脱敏治疗期间发生轻微反应,应暂停输注并根据症状给予药物对症处理。一旦反应消退,应从暂停时的步骤重新开始输注。出现严重者则应停止脱敏疗法采用适当的急救药物对患者进行治疗。
1.5 统计学方法
该研究的主要目标是明确有利于脱敏治疗成功的患者特征,包括年龄、性别、潜在疾病、特应性、既往暴露史、皮肤试验、治疗方案、表型、内型和HSRs的生物标志物。为了比较两组之间的统计学差异,连续变量评估采用95%置信区间的双侧Welcht检验,分类变量分析采用卡方检验。计算并给出每个变量的平均值±标准差以及每个分类变量的数量和百分比。所有统计分析均使用R统计软件(RConsortium,Vienna,Austria)。
2 结果
2.1 患者特征
104例患者用16种不同的mAbs进行了526次脱敏治疗。这些患者中37%具有特应性病史(哮喘、变应性鼻炎、食物过敏、荨麻疹和/或膜翅目毒液过敏病史),27%的患者有其他药物不良反应史(表3)。最常见的mAbs治疗适应证是血液系统恶性肿瘤(47/104例)、结缔组织疾病和其他自身免疫性疾病(32/104例)(表4)。
2.2 HSRs初始反应的症状和表型
皮肤症状(潮红/发热/红斑32%、瘙痒29%、荨麻疹19%)是最常见的初始症状,其次是呼吸(呼吸困难21%)及喉部(发紧/肿胀14%)症状。生命体征变化如低血压和氧饱和度下降分别为11%和7%(图1)。HSRs初始反应呈现4种表型:Ⅰ型(占63%),细胞因子释放反应(占13%),混合型(占21%)和,Ⅳ型迟发反应(占3%)(图2A)。
2.3 HSRs初始反应的严重程度
大多数初始反应是Ⅱ级,占48%,29%的患者出现Ⅲ级反应(图2B)。利妥昔单抗引发Ⅱ级反应的发生率较高,达60%(31/52例),而英夫利昔单抗引发I级反应的发生率较高,达39%(7/18例)。托西珠单抗和本妥昔单抗出现Ⅲ级反应的例次高,但病例数分别仅有3例和8例(表4)。
2.4 脱敏治疗方案
在所有526次脱敏治疗中,有425次(80%)使用3袋(浓度梯度)-12步骤方案,其他方案包括1袋(浓度梯度)-3步骤、2袋(浓度梯度)-8步骤和4袋(浓度梯度)-16步骤,分别占6%、3%和9%。对3种皮下给药mAbs进行了9次7步骤脱敏和单步骤激发方案,81次脱敏治疗中应用静脉滴注作为预防用药,作为规范预防用药的一部分(在脱敏治疗期间没有出现严重突发反应)的患者出现HSRs的发生率为18%,且仅出现Ⅰ级反应。与之相似,在脱敏治疗期间发生严重突发反应的患者在随后的脱敏治疗中应用静脉滴注作为预防用药者所出现的反应级别也较低(1.30~0.35)。

表3 人口学资料和患者特征(n=104)
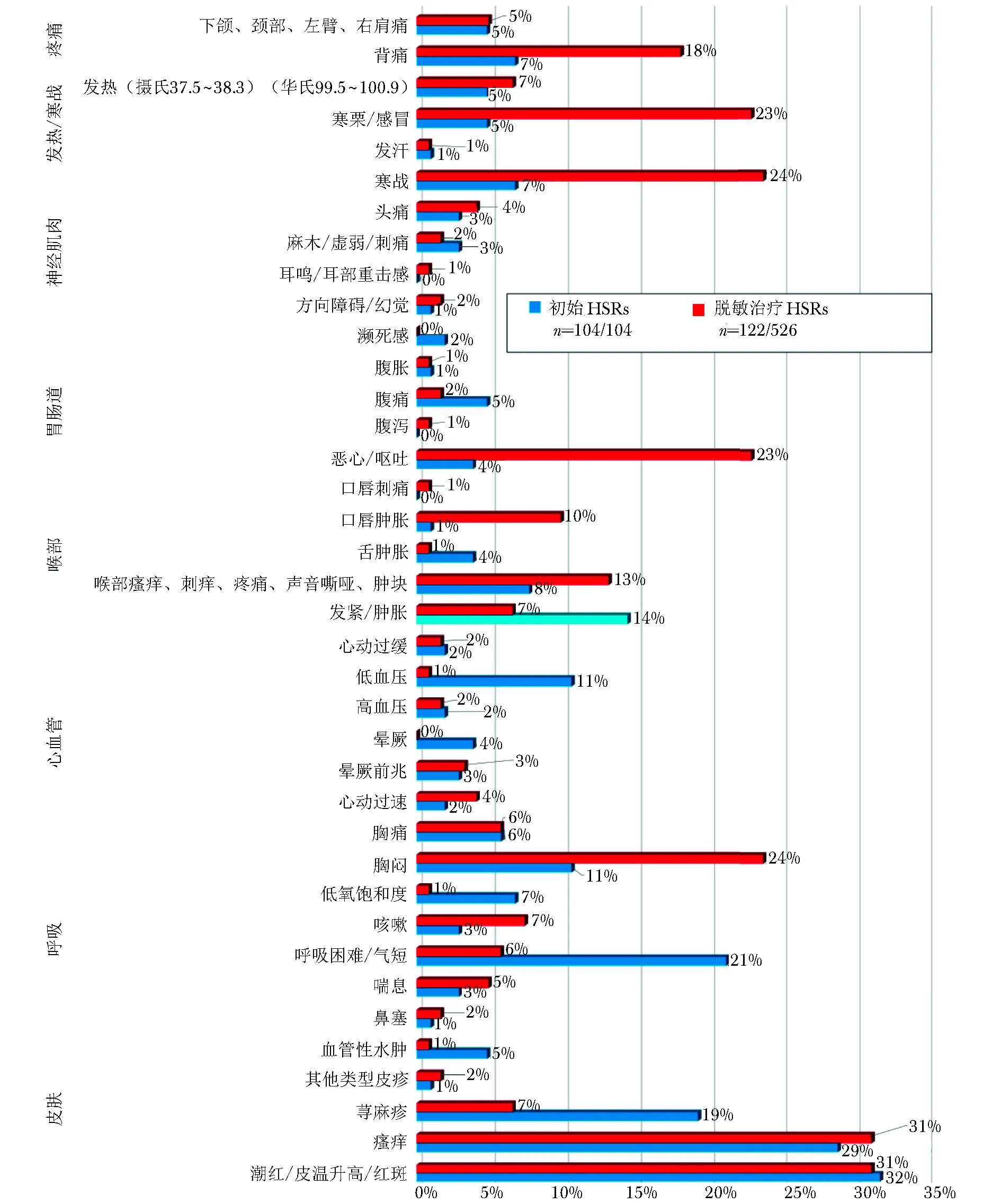
图 1 初始HSRs与脱敏治疗HSRs症状比较(以按器官系统分类发生特定症状反应患者的百分比表示)初始HSRs包括所有患者(n=104),脱敏治疗HSRs包括所有在脱敏治疗期间有突发严重反应的患者(526例次中的122例次);SOB:气短
2.5 脱敏治疗过程中出现的反应
脱敏治疗期间出现的主要症状是寒战(24%)、寒栗(23%)、背痛(18%)(图1),其中细胞因子释放反应是主要的HSR表型(52%)(图2B和C)。在526次脱敏治疗中,404次(77%)顺利完成,未出现任何HSRs。HSRs常发生在第12步(53/122例),在所有脱敏治疗中,15%(78次)出现轻度HSRs(Ⅰ级)、8%(42次)出现中度HSRs(Ⅱ级),0.4%出现(2次)为重度HSRs(Ⅲ级),1例患者给予肾上腺素(图2D)。患者的第1次脱敏治疗期间均未出现Ⅲ级反应(图2E)。在出现多次HSRs(在不同步骤)的18次脱敏治疗中,有3次(16%)随着时间推移HSRs加重(其中2例次从Ⅰ级到Ⅱ级,1例次从Ⅰ级到Ⅲ级)。接受皮下注射脱敏治疗的4例患者均成功完成治疗(表4)。

图 2 初始HSRs与脱敏治疗HSRs特征比较
与初始HSRs相比,第1次脱敏治疗期间HSRs的严重程度显著降低(P=1.3×10-13)(图2E)。更长时间的可疑致敏药物暴露能显著降低脱敏治疗期间的平均HSRs程度(P=0.003)(参见在线资料库www.jacionline.org中本文的图E1),同时,多次脱敏治疗的HSRs频率和严重程度也会降低(图2G)。患者出现HSRs者如已减慢静脉滴注速度或增加预防用药仍无法按照方案完成脱敏治疗时,建议将剂量减少25%、50%或75%。剂量的减少幅度取决于HSRs的严重程度,HSR越严重,剂量越低,且需与经治医生协商。6例患者的21次脱敏治疗需要降低剂量;15次脱敏治疗未再出现HSRs。后续仍出现严重突发反应患者的HSRs级别从1.9±1.3降低至0.6±1.2。3例患者完成脱敏治疗且达到100%目标剂量,2例患者采取其他治疗方案无需再接受脱敏治疗,1例患者因在两次脱敏期间尽管剂量均已降低50%,但仍持续出现2级反应而未能继续脱敏治疗。

表4 按不同药物表示的生物药品特征、适应证、初始反应的严重程度、患者例数和脱敏治疗次数
2.6 皮肤试验及其与HSRs严重程度的相关性
对58例患者进行了10种mAbs的皮肤试验,其中24例阳性(9例点刺试验,15例皮内试验),占41%;34例阴性,占59%(表5)。在初始反应为Ⅰ型反应和细胞因子释放反应表型的患者中,皮肤试验的阳性率分别为44%和11%(图3A),脱敏治疗期间出现Ⅰ型反应的患者皮肤试验阳性率为69%(图3B)。脱敏治疗期间两类皮肤试验结果的反应等级均显著下降(图3C)。皮肤试验阳性结果与较重的初始HSRs相关(P= 0.0088)(图3C)。
2.7 生物标志物
45例患者进行了类胰蛋白酶检测,其中1例在2次脱敏治疗期间类胰蛋白酶升高(21.4 ng/ml和23.6 ng/ml,基线期为14.3 ng/ml)。13例患者进行IL-6检测,其中8例升高(表6)。
3 讨论
我们对104例患者的HSRs提供了新的表型和内型的循证描述,这些患者对16种mAbs(目前可用mAbs的34%)出现了HSRs且成功进行了脱敏治疗,有助于mAb HSR的诊断和治疗。
本研究中常见的诱发HSRs的mAbs是利妥昔单抗、英夫利昔单抗、托西珠单抗、本妥昔单抗及曲妥珠单抗,而新的人源化mAbs,如帕妥珠单抗、纳武单抗和派姆单抗诱发HSRs较为少见。由于缺乏小鼠抗体部分,人源化mAbs的HSRs较为少见,但由于使用了不能合成人糖基侧链的转基因小鼠细胞株,因此免疫原性仍可持续存在[27-29](图4)。
我们将HSRs分为4种表型,Ⅰ型(IgE/非IgE)、细胞因子释放反应、混合型(Ⅰ型/细胞因子释放)和Ⅳ型反应。Ⅰ型占63%,是最常见的初始HSRs表型(图1和图3)。荨麻疹的发生率高于文献报道的其他药物HSRs,很可能是mAb HSR的独有特征。有趣的是,在脱敏治疗过程中,我们观察到从Ⅰ型到细胞因子释放反应的转换(图2A和C)。这种转换的机制尚不清楚;但一种可能性是脱敏治疗以及规范预防性药可以阻断Ⅰ型HSRs,但不能抑制细胞因子释放反应的症状,这并不能解释初始反应HSRs的表现及为什么患者的初始反应中细胞因子释放型和Ⅰ型反应(或混合反应)的数量并不一致,因此凸显了在后续反应中HSR表型转换的可能。
用确立生物标志物来鉴别药物HSRs的内型对于鉴定、分级和治疗HSRs至关重要,目前的生物标志物仅适用于Ⅰ、Ⅲ和Ⅳ型,但不适用于Ⅱ型。文献报道类胰蛋白酶在Ⅰ型HSRs中会升高,在我们的报告中,利妥昔单抗脱敏治疗期间出现2次偶发类胰蛋白酶升高(同一患者),与Ⅰ型症状相关联,且可由于H1/ H2阻断作用而表现为无症状的亚临床反应。在所有被检测的患者中,IL-6的升高与细胞因子释放症状均相关联。IL-6是鉴定和治疗细胞因子释放反应的重要生物标志物。
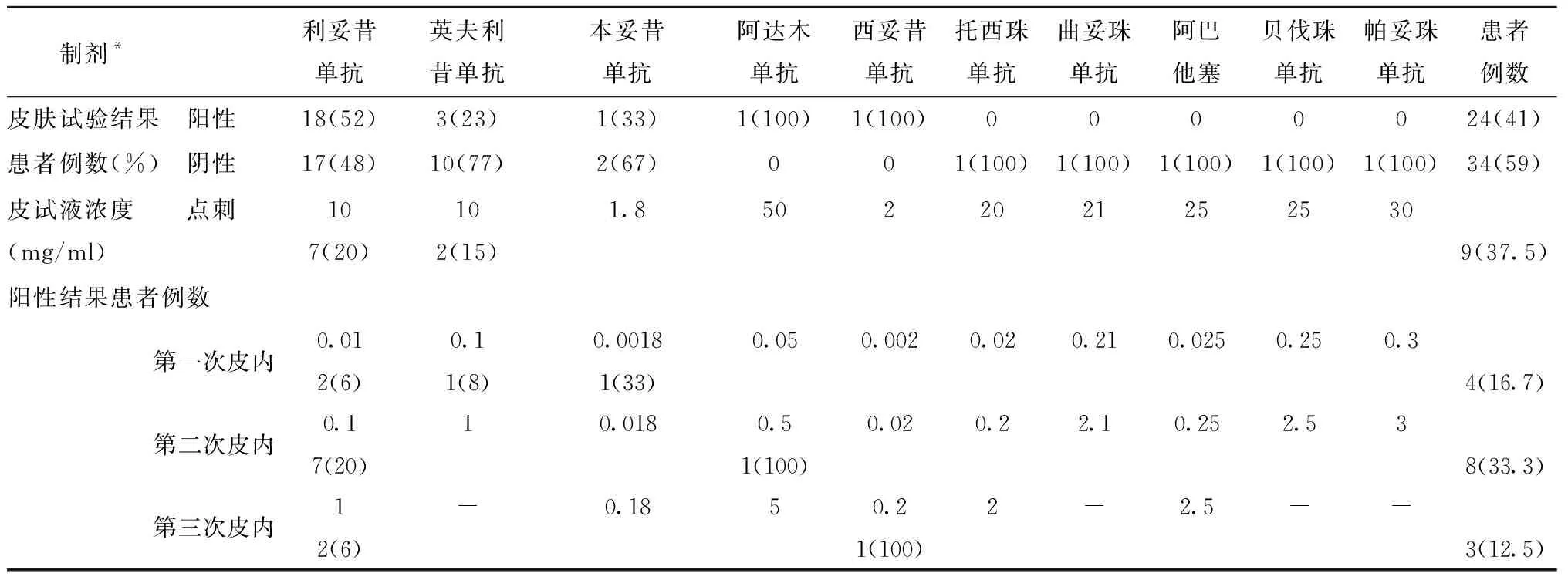
表5 皮肤试验结果和皮试浓度[n或n(%)]
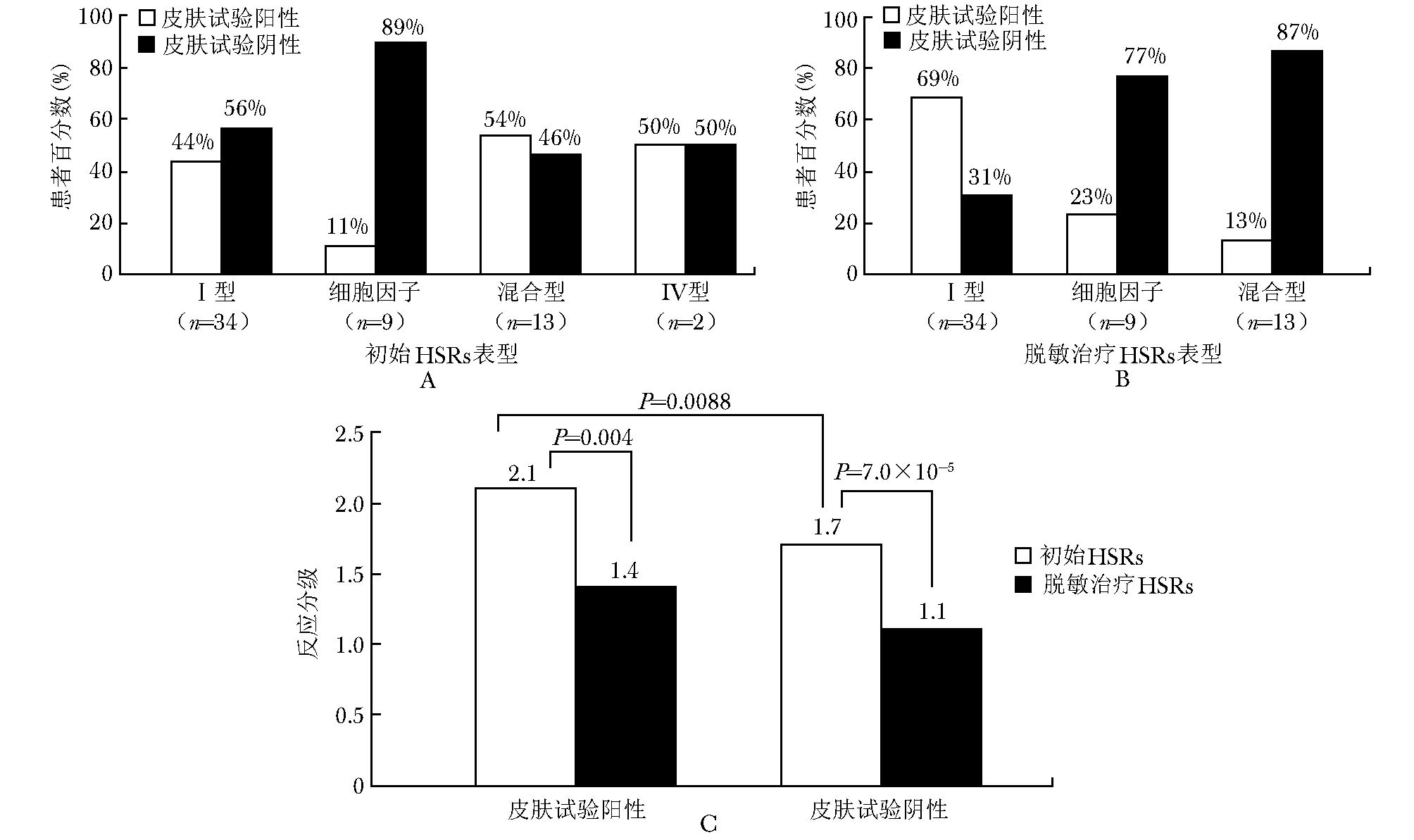
图 3 皮肤试验结果与HRSs表型和严重程度的关系

图 4 推荐对于mAbs HSR的精确医学新分类和新治疗建议

表6 脱敏治疗期间的生物标志物
其他鉴定,如皮肤试验,在mAbs HSRs中尚未规范化,但已有证据显示可用于化疗方案的危险度分层[4]。我们对58例患者(56%)进行了皮肤试验,其余46例因mAbs费用昂贵检测被推迟(表5)。5种mAbs的皮肤试验结果为阴性,这些患者中4例与混合型、细胞因子释放型和Ⅳ型反应相一致,提示皮肤阴性试验反映了潜在的内型。另1例患者对托西珠单抗有轻微的Ⅰ型反应,Ⅳ型反应有可能倾向于进展为IgE介导的Ⅰ型反应。因此,对于皮肤试验结果阳性的迟发反应患者推荐脱敏治疗。考虑仅有少数患者进行了皮肤试验,mAbs皮肤试验的价值尚待进一步验证。尽管有少数初始Ⅰ型HSRs(44%)与皮肤试验阳性相关联(图3A),但在脱敏治疗期间,皮肤试验阳性患者中出现Ⅰ型表型的百分比更高(69%)(图3B)。这些发现表明,皮肤试验在预测严重突发反应的表型方面可能有一定的意义。皮肤试验阳性患者的初始HSRs级别显著增高(P=0.0088),虽然统计学上差异并不显著,但皮肤试验阴性患者在脱敏治疗期间反应级别较低(图3C),证实了mAb 皮肤试验的临床相关性和重要性,可参见mAb治疗流程中的相关描述(图5)。
人口统计学资料发现,我们的患者中罹患特应性疾病的比例高于普通人群(37%比25%),且药物不良反应发生率明显增高(27%比<1%),但与出现化疗HRSs的患者(特应性疾病患病率为47%,药物不良反应发生率为50%)相比,我们患者的发生率均较低(表3)[20,30]。
随着mAb全程暴露时间的延长(在初始反应时更多地暴露于mAb),HSRs级别显著降低。对mAbs的初始反应发生于第1次及第2次全程暴露期的概率更高,且反应级别也较严重,但后续暴露时的反应级别和严重程度均较初始反应降低(图E1)。
在脱敏治疗期间发生的HSRs的严重程度明显低于初始HSRs,尤其是第1次脱敏治疗时未出现严重的Ⅲ级症状,如低血压、晕厥和/或血氧饱和度降低(图2及在线资料库www.jacionline.org中本文图E2)。仅有23%的患者在脱敏治疗期间发生HSRs,其中大多数为轻度(Ⅰ级)反应。如既往文献的报道,大多数反应发生在脱敏治疗的最后一步[9,30],本研究的结果亦显示脱敏方案第一袋药物给药期间出现反应罕见,这可能提示第一袋药物并非mAbs脱敏治疗所必需。然而,如同体外模型结果所示,脱敏治疗前期步骤对于预防脱敏治疗后期步骤较大剂量诱发HSRs所必需[31-33]。尚需更多的证据明确第一袋药物在脱敏治疗中的作用。
接受预防静脉滴注生理盐水的患者较少出现严重反应(1对1.4),出现突发严重突发反应后静脉滴注生理盐水的患者反应也较轻。静脉滴注生理盐水疗效的潜在机制可能是同时稀释抗原和肥大细胞介质,降低其浓度并促进免疫原性物质的快速清除。对于细胞因子释放反应患者,推荐的输注速度前11个步骤中为100 ml/h,第12步骤增加到250 ml/h(对于3袋-12步骤方案,即当药物处于峰值浓度和峰值速度时)。在出现HSRs时,输注速度可增加至500 ml/h直到症状消失。本文的流程图对上述推荐方案进行了概述,该流程图有助于基于表型、临床表现和生物标记进行危险度分级(图5)[20]。

图 5 mAb HSR的推荐治疗流程

图 E1 基于mAb暴露(次数)的HSRs严重程度白色柱代表初始HSRs平均严重程度级别,根据既往mAbs的暴露次数(1-2,3-6,7及7次以上)分类;黑色表示在同一暴露次数下,首次脱敏治疗HSRs平均严重程度级别
既往数据显示多次脱敏治疗后可维持长期耐受,如首次脱敏治疗失败,可通过降低(脱敏治疗)剂量使患者耐受其目标剂量[9]。6例患者中有3例通过先降低剂量、再于随后的多个脱敏治疗疗程中递增剂量(如从50%逐步增至75%、100%)最终达耐受。长期耐受的机制还不清楚,尚待进一步研究。同时这种机制也并非实现了真正的脱敏,不推荐在不经脱敏治疗的情况下再次暴露于可疑的生物制剂。如既往文献报道,重复脱敏治疗能降低脱敏治疗过程中发生HSRs的风险,经20次脱敏治疗达到平台期[9]。
回顾性研究所固有的局限性决定了本研究只能对生物标志物(包括皮肤试验)和脱敏治疗期间使用的药物(例如静脉滴注)进行相关性分析。由于我们的患者罹患不同的疾病,收集到的初始HSRs的生物标志物极其有限。应对基线期、初始HSRs期、脱敏治疗及脱敏治疗后各种生物标志物进行进一步评估,以明确这些生物标志物是否能够作为临床上识别不同临床表型的相关指标。除IL-6、类胰蛋白酶外,应研究其他生物标志物,以能更深入的理解Ⅱ、Ⅲ、Ⅳ型和细胞因子释放反应的潜在内型。皮肤试验的局限性在于尚未经过验证,皮肤试验试剂昂贵且大多数情况下无法获得,含有高浓度所有表位成分的特殊皮试液可能为明确诊断所必需。此外,明确无刺激浓度(包括对照液)、预测值(阳性或阴性)及费
用问题/报销问题也是mAb皮肤试验需要虑及的重要问题。 mAb皮肤试验是否适用于临床在一定程度上取决于权衡药物的实际成本与对患者危险度分级及治疗的潜在预测价值。鉴于配制皮试液仅需要少量的mAbs(0.1 ml原液),希望将来能有小包装药物或生物仿制药面世用于皮试。特异性IgE和嗜碱性粒细胞活化试验应与皮肤试验同时进行检测,构成“三头”诊断检测,更明确鉴别HSR的表型[12,34-36]。
结论
本文提出了一种基于表现的生物制剂HSRs新的分类方案,包括4种表型:Ⅰ型、细胞因子释放型、混合型和Ⅳ型反应。脱敏治疗过程中最常见的初始HSRs表型转换是由最常见的Ⅰ型转换为细胞因子释放型。在526次静脉及皮下注射生物制品脱敏治疗中, 523次(99.4%)成功完成。对于脱敏治疗困难的患者,静脉滴注和降低剂量是有效的治疗策略。我们的结果证实mAbs脱敏治疗的有效性和安全性。综合考虑HSR的表型与内型(IgE、非IgE)及生物标志物(如皮肤试验、类胰蛋白酶和IL-6)等因素将有助于指导mAbs HSRs的治疗。生物制品HSRs患者应采用精准和个性化治疗。
临床意义:本文提供了16种mAb HSRs新的基于循证的表型和内型,为诊断和治疗提供了有效手段,提高了mAbs HSR个体化和精准医疗水平。
参考文献请见原文:
J Allergy Clin Immunol 2018, 142:159-70
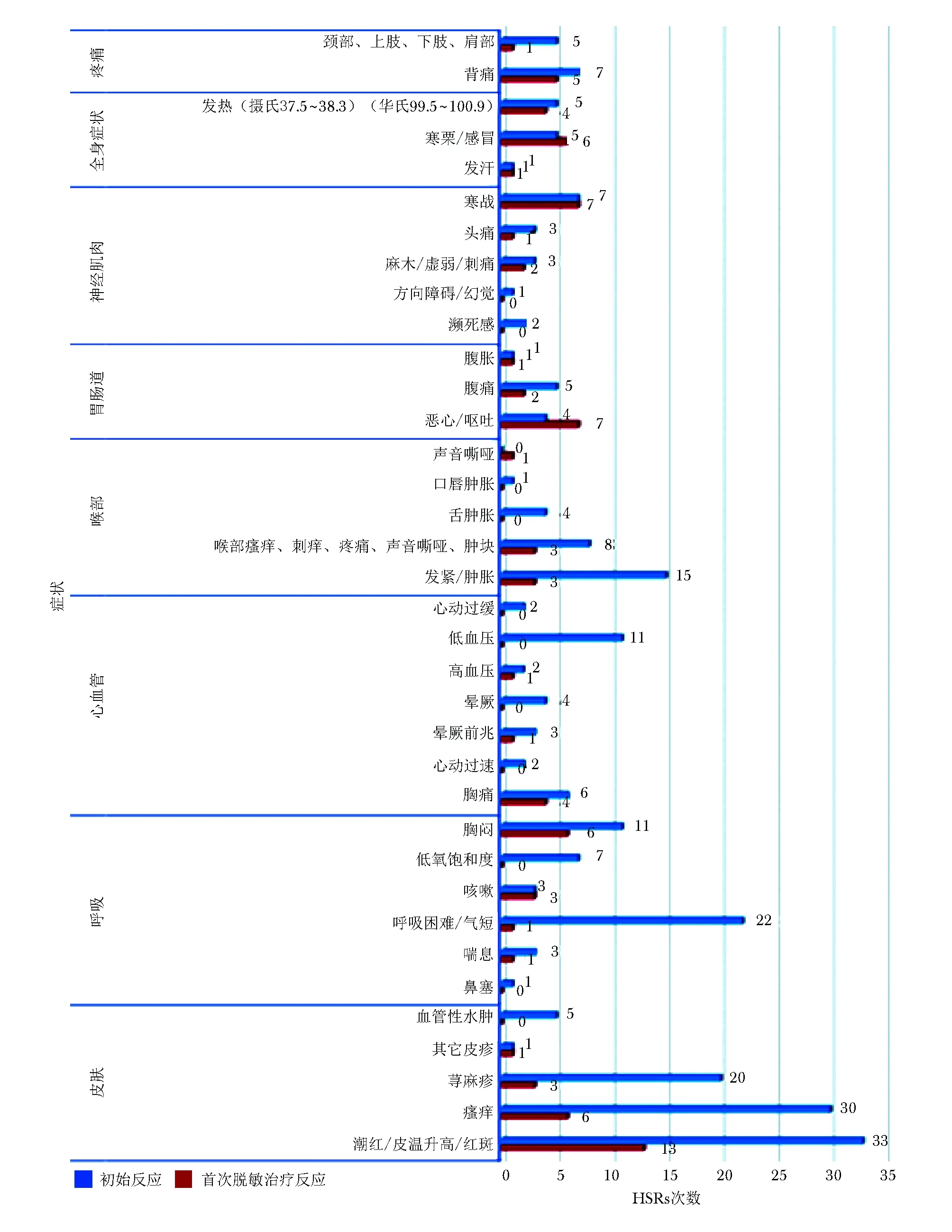
图 E2 初始HSRs与首次脱敏治疗HSRs症状比较
专家点评
王良录中国医学科学院北京协和医学院北京协和医院变态(过敏)反应科
精准医学是近年来临床医学理念的一项重大突破,而单克隆抗体(mAb)靶向药物是目前精准医学最重要的治疗手段。随着该类药物更加广泛地应用于临床,诱发超敏反应也随之增加,不仅阻碍了其临床应用,也对患者的生命健康构成了威胁。该文基于HSRs的临床表型、潜在的内型和生物标志物,提出了一种新的基于循证的mAb HSRs分类方法,特别是对细胞因子释放反应的描述,丰富了对mAb HSRs发病机制的认识。基于对HSRs发病机制的更深入、全面的认识,不仅为mAb HSRs脱敏治疗奠定了理论基础,亦为患者的选择提供了依据。本文还提供了mAb皮肤试验、激发试验及脱敏治疗的具体方案,为诊断和治疗这些HSRs提供了新指南,同时为mAb脱敏治疗建立了新的治疗规范。该文还报道了脱敏治疗过程中从Ⅰ型到细胞因子释放型的转换,以及非传统适应证细胞因子释放反应、Ⅳ型迟发型HSRs脱敏治疗,丰富了对mAb脱敏治疗的认识,扩展了适应证,为更多的mAb HSRs患者提供了恢复治疗的机会,重燃了生的希望,功莫大焉!该文为mAb HSRs的诊断和治疗提供了有效手段,提高了mAbs HSRs个体化和精准医疗水平,必将对单克隆抗体靶向药物的临床应用有所裨益。

王良录
中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科常务副主任,主任医师。1993年毕业于中国协和医科大学,获医学博士学位。现任中华医学会变态反应学分会候任主任委员、北京医学会变态反应专业委员会副主任委员、北京医师协会变态反应专科医师分会副会长、北京医师协会变态反应科专家委员会副主任委员、《中华临床免疫和变态反应杂志》副主编、《中华微生物学和免疫学杂志》等多种专业杂志编委。主要从事变态反应疾病的体外诊断、空气孢粉学、花粉症并v 食物变态反应、真菌变态反应的临床及基础研究工作。作为副主编完成《中国气传花粉和植物彩色图谱》、《中国气传真菌彩色图谱》的编撰工作。在研主持卫健委公益性行业科研专项项目一项。

