淫羊藿素对BALB/c-nu 裸小鼠人源性前列腺癌模型的影响
宋登鹏, 饶 红, 韩安艳, 武福云, 陈德森
(1. 十堰市太和医院 湖北医药学院附属医院, 十堰 442000;2. 湖北医药学院基础医学院, 十堰 442000)
前列腺癌(prostate cancer, PCa)为中老年男性泌尿生殖系恶性肿瘤, 发病率和死亡率仅次于肺癌,且其发病随年龄而增长, 严重威胁生命健康[1,2]。PCa为发生于前列腺腺体组织的腺癌, 是前列腺腺泡细胞异常无序生长的结果[3,4]。现在针对PCa的研究已有突破性进展, 如对miRNA的分子机制和功能的研究为PCa的生物学过程提供了新的认识, miRNA与 mRNA 结合后, 在转录过程中会对一些编码基因和非编码基因的表达产生影响, 可能造成前列腺腺泡细胞的失常或结构改变, 对PCa 的发生起关键性作用[5,6]。但在研究中也不能忽视磷脂酰肌醇3-激酶/蛋白激酶B(P13K/Akt)信号通路在PCa的病理演变中的作用。P13K/Akt信号通路在肿瘤细胞增殖和凋亡中起重要作用, 多项研究[7,8]表明P13K/Akt信号通路与PCa有关。抑制P13K/Akt信号通路或去势降低雄激素可能减缓PCa癌变[9]。目前针对药物对P13K/ Akt信号通路的影响多停留在细胞培养, 而缺少在体动物实验, 鉴于这一现状, 本研究在成功建立人源性前列腺癌LNCaP细胞珠动物模型的基础上,通过尾静脉注射的方法研究淫羊藿素对P13K/ Akt信号通路激活及磷酸化过程的影响, 探讨淫羊藿素干预PCa的机制, 为临床开发新药提供参考依据。
1 材料与方法
1.1 动物
5周龄SPF级雄性BALB/c-nu裸小鼠40只,体质量15.5~16.5g,购自北京维通利华实验动物技术有限公司[SCXK(京)2018-008]并饲养于实验动物中心标准的屏障实验室,所有动物均符合国家实验动物标准,并经我院医学伦理学会批准实施实验。人源性前列腺癌LNCaP细胞珠裸小鼠荷瘤建模在科技中心SPF级实验室[SYXK(鄂)2018-0031] 完成,实验期间遵守3 R原则,给予动物人道主义关怀,使受试动物享受动物福利。
1.2 主要药品及试剂
淫羊藿素标准品由成都瑞芬思生物科技有限公司提供(批号: 0173721); LNCaP细胞株由尔顿生物科技(上海)有限公司提供(批号: 02310); 麻醉乙醚由洛阳昊华化学试剂有限公司提供(批号: 20153125);EDTA、RPMI-1640 细胞培养基均由上海冠导生物工程有限公司提供(批号: H01722, H01730); 胎牛血清(FBS)由赛默飞公司提供(批号: B17501); RPMI-1640细胞培养基、磷脂酰肌醇3-激酶(P13K)、磷酸化蛋白激酶B(p-Akt)、磷酸化雄激素受体(p-AR)、雄激素受体剪接变异体7(AR-V7)、降钙素(Calcitonin)和钙黏蛋白E(E-cadherin)均购自南京森贝伽生物科技有限公司(批号: H1707、H0145、H1714、L0163、L0160); 其中阳性药物P13K/Akt抑制剂LY294002(批号: A10547-10)由Adooq中国(南京百鑫德诺生物科技有限公司)提供。
1.3 实验方法
1.3.1 动物分组 将40只雄性BALB/c-nu裸小鼠用随机数字表编号,按随机对照原则均分为4组: 对照组、PCa组、阳性药组和实验组,每组10只。
1.3.2 实验步骤
1.3.2.1 细胞复苏和调制 将LNCaP从冻存的液态罐取出,37 ℃速融解冻, 移入RPMI-1640培养液中复苏24 h。再次加RPMI-1640培养液培养3 d,0.25%EDTA消化后收集LNCaP, 调制成2×107个/mL的LNCaP悬液用于建模。
1.3.2.2 PCa模型制备 实验前将所有动物移入隔离柜,实验时再将4组BALB/c-nu裸小鼠移入麻醉盒,将乙醚倒在小纱布块上,放置于麻醉盒,约2 min后取出已麻醉的裸小鼠。然后移入超菌台,腹部向上固定,用碘伏消毒下腹部皮肤及生殖器,从裸小鼠髂前上棘正中腹白线近生殖器处纵行切开腹部皮肤、切口约1 cm即可,然后游离腹直肌,剪开腹膜,游离膀胱,将膀胱周围脂肪组织向左右推开, 牵出膀胱和精囊腺,用棉签将膀胱推向尾端,然后可见到较周围组织深的呈叶状肉红色左右各一叶的前列腺[10]。PCa组、阳性药组和实验组左右两叶前列腺分别注射25 μL 2×107个/mL的LNCaP悬液,然后还纳膀胱, 关闭腹腔、分层依次缝合、消毒即可。本实验为无菌手术, 无须注射抗生素。对照组手术同上,但不注射LNCaP悬液。将所有动物移入屏障动物实验室饲养并观察动物生存情况。根据以往经验和相关文献,肿瘤生长迅速,4周即可成模[11]。本实验4组动物各存活10只、8只、9只、9只,死亡原因不明,可能与感染、手术创伤、LNCaP接种或其它原因有关,接种LNCaP的存活动物均有肿瘤生长现象,成瘤率100%。
1.3.3.3 治疗方法 实验组每日按0.1 mL/10 g尾静脉注射0.8%淫羊藿素,本实验中使用的LY294002是一种广谱PI3K抑制剂,其抑制PI3K的IC50为0.5 μmol/L,根据文献及使用说明,本实验最终确定以其为阳性药,并按0.1mL/10 g尾静脉注射LY294002(约 0.5 μmol/L)作为阳性对照(即阳性药组),对照组和PCa组注射等体积生理盐水对照。4组动物均连续注射4周。
1.3.3.4 前列腺肿瘤生长情况及取材 先称裸小鼠体质量, 然后脱臼法处死动物, 摘取左叶前列腺(约20 mg), 用滤纸吸干后称前列腺瘤体组织湿重、量前列瘤体长短径计算体积以比较前列腺肿瘤生长情况。
1.3.3.5 前列腺瘤组织芯片标本制备及Calctionin、AR-V7、E-cadherin检测 用体积分数10%甲醛固定左叶前列腺, 常规胶水后石蜡包埋, 用组织芯片制备仪制备前列腺瘤组织芯片标本, 连续切片(4 μm),然后58 ℃烘烤18 h,常规脱蜡,PBS液冲洗3遍。柠檬酸缓冲液抗原修复20 min,室温冷却20 min,PBS液冲洗3遍。滴加20%蛋清后室温静置30 min,再次用PBS液冲洗3遍。滴加10%正常羊血, 室温静置20 min。加鼠Calctionin、AR-V7、E-cadherin一抗混合物, 室温孵育4 h,PBS液冲洗3遍, 封片。LeicaTCS SP2共聚焦显微镜下激光扫描, Calctionin、AR-V7以胞核内棕黄色颗粒、E-cadherin以胞核内可见红色荧光为阳性表达。
1.3.3.6 p-AR和p-Akt蛋白检测 取右叶前列腺(约20 mg),剪碎、冲打、混匀后放入加有700 μL蛋白裂解液(4 ℃)的离心管中,匀浆10 min,4 ℃条件12 000 g离心30 min; 弃上层液、取中层液到标记好的样品管中备检测。采用Western blotting检测p-AR和p-Akt蛋白表达。取备检匀浆液,样品孔加50 μg蛋白液进行聚丙烯酰胺凝胶电泳,湿转到硝酸纤维膜,用质量分数5%脱脂奶粉封闭,加一抗 p-AR、 P13K和p-Akt及GAPDH(内参), 4 ℃孵育过夜, TBST液洗涤, 室温下加二抗摇床孵育60 min,然后用TBST液洗涤7 min,滴加ECL发光液避光反应5 min,然后曝光显影,以GAPDH为内参,Image J软件分析目标条带的相对表达量。
1.4 统计学方法
使用SPSS 11.0统计软件进行统计学处理分析。定量资料采用多个样本均数方差分析, 以x- ±s表示,组间比较采用两样本均数的t检验,率的比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 前列腺瘤体生长情况
治疗结束后,PCa组裸小鼠前列腺瘤体湿重和体积均较对照组明显增高(t=4.733, 6.196,P<0.05)。阳性药组和实验组治疗结束后裸小鼠前列腺瘤体湿重和体积则较PCa组降低(t=4.925,7.034,5.902,4.193,P<0.05),治疗后4组体质量比较差异无统计学意义(P>0.05)(见表 1)。

表 1 4组裸小鼠体质量、前列腺瘤体湿重和体积比较
2.2 前列腺瘤组织芯片标本Calctionin 、AR-V7、E-cadherin阳性率
与对照组比较,PCa组Calctionin 、AR-V7阳性率升高,E-cadherin阳性率降低(t=9.014, 6.963,7.302,P<0.05)。与PCa组比较,阳性药组和实验组Calctionin 、AR-V7阳性率明显降低(t=6.352,7.293,P<0.05), E-cadherin阳性率明显升高(t=8.260,P<0.05)。阳性药组和实验组组间比较差异无统计学意义(t=0.381,0.156,0.093,P>0.05)(图 1)。
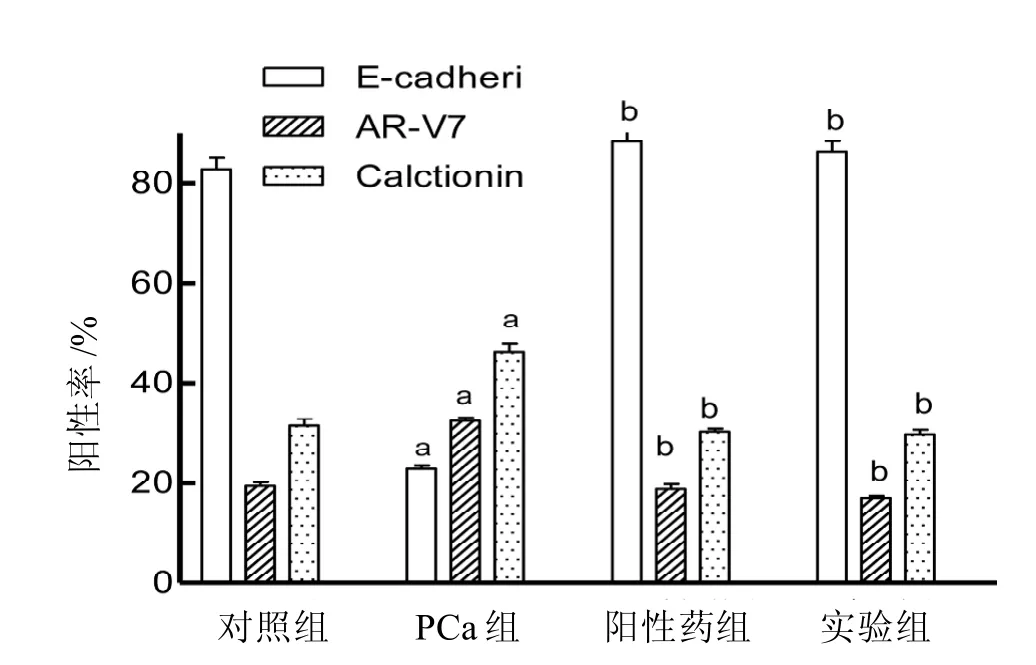
图 1 治疗后4组裸小鼠前列腺瘤体中Calctionin、AR-V7、E-cadherin阳性率
2.3 前列腺瘤体中p-AR、P13K和p-Akt蛋白表达
PCa组前列腺组织p-Akt、P13K和p-AR均高表达, 与对照组比差异有统计学意义(t=11.369, 6.250,8.254,P<0.05)。阳性药组和实验组前列腺组织p-Akt、P13K和p-AR均低表达,与PCa组比差异有统计学意义(t=9.021,10.365,7.286,P<0.05)。实验组与阳性药组组间比较差异无统计学意义(t=0.150,0.322,0.144,P>0.05)(图 2)。

图 2 治疗后4组裸小鼠前列腺瘤体中p-AR、P13K和p-Akt相对表达
3 讨论
PI3K/Akt信号通路作为细胞胞存活及增殖的经典传导通路,在细胞凋亡、生长、增殖和血管生成中起着关键性的生物学功能、参与多种肿瘤的发生和发展[12]。PCa的发展和恶化受雄激素和AR信号调节, 雄激素与AR结合会进一步激活PI3K/Akt信号通路,刺激PCa细胞的增殖,但PI3K/Akt信号通路也受其相关蛋白磷酸化影响,如p-AR和p-Akt等[13-16]。研究表明,应用P13K/Akt信号通路抑制剂LY294002能抑制血管形成和肿瘤的生长[17]。由此推论:抑制AR 表达及 PI3K/AKT 信号通路下游相关蛋白磷酸化可能发挥对PCa的治疗作用。现代药理学研究表明,淫羊藿素具有促进间充质干细胞增殖及迁移、抗动脉粥样硬化、抗氧化、调节免疫力和抗肿瘤等功能[18,19]。也有研究发现淫羊藿素具有抑制雄激素磷酸化而降低PI3K/Akt信号通路活化,从而发挥抑制PCa移植瘤生长[20]。本研究中采用从淫羊藿全草中提取的生物碱单体淫羊藿素进行尾静脉注射来观察其对LNCaP细胞珠裸小鼠前列腺瘤体中P13K/ Akt信号通路激活及其相关蛋白磷酸化的影响。
观察表明, 实验组治疗后前列腺瘤体中P13K、p-Akt、p-AR均较模型组低(P<0.05)。这一结果提示淫羊藿素具有抑制P13K/ Akt信号通路相关蛋白磷酸化的作用,p-Akt、P13K和p-AR水平降低会诱导抗凋亡蛋白表达和磷酸化凋亡调节蛋白产生抑制细胞凋亡作用,这也是淫羊藿素抑制LNCaP增殖的主要生物学效应。阳性药组中所使用的LY294002为P13K/Akt信号通路抑制剂,与抑制剂CD147为同一类型P13K/ Akt信号通路抑制剂,对PCa细胞雄激素受体磷酸化具有阻断作用[21]。P13K基因是一种胞内磷脂酰肌醇激酶,其下游靶蛋白Akt是PI3K/Akt信号通路的核心,其磷酸化水平与肿瘤的发生、发展和转移密切相关。Akt促进肿瘤转移的机制复杂,包括降低肿瘤细胞间的黏附力,影响细胞外基质和肿瘤细胞的运动能力等。本实验中实验组p-Akt、P13K和p-AR与阳性药组组间比较无统计学意义,说明淫羊藿素也具有P13K/Akt信号通路抑制剂类似的生物学效应。从实验结果来分析,淫羊藿素可能通过抑制Akt和AR磷酸化而发挥对PI3K/Akt信号通路的抑制或阻断作用,这一生物学效应的直接结果可抑制或降低LNCaP的侵袭、转移能力,而其核心作用就是抑制或阻断细胞间这一级联通路(PI3K/Akt信号通路)之间的信号转录和传导。这与饶红等[22]和许伟等[23]的研究结果一致。另外,本研究还观察到淫羊藿素还具有提高E-cadherin、降低AR-V7和Calcitonin的作用。AR-V7为存在于PCa组织中的AR剪接变异体,AR-V7高表达常预示前列腺肿瘤复发、患者生存时间缩短,因此,AR-V7可作为评价肿瘤进展的主要指标之一[24,25]。E-cadherin属于经典的钙黏附蛋白, 与多种恶性肿瘤侵袭和转移有关, E-cadherin基因表达丧失可导致细胞间黏附力降低、进而促进肿瘤的侵袭和进展,高表达则可增强肿瘤细胞与间质细胞黏附力,抑制肿瘤细胞浸润和转移[26,27]。研究表明, Calctionin也与多种恶性肿瘤进展及感染有相关性, 可作为恶性肿瘤进展及感染的观察指标[28]。也有研究证实Calctionin过表达会促使PCa产生去势抵抗, 这又会增加PCa肿瘤侵润和转移风险[29,30]。本实验结果证实, 淫羊藿素在抑制Akt和AR磷酸化的同时, 还可通过增加E-cadherin的合成来增强肿瘤细胞与间质细胞黏附力,并通过降低Calctionin表达而产生抑制肿瘤细胞侵润和转移效应。实验组反映肿瘤进展的主要指标AR-V7及裸小鼠体质量、前列腺瘤体湿重、体积均降低,这一结果也可间接证明由LNCaP引起的PCa得到有效控制,而这一结果与淫羊藿素影响上述诸多因素有相关性。
综上所述,淫羊藿素具有抑制或阻断 LNCaP裸小鼠前列腺瘤体中P13K/Akt信号通路激活及其下游相关蛋白如AR和Akt磷酸化作用。淫羊藿素可能主要通过阻止AR和Akt磷酸化生成p-Akt、p-AR来实现抑制LNCaP侵袭和转移,使肿瘤生长受阻,在这一过程中,淫羊藿素还促进E-cadherin的合成并降低Calctionin表达,这有利于增加肿瘤细胞与基质之间的黏附力,从而发挥抗肿瘤效应并降低肿瘤侵润和转移风险。

