鞘内镇痛在难治性疼痛治疗中的应用
刘楹子 杨晓秋
(重庆医科大学附属第一医院疼痛科,重庆400016)
鞘内镇痛(intrathecal analgesia)是指将镇痛药物注入蛛网膜下腔,经脑脊液循环直接作用于脊髓、脑产生镇痛作用的技术,具有起效快、镇痛效果确切、药物用量小、药物不良反应少等优点[1],临床上在难治性癌痛及非癌痛治疗中的应用日益广泛。鞘内药物的选择、联合用药以及镇痛模式的设置是镇痛成功的关键,药物耐受性亦是难点,皆为目前研究的重点。本文主要就鞘内镇痛在难治性疼痛治疗中的应用进展作一综述,为临床合理应用此项技术提供参考。
一、鞘内镇痛概况
1.鞘内镇痛历史
1885年Leonard首次在鞘内应用局麻药镇痛,1971年Goldstein发现阿片受体,1976年Lamotte确认阿片受体位于脊髓,同年Yaksh研究证实吗啡可产生脊髓介导的镇痛作用,1979年Wang, JK采取吗啡鞘内单次注射治疗晚期癌痛取得良好效果[2]。此后,鞘内镇痛在临床应用日益广泛。
2.鞘内镇痛优势
鞘内镇痛药物可直接到达中枢神经系统,能够快速、有效、稳定地发挥镇痛作用,与口服、肌内注射和静脉镇痛相比,鞘内镇痛所需药物剂量更小,药物不良反应更少、程度更轻[1]。同时,通过鞘内药物输注系统持续鞘内给药,能够实现长期有效的疼痛控制。此外,采用病人自控镇痛(patient-controlled analgesia, PCA)方式鞘内给药,病人全程参与镇痛过程,更精确调节鞘内给药剂量、实现个体化镇痛治疗,也更符合“精准医疗”原则。
3.鞘内镇痛适应证与禁忌证:
(1)适应证:①癌性疼痛[3]:病人口服阿片类药物有效但剂量极大或不能耐受药物副作用,或病人不能口服镇痛药物,预期寿命大于6个月。②难治性非癌性疼痛[3~5],如无手术适应证的轴性颈和腰背痛、腰背部术后疼痛综合征(failed back surgery syndrome, FBSS)、复杂性区域疼痛综合征(complex regional pain syndrome, CRPS)、幻肢痛或残肢痛、带状疱疹后神经痛(postherpetic neuralgia, PHN)、周围缺血性疼痛、脊髓损伤,以及其他如慢性难治性心绞痛、肌强直和痉挛等:传统治疗方法疼痛控制不佳(中重度疼痛)、不适合进一步保守治疗或其它手术或介入治疗,心理学评估可耐受。
(2)禁忌证:药物依赖或成瘾,心理状态不稳定,药物输注系统植入禁忌证如脑及椎管内占位病变、严重全身或局部感染、脓毒血症、凝血功能障碍等[5]。
二、鞘内镇痛常用药物
因药物理化性质与神经毒性等原因,能用于鞘内镇痛的药物种类较少。吗啡和齐考诺肽是美国食品药物管理局(food and drug administration, FDA)批准用于鞘内镇痛的药物[4],而氢吗啡酮、可乐定等药物虽无FDA批准,但因有较高的循证医学证据等级、有多国指南及多学科疼痛专家共识会议(polyanalgesic consensus conference, PACC)推荐于鞘内使用[4]。2012年,PACC根据神经痛与伤害性疼痛作了鞘内药物分级推荐[4],包括阿片类药物、局麻药、α2受体激动剂、钙通道阻滞剂、γ-氨基丁酸激动剂等。2016年PACC将其整合后以癌性疼痛与非癌性疼痛、局灶性疼痛与弥漫性疼痛的分类又作药物分级推荐(见表1~4)。2016年药物推荐较2012版在一线、二线上无太大变化,三线、四线药物因2016年新的分类方式而部分作出调整,且2016年增补部分五线、六线药物。

表1 2016年PACC癌性弥漫性神经痛或伤害性疼痛药物推荐[3]

表2 2016年PACC癌性局灶性神经痛或伤害性疼痛药物推荐[3]

表3 2016年PACC非癌性弥漫性神经痛或伤害性疼痛药物推荐[3]

表4 2016年PACC非癌性局灶性神经痛或伤害性疼痛药物推荐[3]
1.阿片类药物
吗啡、芬太尼、舒芬太尼、氢吗啡酮是治疗难治性疼痛鞘内最常使用的阿片类药物,因其化学性质不一,药理学特点各异,镇痛效果也有较大差别。
(1)吗啡:吗啡是唯一被FDA批准用于鞘内的阿片类药物,也被PACC列为鞘内一线药物[3]。吗啡为亲水性,随脑脊液循环鞘内作用范围广泛,但起效慢,作用时间长。吗啡是鞘内药物镇痛的金标准,鞘内输注1 mg吗啡相当于硬膜外给药10 mg、静脉注射100 mg或口服300 mg,据此可将病人口服或静脉吗啡剂量换算为鞘内给药剂量[1]。即便曾口服或静脉使用大量阿片类药物疗效欠佳的病人,部分病人脊髓阿片受体对阿片类药物未完全脱敏,鞘内使用吗啡亦可有良好的镇痛效果[6]。吗啡常见不良反应包括呼吸抑制、轻度镇静、恶心、呕吐、皮肤瘙痒及尿潴留等。呼吸抑制最为严重,主要发生在刚开始使用和停药后再使用时[7]。故在鞘内使用吗啡时应根据PACC推荐剂量使用[3]。由于鞘内用药剂量远小于全身药量,不良反应较全身给药明显降低。
(2)芬太尼与舒芬太尼:芬太尼与舒芬太尼均属亲脂性药物,进入脊髓时,同时与白质内非特异性位点和后角内特异性受体结合,起效快,但因其作用时间短、范围局限,故对于癌痛治疗仅作为三线以上用药。但在非癌性局灶性疼痛中被列为一线用药[3],其常见的不良反应同吗啡。
(3)氢吗啡酮:一种半合成的阿片类受体激动剂,吗啡衍生物,亲水性弱于吗啡,镇痛作用是吗啡的5~10 倍,通过激动中枢神经系统μ阿片受体起镇痛作用,也作用于部分δ受体,但是不作用于κ、σ、ε受体[8]。鞘内注射后随脑脊液流动作用范围较广泛,常用于对吗啡耐受或不良反应较严重的病人,在癌痛与非癌性弥漫性疼痛中被列为一线用药[3]。其常见不良反应包括胃肠道反应和中枢神经系统反应,如便秘、恶心、呕吐、头痛、皮肤瘙痒等[8]。
此外,痛觉过敏是鞘内长期使用阿片类药物不常见但后果严重的并发症之一[7],降低阿片类药物剂量或与非阿片类药物联合用药可改善该症状。
2.局麻药
局麻药在脑脊液中扩散直接作用于脊髓,通过结合电压门控性Na+通道,阻止动作电位产生和神经冲动传导产生镇痛作用,但能用于鞘内的局麻药物种类较少。
(1)布比卡因:属酰胺类局麻药,具有亲水性,作用范围较广,持续时间长,相比其它局麻药有较长的感觉阻滞和更少的运动阻滞[9],是鞘内最常用的局麻药。2016年PACC仍在癌痛或非癌痛中将其列为一线的辅助用药,多与阿片类药物联合运用,也是目前鞘内使用最多的局麻药[3]。
(2)罗哌卡因:同属酰胺类局麻药,在阻滞起效时间、阻滞效果和镇痛持续时间方面接近布比卡因,但没有获得FDA批准的鞘内给药标签,而中国食品药品监督管理局(china food and drug administration, CFDA)批准了罗哌卡因用于鞘内镇痛。
(3)丁卡因:获得了FDA和CFDA在鞘内使用的许可,但因其易产生毒性反应,故2012与2016版PACC均未推荐该药用于鞘内镇痛。
局麻药常见不良反应包括感觉障碍、运动障碍、低血压、尿潴留等,通常与药物浓度和用药的脊髓节段相关[9],在滴定时应监测病人并及时做出药量调整。但由于安全性和有效性的信息不足,长期连续鞘内给局麻药和使用其他局部麻醉剂的经验有限,故局麻药在鞘内的应用还需更长期深入的研究。
3.α2受体激动剂
可乐定是α2受体激动剂中主要能用于鞘内的药物[4],通过与脊髓背角α2受体结合,调节有害感觉传递产生镇痛作用,2016 PACC推荐为伤害性疼痛和神经痛的辅助用药[7]。可乐定鞘内使用优势是无呼吸抑制、尿潴留、胃肠道反应、瘙痒和感觉运动阻滞[7],常见副作用包括低血压、心动过缓、镇静及口干等[10],2016年PACC指出,可乐定在滴定和持续泵注时应频繁监测病人血压及心率[11]。目前还没有可乐定鞘内给药的安全性和耐受性的高等级证据,故临床使用中仍须谨慎。
4.钙通道阻滞剂
齐考诺肽是N -型钙通道的脊神经节高度选择性的阻滞剂,也是唯一可用于鞘内镇痛的该类药物,其需直接经脑脊液给药才会有疗效。FDA批准其为治疗慢性疼痛鞘内药物,且只能鞘内使用。2016年PACC提出齐考诺肽有很强的临床证据证实其有效性,并推荐为部分难治性疼痛病人的一线药物[3]。其优点在于可突然停药而无撤药症状。不良反应通常与应用较高的初始剂量、用量迅速升级或两方面同时存在,包括严重的头晕、恶心、记忆力减退、眼球震颤、精神错乱、步态失调、便秘、尿潴留等[12],当发生明显不良反应时应将剂量减半[7]。
Staats等[13]对鞘内注射齐考诺肽在难治性癌痛和艾滋病疼痛进行一项双盲、安慰剂对照的多中心临床试验,研究组有超过25种类型癌症,结果表明齐考诺肽组与安慰剂组相比可获得两倍以上的疼痛缓解,不良反应有认知与精神障碍。且齐考诺肽能加重精神疾病的精神症状,不推荐齐考诺肽用于既往有精神错乱病史的病人[14]。
5.γ-氨基丁酸激动剂
巴氯芬是此类药物的代表,系γ-氨基丁酸B受体激动剂,通过增加钾电导引起的二级神经元超极化,抑制钙离子通过电压门控钙通道产生镇痛作用[12]。FDA批准其用于鞘内泵注,主要用于治疗痉挛性疾患,在疼痛合并痉挛时可作为辅助剂,并在临床研究中已获得不同程度的进展[3]。但该类药物在治疗癌症疼痛的作用有限,目前没有足够的研究数据证明其有效性。巴氯芬鞘内使用的副作用包括无力、肌张力低下、镇静、便秘、勃起障碍、括约肌控制障碍,呼吸抑制等[12],且巴氯芬有很强的撤药反应,应逐渐减量至停用[3]。
6.药物的剂量及浓度
2016年PACC建议鞘内药物的起始剂量、测试剂量和每日最大剂量以及药盒最高浓度较2012版有部分更新[3],氢吗啡酮起始剂量、吗啡测试剂量均下调,并明确给出了芬太尼、舒芬太尼每日最大剂量(见表5)。
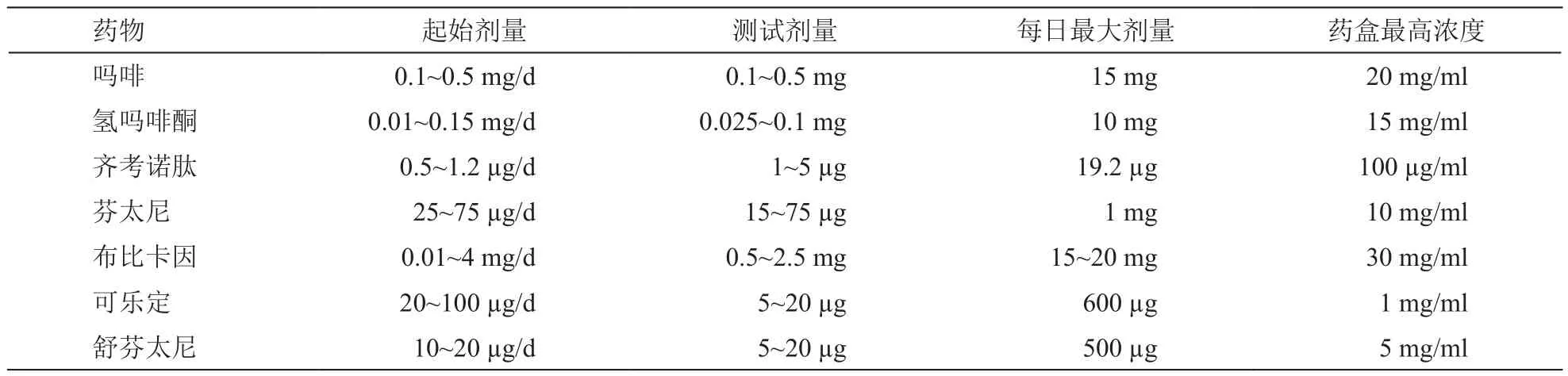
表5 2016年PACC鞘内镇痛的药物剂量和浓度[3]
三、鞘内镇痛技术实施要点
不同鞘内镇痛装置、镇痛药物的选择与滴定及PCA镇痛模式均可影响鞘内镇痛疗效。鞘内镇痛可采取鞘内单次药物注射与鞘内药物连续输注给药,鞘内单次药物常用于测试病人鞘内使用药物的疗效。鞘内连续镇痛则是通过鞘内药物输注系统(implanted drug delivery system, IDDS)持续给药实现。
1.鞘内镇痛药物滴定
2016年PACC提出病人初次接受滴定药物应为FDA批准鞘内使用的药物,首先从单一药物滴定,若需行混合制剂滴定,应遵循2016年PACC推荐剂量[11]。应从小剂量开始逐渐滴定至有效镇痛剂量,同时全面评估疗效、耐受性、安全性。药物滴定方式包括口服、静脉PCA、硬膜外与鞘内的单次或连续给药。然而部分专家[4]认为,硬膜外与鞘内的单次或连续给药对于某些病人是不恰当的,如预计生存期较短的病人、免疫功能低下的病人等。目前临床常用方式多为口服或静脉给药滴定,再换算为鞘内用药剂量。通常当病人的疼痛缓解程度≥50%,且没有难以耐受的不良反应时,即视为滴定获得满意效果。
2.鞘内镇痛装置选择
常用的IDDS装置分为两种[15],全植入式鞘内药物输注系统和半植入式鞘内药物输注系统。全植入式系统优点包括病人感染风险相对较低、舒适度高、植入后管理便捷,但因其局部创伤相对较大,药物储存量较小,联合用药受限,费用较高,故更适用于预计生存期大于6个月的难治性疼痛病人。半植入式系统创伤较小、药物储存量大、费用较全植入式低,但因其感染风险较高,植入后管理难度较大,病人便捷度稍差,故更适宜于预计生存期较短的癌痛病人和难治性非癌痛的短期治疗。
3.穿刺间隙与鞘内导管尖端位置的确定
脊椎穿刺间隙及鞘内导管顶端最佳位置的相关研究数据有限,2016年PACC建议应根据病人疼痛部位或引起疼痛的病变部位决定[3]。通常从低位穿刺点(L2-3以下)穿刺后植管,将鞘内导管顶端放置到相应的位置(见表6)。但在特殊情况下(如颈肩胸背部疼痛),可根据脊髓节段对应的椎骨来选择穿刺点。

表6 疼痛部位与鞘内导管顶端位置关系
4.鞘内镇痛给药模式
Pope 等[16]研究发现,临床上鞘内镇痛PCA常用给药模式为背景剂量与单次追加剂量的联合应用,但提出如果仅使用单次追加剂量,可减少药物使用总量、降低肉芽肿发生率以及因病人逐渐耐药所致药物剂量增加的概率。我们通过检索多个数据库后,发现目前关于鞘内镇痛PCA模式选择的临床研究较匮乏,此可为今后研究方向。
5.鞘内镇痛不良反应与预防
与药物相关的不良反应有皮肤瘙痒、恶心呕吐、尿潴留、便秘、呼吸抑制等。Krakovsky的研究表明[17],绝大多数病人的主要并发症是药物相关的不良反应。Carvalho的研究也证实[18],药物相关不良反应的程度与药物剂量大小有关,如逐渐增大吗啡剂量在镇痛效果上没有明显提升,但药物不良反应发生率却增高。因此,鞘内镇痛药物的合理运用与新药研发是提高安全性、有效性并降低鞘内镇痛不良反应与并发症的关键之一。
2012年PACC已提出吗啡相关导管尖端肉芽肿相应解决方案[2],2016年PACC又指出除吗啡外,氢吗啡酮、布比卡因、舒芬太尼、巴氯芬、曲马多在输注时均可能导致肉芽肿[7],而齐考诺肽与肉芽肿没有关联[7]。肉芽肿可能因高浓度的药物长时间滞留在导管尖端区域未随脑脊液流动所致[7]。
与穿刺置管及IDDS相关的并发症有椎管内出血、血肿、感染、神经损伤、导管堵塞、仪器故障等。严格掌握适应证、按照鞘内镇痛技术规范实施操作、遵循无菌原则、病人镇痛全过程规范化操作与管理均能降低穿刺置管及IDDS并发症的发生。
四、鞘内镇痛的临床应用
1.难治性癌性疼痛
癌痛是临床上最常见、最痛苦的疼痛综合征之一。在WHO“三阶梯镇痛”方案及原则指导下,大多数癌症病人疼痛情况有所改善,但仍有15%的癌症病人为难治性癌痛。尤其在疾病晚期,常规镇痛治疗手段疗效不佳并出现难以耐受的不良反应,急需更多的疼痛管理模式更快更好地控制疼痛。采用IDDS镇痛是晚期癌痛病人又一种治疗选择,同时也在临床应用中取得较好的疗效。
Mastenbroek等[19]对9名患有严重难治性癌痛、对常规疼痛治疗效果不佳或不能耐受副作用的病人采用鞘内镇痛进行回顾性研究,观察病人鞘内使用吗啡、布比卡因和可乐定的疗效和副作用,记录鞘内镇痛治疗启动前、启动时、出院时、在门诊治疗时及死亡前病人的疼痛评分与副作用。结果显示,与治疗前相比,治疗刚启动时、出院时、在门诊治疗时病人疼痛数字评分法(numerical rating scale,NRS)评分平均降低66%,在死亡前几天,50%的病人仍无明显疼痛。鞘内镇痛期间无重度低血压、呼吸抑制和神经功能障碍等严重不良事件,3例病人出现轻度低血压,调整可乐定剂量后逐渐改善,3例病人出现下肢无力,经调整布比卡因剂量后,2例症状消失、1例下肢无力被证实因肿瘤压迫脊髓所致。故作者认为鞘内镇痛对晚期癌症难治性癌痛病人安全、有效。
Zheng等[20]对53例顽固性癌痛或出现了不可耐受镇痛药物相关不良反应的病人进行了前瞻性队列研究,病人均接受IDDS治疗,给予吗啡与罗哌卡因混合溶液镇痛。评估病人在入院期、滴定期、随访时间至死亡的NRS评分、综合毒性评分、生活质量评分、全身使用阿片类药物剂量(基础剂量和爆发痛时追加剂量),鞘内吗啡使用剂量(基础剂量和爆发痛时自控追加剂量),并记录并发症,评价鞘内镇痛疗效与安全性。在治疗开始和所有后续随访中,病人NRS评分和综合毒性评分均显著降低,生活质量评分在治疗后明显改善,在随访期全身使用阿片类药物基础剂量和追加剂量均显著下降。在整个研究期间,鞘内吗啡剂量有轻度的增加,无感染、设备相关及导管相关的并发症。
Kiehelä等[21]对 2004年 12月至 2009年 12月五年内在赫尔辛基大学医院进行鞘内或硬膜外镇痛的所有难治性癌痛病人作回顾性研究(n= 60)。44例病人采用鞘内注射(intrathecal, IT),16例病人采用硬膜外注射(epidural, EP)。IT组和EP组分别有70%和50%的病人获得良好镇痛效果,有83%的病人经鞘内镇痛治疗后,全身性阿片类药物可停用或明显减少用量。
黄明等[22]自2013年11月至2015年2月观察了9例采用IDDS持续鞘内吗啡治疗、VAS评分≥7分的难治性癌痛病人的镇痛疗效、爆发痛发作次数、镇痛药物服用剂量及不良反应情况,随访5月~13个月。治疗后1天、14 天,1月 、3月病人VAS评分分别为3.11±1.12分、2.05±1.62分、1.88±0.97分、1.92±1.03分,较治疗前(8.14±1.47分)明显降低,差异有统计学意义(P< 0.05) ;治疗后各观察时间点疼痛缓解总有效率分别为88.9%、88.9%、100%、100%。随访期间均未发生手术相关并发症及吗啡不良反应。
此外,控制癌痛病人的爆发性疼痛(break through pain, BTP)也是提高癌症病人生存质量的关键之一。Brogan等[23]完成了98例难治性癌性疼痛病人的问卷调查,58例病人被纳入使用鞘内镇痛的研究组,问卷包括安德森症状评估量表和鞘内泵植入术前后BTP的情况。结果显示鞘内镇痛病人最高NRS疼痛评分从镇痛前的8.32 (SD, 1.73)下降到4.98(SD, 2.92,P< 0.001),疼痛评分大于7分的病人占比从84.2%下降到35.2% (P< 0.001)。病人平均每日吗啡剂量从805.3 mg降到128.2 mg,65.5%病人停止使用非鞘内阿片类药物。95%病人在鞘内镇痛前存在明显的BTP,使用鞘内镇痛后减少至75% (P< 0.013)。且Brogan等人发现鞘内药物治疗对BTP的镇痛起效速度是传统给药途径的3倍。
2.慢性非癌性疼痛
鞘内镇痛在难治性非癌性疼痛病人中的应用也越来越多,与传统的镇痛模式相比,有着良好的镇痛效果和更少的药物不良反应。Raphael等[24]评估使用IDDS鞘内注射吗啡在慢性非癌性疼痛病人中的疗效,证明了该疗法在治疗慢性非癌痛病人的有效性与安全性。
(1)腰背部及下肢疼痛
Duarte等[25]对20例IDDS植入治疗非癌性疼痛病人进行了平均13.5年的随访研究,大多数病人(85%)疼痛部位是腰背部,大部分(60%)为腰背部术后疼痛综合征(failed back surgery syndrome,FBSS),其他疼痛部位还包括腹部、下肢。40%病人为伤害性疼痛,其余60%为伤害性与神经病理性混合性疼痛。鞘内用药主要为阿片类药物,部分病人联合使用小剂量局麻药。对病人的疼痛强度、疼痛缓解情况、生活质量等进行评估。在鞘内镇痛后,病人疼痛强度明显下降,生活质量明显改善,在平均4年和平均13.5年之间的评估没有统计上的显著变化。本研究认为IDDS在慢性非癌性疼痛的治疗中以及在成为慢性非癌性疼痛病人终身疼痛管理方案中都具有极大潜力。
(2)带状疱疹后神经痛(postherpetic neuralgia,PHN)
朱彤等[26]选择40例PHN病人。随机双盲分为两组:A组(口服吗啡20 mg/d,n= 20),B 组(鞘内吗啡组,n= 20)。记录治疗前和治疗后1天、3天、7天、15天、30天及90天时病人VAS评分,观察两组住院期间日最大吗啡量及第90天的吗啡量,记录常见不良反应发生例数及处理。结果表明,与口服吗啡组相比,鞘内吗啡组病人治疗后在观察时间内VAS评分明显降低(P< 0.001),发生嗜睡及便秘明显减少(P< 0.05),尿潴留者明显增加(P< 0.05)。本研究认为,疼痛剧烈、口服镇痛药物效果不佳或不能耐受药物不良反应的PHN病人,可酌情选IDDS输注吗啡治疗,尽快控制病人疼痛,改善生活质量。
(3)复杂性区域疼痛综合征(complex regional pain syndrome, CRPS)
Bahl等[27]报道了一例诊断CRPS表现有周期性局灶性肌张力障碍的15岁女性病人,经过3年局部及全身药物及物理治疗后未能取得满意的效果,仍因左足肌张力障碍导致左足痉挛和疼痛。病人接受了IDDS植入并持续输注巴氯芬,治疗后肌张力障碍得到解决,疼痛明显缓解,可参加体育和舞蹈活动。
(4)角膜神经性疼痛
Sayegh等[28]报道了一例32岁女性病人,在准分子激光原位角膜磨镶术后出现顽固性双侧干眼症和角膜神经痛,给予眼部和全身药物镇痛治疗均未取得明显效果,植入三叉神经节电极电刺激后疼痛完全缓解,但停用电刺激疼痛复发。故在病人寰枢椎水平植入鞘内药物输注系统持续输注小剂量芬太尼和布比卡因,病人疼痛控制良好,缓解超过1年。
五、总结与展望
多种疼痛性疾病可导致病人长期、剧烈、难治性疼痛,包括晚期癌痛及某些非癌痛(如PHN、FBSS等),鞘内镇痛治疗明显缓解病人疼痛、促进身体机能恢复、提高生存质量,值得临床推广应用。但鞘内镇痛技术仍有许多需要进一步深入研究与改进之处,如寻找可安全有效应用于鞘内的新型镇痛药物,不同药物间合理配伍以提高镇痛效果减轻药物不良反应,远程联网实时监测并调控病人的镇痛方案以实现更好的个体化镇痛等等。相信随着研究的进展,鞘内镇痛技术在临床的应用,有望得到拓展。
——吗啡

