唑来膦酸对女性骨质疏松病人的疗效观察及对骨代谢物的影响*
代月娥 刘 柳 文传兵 杜 宇 林 涛 江 平 吴 莹
(四川省医学科学院· 四川省人民医院疼痛科,成都 610072)
骨质疏松症 (osteoporosis, OP) 是一种以骨量下降,骨微结构损坏,骨脆性增加,易发生骨折为特征的全身性骨病。原发性骨质疏松症主要包括绝经后骨质疏松症和老年骨质疏松症[1]。骨质疏松症的严重后果是发生骨质疏松性骨折,从而导致病人的病残率和死亡率增加。我国绝经后原发性骨质疏松症女性病人普遍存在,据调查显示50岁以上女性骨质疏松症占总患病率为26.7%,随着年龄增长,发病率以每10年20%的增长率增高[2]。唑来膦酸作为第三代双膦酸盐类抗骨质疏松药物,已被用于治疗女性绝经后骨质疏松症[3],但目前尚缺乏对唑来膦酸输注不同时间段的临床疗效对比以及对骨代谢指标影响的文献报道。本研究通过回顾性分析我院2013年至2016年女性原发性骨质疏松病人应用唑来膦酸治疗不同时间段后的骨密度和骨代谢标志物的变化,评价该药物不同疗程对女性骨质疏松病人的临床疗效和骨代谢的影响,指导临床用药。
方 法
1.一般资料
经四川省人民医院伦理委员会批准,收集2013年8月至2016年8月我院疼痛科290例有完整资料的使用唑来膦酸的女性骨质疏松症病人,入院后使用唑来膦酸抗骨质疏松治疗3年以上病人79例(胸椎压缩性骨折38例,腰椎压缩性骨折9例,胸腰椎压缩性骨折13例)。使用唑来膦酸抗骨质疏松治疗2年以上病人94例(胸椎压缩性骨折46例,腰椎压缩性骨折9例,胸腰椎压缩性骨折11例)。使用唑来膦酸抗骨质疏松治疗1年以上病人117例(胸椎压缩性骨折54例,腰椎压缩性骨折12例,胸腰椎压缩性骨折18例)。
纳入标准:参照世界卫生组织 (WHO) 推荐的原发性骨质疏松症诊断标准,双能X线骨密度仪(DXA) 检测骨密度T值≤ -2.5 及/或已发生脆性骨折的女性骨质疏松症病人[4]。
排除标准:严重的血液系统疾病、骨髓增生性疾病(如多发性骨髓瘤)和恶性肿瘤转移者;甲状旁腺功能亢进者。
2.方法
所有入选病人手术或非手术治疗均在入院后排除禁忌证后使用唑来膦酸5 mg(商品名:密固达,北京诺华制药有限公司,规格5 mg/100 ml)静脉滴注,1次/年;另每天补充骨化三醇胶丸0.25 μg,每日2次(罗盖全,上海罗氏制药有限公司,规格0.25 μg)、钙尔奇D 600 mg,每日1次(美国惠氏制药有限公司,规格为元素钙600 mg + 维生素D 125 IU)。骨密度检查所用设备为美国lunar公司的DPX-Bravo双能X线骨密度仪器( DXA) ( Lunar Prodigy Advance, GE公司,美国),操作人员均为固定的正规培训后的放射科医师。所有输注唑来膦酸的病人在治疗前后均行骨密度、骨代谢标志物、肝肾功能检查。唑来膦酸5 mg 静脉滴注时间120 min,使用前给予生理盐水500 ml静滴扩容,以及葡萄糖酸钙1 g缓慢静推预防过敏;使用后给予生理盐水100 ml 静滴冲洗管道,首次使用唑来膦酸病人当晚嘱复方酚咖伪麻胶囊(力克舒,成都恩威制药有限公司,规格复方制剂,每粒含对乙酰氨基酚150 mg,马来酸氯苯那敏1.25 mg,盐酸伪麻黄碱15 mg,咖啡因12.5 mg等)2粒口服预防肌肉酸痛等流感样症状,用药前及用药后嘱病人多饮水以促进药物排泄、减少肾脏毒性的发生。
3.观察及评价指标
(1)骨密度测定:采用双能X线骨密度仪DXA测定治疗前后所有病人腰椎L1-4和左髋部(股骨颈、大粗隆、股骨干)的骨密度值。
(2)骨代谢标志物水平的检测:采用德国罗氏诊断公司提供的骨代谢检测试剂盒,应用电化学发光免疫分析技术检测所有病人治疗前后的血清骨代谢指标总I型胶原氨基端延长肽 (P1NP) 、25 羟基维生素D、β-胶原降解产物测定 (β-CTX)、骨钙素N端中分子片段 ( N-MID) 的水平,以肝素抗凝真空采血管取病人空腹外周静脉血5 ml,所有血样标本送我院检验科进行检测分析。
(3)血钙、血磷、尿素氮(BUN)、肌酐(Cr) 测定:分别于治疗前后检测以上指标,所有血样标本送我院检验科进行检测分析。
(4)不良反应:主要观察记录病人出现包括发热、肌肉软组织疼痛、骨关节疼痛等流感样症状的例数,以及使用药物后出现恶心、呕吐、乏力及心律失常等症状的例数。本研究中发热定义为:输注密固达前体温为基础体温,使用后较基础体温升高0.5℃。肌肉软组织疼痛、骨关节疼痛定义为:输注密固达后原部位疼痛加重或新出现部位的疼痛。
(5)观察新发骨折情况:三组病人于治疗后一年内分别统计病人再次发生脆性骨折或新发骨折的例数,并行相应部位的X线或MRI检查,验证有无新发骨折。
4.统计学处理
应用SPSS 19.0 统计学软件进行统计分析,计量资料以均数±标准差(±SD)表示,组间比较采用单因素方差分析,组内比较采用重复测量因素的方差分析,计数资料采用X2检验;P< 0.05为差异有统计学意义。
结 果
1.治疗不同年组的病人治疗前后骨密度值比较
与治疗前比较,治疗不同年组的原发性女性骨质疏松症病人腰椎( L2、L3、L4、L1-4)和髋部骨密度值均增加,有统计学差异 (P< 0.05),其中,唑来膦酸治疗3年组病人的腰椎和髋部骨密度值明显高于治疗1年组和治疗2年组的病人,有统计学差别(P< 0.05,见表1)。
表1 病人治疗前、后骨密度值的比较(±SD)

表1 病人治疗前、后骨密度值的比较(±SD)
*P < 0.05,与治疗前比较,#P < 0.05,与治疗1年组比较;△P < 0.05,与治疗后2年组比较
腰椎( g /cm2)L1 L2 L3 L4 L1-4治疗前 290 0.644± 0.140 0.554±0.137 0.613±0.152 0.642±0.142 0.615±0.151时间 例数治疗1 年组 117 0.712± 0.153* 0.628±0.151* 0.698±0.165* 0.761±0.163* 0.726±0.167*治疗2 年组 94 0.756± 0.162* 0.672±0.141* 0.725±0.164* 0.803±0.156* 0.757±0.172*治疗3年组 79 0.859± 0.165*#△ 0.811±0.152*#△ 0.847±0.167*#△ 0.879±0.174*#△ 0.867±0.171*#△髋部( g /cm3)股骨颈 大粗隆 股骨干 全部治疗前 290 0.528±0.154 0.318±0.157 0.499±0.149 0.452±0.163时间 例数治疗1 年组 117 0.617±0.151* 0.398±0.160* 0.597±0.158* 0.571±0.167*治疗2 年组 94 0.661±0.155* 0.428±0.165* 0.611±0.165* 0.617±0.173*治疗3年组 79 0.792±0.163*#△ 0.518±0.168*#△ 0.759±0.157*#△ 0.722±0.168*#△
2.治疗不同年组的病人治疗前后骨代谢标志物水平的比较
与治疗前比较,治疗1、2、3年组的原发性女性骨质疏松症病人血清中P1NP、β-CTX、N-MID水平均明显下降,有统计学差异 (P< 0.05) ;25羟基维生素D水平明显升高,有统计学差异 (P< 0.05)。治疗3年组、2年组、1年组的骨代谢标志物和25羟基维生素D水平之间变化不明显,无统计学差异(P> 0.05,见表2)。
表2 治疗前、后骨代谢标志物水平的比较(±SD)

表2 治疗前、后骨代谢标志物水平的比较(±SD)
*P < 0.05,与治疗前比较
组别 例数 P1NP (ng /ml) β-CTX (ng /ml) N-MID (ng /ml) 25- (OH)D (ng /ml)治疗前 290 45.258±25.652 0.394±0.176 18.325±8.296 16.162±9.216治疗1年组 117 30.164±16.763* 0.124±0.046* 14.916±4.683* 22.726±8.418*治疗2年组 94 29.713±14.167* 0.121±0.028* 14.169±3.536* 23.317±8.673*治疗3年组 79 28.154±11.271* 0.122±0.029* 13.465±2.857* 23.673±9.362*
3.治疗不同年组病人治疗前后血钙、血磷、BUN、Cr水平比较
与治疗前比较,治疗后各组病人血钙、血磷、BUN、Cr水平均无明显变化 (P> 0.05,见表3)。
表3 治疗前、后血清指标水平的比较 (±SD)

表3 治疗前、后血清指标水平的比较 (±SD)
组别 例数 Ca (mmol /L) P (mmol/L) BUN (mmol /L) Cr (umol /L)治疗前 290 2.29±0.24 1.07±0.24 5.24±1.42 59.2±9.2治疗1年组 117 2.28±0.22 1.09±0.27 5.26±1.39 58.5±9.5治疗2年组 94 2.30±0.21 1.12±0.26 5.31±1.46 61.7±9.7治疗3年组 79 2.24±0.25 1.10±0.27 5.25±1.37 60.9±10.3
4.病人输注唑来膦酸后不良反应发生情况
输注药物治疗3年组病人79例,观察到31例发热、37例肌肉酸痛;治疗2年的病人94例,观察到38例发热、43例肌肉酸痛;治疗1年的病人117例,观察到46例发热、55例肌肉酸痛,三组间不良反应发生率无统计学差异 (P> 0.05,见表4)。上述不良反应大部分在药物使用后3d内出现,症状持续1~3 d,未见不适症状反复的病人。治疗期间所有病人未出现下颌骨坏死、肾衰竭、恶性心律失常、休克等严重并发症。
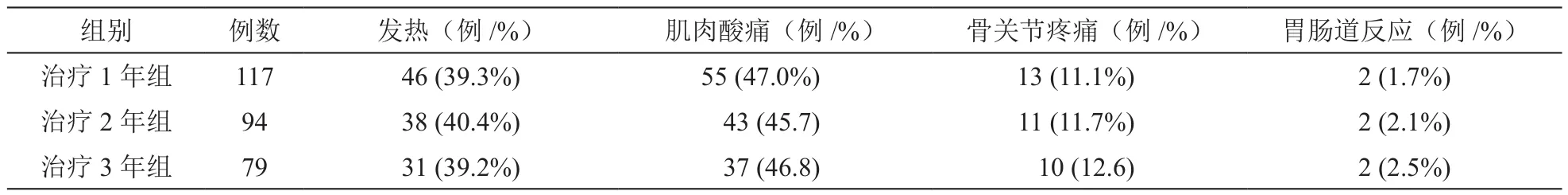
表4 不同治疗时间段内发生不良反应的百分比比较(例/%)
5.治疗不同年组病人新发骨折情况
治疗3年组共有2例病人在治疗期间发生新发骨折;2年组有3例病人在治疗期间发生新发骨折;1年组有3例病人在治疗期间发生新发骨折。
讨 论
原发性绝经后女性骨质疏松症病人,其发病机制主要是以绝经后妇女的雌激素分泌明显减少,引起的破骨细胞活性增强,导致骨吸收大于骨形成的高转换型的OP[5]。所以针对破骨细胞活性增强这一骨质疏松发生的关键机制,目前循证医学研究最全面、临床应用最广泛的抗骨重吸收类药物即双膦酸盐类[6,7]。唑来膦酸是经静脉应用的第3代双磷酸盐。对于原发性骨质疏松,国外多项研究均表明,唑来膦酸能显著提高绝经后女性腰椎和髋部骨密度,降低腰椎、髋部骨折和新发骨折的风险[8,9]。本研究发现输注唑来膦酸的女性绝经后病人,输注时间越长的病人其骨密度改善越明显,发生新发骨折的病人比例也明显降低。
既往有研究表明,唑来膦酸5 mg每年1次连续静脉输注3年疗程后,腰椎骨折发生率降低70%、髋部骨折发生率降低40%[10]。本研究显示唑来膦酸治疗1年就能提高原发性骨质疏松女性病人腰椎及髋部的骨量,而治疗3年的病人其腰椎及髋部的骨量明显增加,新发骨折的发生率明显减少,这与国外相关研究结论一致。进一步分析使用不同疗程后各部位骨密度变化,我们发现对于原发性女性骨质疏松症病人,相比髋部骨密度,唑来膦酸更能明显改善其腰椎骨密度。提示我们应用唑来膦酸抗骨质疏松对于降低腰椎骨折风险的作用更为确定。在治疗过程中有病人发生新发骨折,进一步分析这几位病人均在使用唑来膦酸1年时未及时行第二次药物治疗的情况下发生,但随用药疗程的增加我们发现输注唑来膦酸2次后的再发骨折风险明显降低,也提示连续输注唑来膦酸才能更好的降低骨折风险。
BMD是诊断原发性骨质疏松症的“金标准”[11]。但骨密度在治疗后短期内难以得到改善,而骨代谢标志物常能在短期内反映治疗效果。所以骨转换指标被认为是应用抑制骨吸收药物双膦酸盐治疗OP病人最佳的短期监测标志物[12,13]。有研究证实,应用抑制骨吸收药物6个月即能明显影响骨转换指标,β-CTX、P1NP、N-MID 会显著下降[14]。本研究回顾性分析了不同治疗时间的女性骨质疏松症病人应用唑来膦酸治疗后骨代谢标志物的变化情况。我们发现,使用唑来膦酸治疗1年病人的P1NP、β-CTX、N-MID 水平均明显下降,与输注2、3年之间无明显显著性差异。这说明,使用唑来膦酸治疗后其骨代谢标志物均会在短时间内明显降低,最后趋于缓慢降低或维持一个较低的水平。
维生素D在原发性OP发病机制中起更重要的作用有关,维生素D缺乏在原发性OP中表现更明显。本研究发现,所有病人治疗前其25羟基维生素D水平均较低,在应用唑来膦酸治疗后,三组病人 25羟基维生素D水平较治疗前明显升高。因中国饮食和生活习惯,所有输注唑来膦酸病人均参考指南每日补充0.5 μg骨化三醇胶囊,确保维持病人的维生素D正常水平[15]。
本研究结果显示,所有输注唑来膦酸的病人,其不良反应主要是发热、肌肉骨关节疼痛,绝大多数在用药前3天出现,1至3天后好转;我们观察到,三组病人的不良反应发生率总体之间无明显差异,这和临床上观察到的一致[16],即初次使用病人的不良反应发生率最高,再次输注唑来膦酸其不良反应不明显。本研究所有病人总体耐受性良好,发热、肌肉酸痛等不良反应发生率略高于国内外报道[17,18],分析原因与我们在输注前未预防性使用非甾体消炎药、使用非甾体药物的时机不同、本研究中所定义的发热、疼痛有一定的关系,这也提示我们以后在临床工作中可进一步观察非甾体药物使用时机与输注唑来膦酸的时间之间是否存在相关性。三组病人均未出观察到严重并发症,表明唑来膦酸作为抗骨质疏松药物具有良好的安全性,而且与本科室常规加强用药前的预防措施、强调水化、预防抗过敏药物的应用有关。
总之,唑来膦酸治疗原发性绝经后骨质疏松症的女性病人,能够显著增加腰椎及髋部骨密度,降低骨代谢标志物的水平,显著降低骨折风险,且总体耐受性较好。

