猪瘟病例的综合诊断及感染毒株遗传进化分析
王宏宇,李 超,孟凡亮,刘照虎,马梓承,焦秋林,李 焱,曹 龙,肖一红,刘思当
(1. 山东农业大学动物科技学院,山东泰安 271000;2. 山东省夏津县畜牧兽医局,山东夏津 253200)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种高度接触性热性传染病。急性病例以高热、神经症状、全身性出血为主要特征,并引起妊娠母猪流产、产死胎等症状,慢性病例因继发或并发细菌或其他病毒感染使症状复杂化。该病是严重危害我国养猪业的重大疫病,每年给我国养猪业造成难以估量的经济损失。该病被世界动物卫生组织(OIE)列为须通报动物疫病[1],被我国列为一类动物疫病。CSFV只有1个血清型,3个基因型。根据CSFV E2基因序列的差异性,将CSFV分为1型(1.1、1.2、1.3和1.4亚型),2型(2.1、2.2和2.3亚型)和3型(3.1、3.2、3.3和3.4亚型)3个基因型,其中2.1亚型又分为2.1a、2.1b、2.1c和2.1d[2]。
E2蛋白又称gP55,是目前CSF研究中较为清楚的一种结构蛋白,由ORF编码的370个(690~1 060)氨基酸构成。E2蛋白是CSFV主要的保护性抗原蛋白和免疫优势蛋白,能够诱导机体产生中和抗体[3],可以作为CSFV基因工程疫苗的主要靶蛋白。Risatti等[4]通过基因替换构建嵌合病毒,证明了E2蛋白与CSFV毒力存在着密切关系,从而为CSFV毒力研究提供了新思路。
现今,在以疫苗免疫接种为主要防控手段下,我国CSF疫情在一定程度上得到了控制,但因种种原因,近年来仍有发生。2018年1—6月,本实验室先后确诊了37起典型的CSF疫情,发病猪死亡率高,症状、病变典型,给发病猪场造成了严重经济损失。2018年5月,山东省菏泽市某育肥猪场发生疑似CSF疫情。为进一步探究CSFV的发展进化,对该育肥猪场死亡病例进行了综合诊断,并将分离毒株进行了遗传进化分析。
1 材料与方法
1.1 病料来源
2018年5月,山东省菏泽市某育肥猪场新进仔猪突然出现急性发病死亡,60多头猪死亡,死亡率超过30%。剖检病死猪,采集脾脏、肾脏、扁桃体、淋巴结和回盲瓣等组织样品,其中一份用10%的福尔马林溶液固定,常规制作石蜡切片,另一份冰冻保存进行病毒分离。
1.2 主要试验材料
琼脂糖凝胶DNA回收试剂盒:购自北京天根生化科技有限公司;DMEM/HIGH GLUCOSE:购自赛默飞世尔科技(中国)有限公司;BI胎牛血清:购自上海逍鹏生物科技有限公司;EasyPure Viral DNA/RNA Kit、T1载体及T1感受态细胞:均购自北京全式金生物技术有限公司;胰蛋白酶-EDTA消化液等:购自北京索莱宝科技有限公司;PK15细胞:由本实验室冻存;One Step RT-PCR试剂盒:购自TaKaRa公司。
1.3 引物设计
根据GenBank中登录的CSFV全基因序列,使用Primer Premier 5.0引物设计软件,分别设计2对引物,用于扩增E2部分基因(鉴别引物)及全基因(全长引物)序列。引物由生工生物工程(上海)股份有限公司合成(表1)。
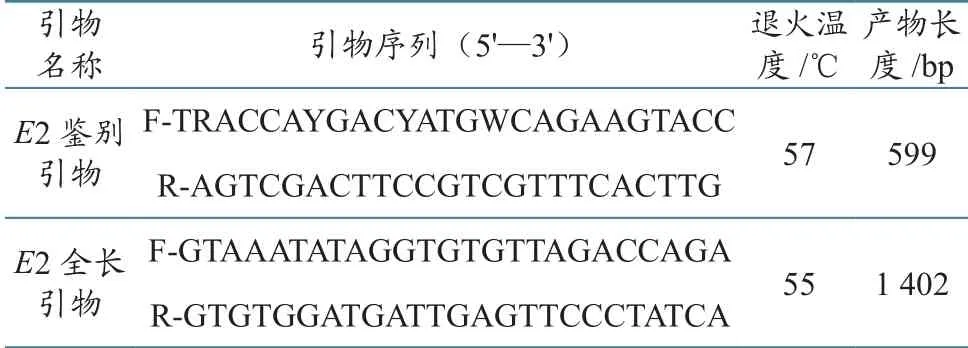
表1 CSFV E2基因引物序列
1.4 病毒分离
将采集的组织样品研磨后置于1.5 mL离心管中,5 000 r/min离心5 min,取上清液经0.22 μm滤器过滤后备用;用DMEM培养液加10%的胎牛血清用于PK15细胞培养,2%的胎牛血清用于病毒感染后的维持液。6孔板培养细胞,待细胞培养到长满单层时,加入上清液,37 ℃感作1~2 h,用PBS洗涤,加入2 mL维持液,37 ℃培养2 d,连续培养3~4代,收集病毒液。
1.5 病毒鉴定
参照EasyPure Viral DNA/RNA Kit说明书,对收集的病毒液进行核酸提取。以提取的核酸为模板,用E2鉴别引物进行PCR方法扩增。扩增体系按照One Step RT-PCR试剂盒说明书进行。扩增程序为:50 ℃ 30 min;95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,33个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.6 E2基因序列测定
将上述核酸提取物用E2全长引物进行50 µL体系扩增,将扩增后的PCR产物进行琼脂糖凝胶电泳。将目的条带所在的凝胶部分分离,使用胶回收试剂盒回收目的片段,将胶回收的目的片段连接T1载体并转入T1感受态细胞,并进行增菌培养。将鉴定为CSFV E2的阳性菌液送上海生工生物工程技术服务有限公司进行测序鉴定,然后对测序结果进行分子特征和遗传进化特点分析。
2 结果
2.1 临床检查及剖检病变
病死猪体温升高,出现神经症状,全身皮肤斑点状出血(图1-A);肾脏表面点状出血(图1-B),脑膜充血出血(图1-C),脾脏边缘出血性梗死灶(图1-D);回盲瓣出现溃疡灶(图1-E),结肠黏膜出现弥漫性糠麸样坏死(图1-F)。

图1 感染猪临床检查及组织器官剖检结果
2.2 组织病理学变化
各器官组织均有出血性病变,淋巴结出血(图2-A),肾间质弥漫性出血(图2-B),肠黏膜出血(图2-C),心脏出血(图2-D);回盲瓣及结肠黏膜纤维素性坏死(图2-E),脑血管周围淋巴细胞袖套样浸润(图2-F)。

图2 病死猪各组织的病理变化(HE×400)
2.3 病毒分离鉴定
对PK15细胞培养分离得到的细胞毒,经RTPCR扩增验证确定为CSFV阳性,猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)和猪圆环病毒2型(PCV2)均为阴性(图3-A)。CSFV E2片段全长扩增如图3-B所示。
2.4 核苷酸和氨基酸序列分析
利用DNAStar中的MegAlign,将新分离株(SDHZ-71)和参考毒株的核苷酸和推导氨基酸进行同源性比较分析。结果(表2)显示:SDHZ-71与国内的Shimen株、HCLV株及TWN株核苷酸序列同源性分别为83.4%、81.9%、81.9%,氨基酸序列同源性分别为90.1%、88.7%、89.3%;与国外的Alfort株和Paderborn株核苷酸同源性分别为86.8%、93.3%,氨基酸序列同源性为91.7%、95.7%;与本实验室2014年分离的SDJNa-14株的核苷酸和氨基酸同源性最高,分别为97.9%和98.7%;与本实验室2015年分离到的菏泽SDHZ-15株核苷酸和氨基酸序列同源性也较高,分别为97.1%和96.8%。
2.5 E2基因遗传演化分析

图3 E2基因扩增琼脂糖凝胶图

表2 新分离株的E2基因与参考毒株同源性比对结果
选取50株CSFV的E2基因参考序列与本实验分离的毒株,利用MEGA6的Maximum- Likelihood方法构建进化树(图4)。E2基因分型结果显示,新分离株SDHZ-71与SDHZ-14、SDJNa-15、Zj0801、SX-04等同属于2.1d亚型,且与本实验室分离的SDHZ-14、SDJNa-15等在同一独立分支上,表明该分离株仍为近几年的流行毒株。

图4 新分离株与参考毒株的遗传进化树
2.6 E2基因推导氨基酸突变位点分析
将分离株与参考株的推导氨基酸进行比对发现,分离株与Shimen株相比,发生了23个氨基酸突变,在Fernandez-Sainz I等[5]预测的糖基化位点中有2个发生了突变,分别为805(NTT-NAT)807、986(NYAK-NYTK)989,其他糖基化位点均未发生变化;与所有参考株相比,发生了805(NTT-NAT)807的突变,但是否与其毒力或其他结构相关,还有待进一步研究。
已知的抗原表位有717TTWKEYSH724,是A11的识别抗原表位[6];771LLFDGTNP778是E2蛋白的一个线性B细胞表位[7];829TAVSPTTLR837是一个高度保守的线性表位,为WH303的识别位点[8];995YYEP998是瘟病毒属保护性线性表位[9]。分离株的771LLFDGTNP778表位发生了N777S的突变,其他表位未发生变化。
3 讨论
CSF是一种以体温升高、全身性出血及高死亡率为特征的接触性传染病,对我国养猪业造成了巨大危害。自20世纪50年代,我国研制的CSFV兔化弱毒苗开始普遍使用,对控制CSFV在我国的传播起到了决定性作用。然而CSF在我国各地仍时有发生,对我国养猪业健康发展构成了巨大的威胁[10],而CSFV也随时间变化不断演变,产生了不同程度的突变,由以前的1.1亚型为主到现在的以2.1亚型为主[11-12]。本研究分离的毒株经分子水平检测及E2基因序列测定,确定为CSFV。
分离株SDHZ-71的核苷酸和氨基酸比对结果显示:SDHZ-71与本实验室分离的SDJNa-14同源性最高,分别为97.9%和98.7%,与2015年分离的菏泽SDHZ-15株也具有较高的同源性,分别为97.1%和96.8%;与HCLV、TWN的核苷酸和氨基酸的同源性最低,分别为81.9%/88.7%、81.9%/89.3%。这说明分离株与近几年分离的山东株差异性较小,而与HCLV、TWN等差异性较大。
遗传进化树分析表明,分离株SDHZ-71与SDHZ-14、SDJNa-15、Zj0801、ZJ7.2005、SX-04等同属于2.1d亚型分支,且与本实验室分离的SDHZ-14、SDJNa-15等在同一独立分支上,核苷酸序列及氨基酸序列同源性比对结果与遗传进化树分析结果一致。
CSFV糖蛋白中,E2是最主要的免疫原性蛋白,能诱导机体产生中和抗体,保护机体免受CSFV攻击[13]。E2的抗原位点主要分布在N端690~866位氨基酸残基上,分为4个抗原区:A、B、C和D区,分 别 位 于766~865、690~799、693~716和775~788位氨基酸残基之间[14],其中693~716肽段可以提供免疫保护[15]。糖基化位点806N、875N的突变,尤其是突变为A,将会导致CSFV毒力减弱[16]。而本分离株未发生突变,表明该途径的毒力致弱并未发生。986N为功能性糖基化位点,其突变可引起E2蛋白分子量大小的改变[17],但具体功能尚未明确,需进一步研究。本分离株与Shimen株相比,由986NYAK989突变为986NYTK989,与HCLV、Alfort等突变一致。本分离株与Shimen、HCLV等相比,与其他2.1亚型一致,也发生了由771LLFDGTNP778到771LLFDGTSP778的突变;相比其他参考毒株,发生了805(NTT-NAT)807糖基化位点的突变,其相关功能需进一步研究验证。
氨基酸的部分突变会导致流行毒株毒力、抗原等功能性结构的改变,可能是导致免疫失败或免疫保护力下降,使免疫猪群频发CSF的主要原因。当然,最主要的原因还是猪群免疫不当及生物安全措施缺失所致。因此,猪场应精选及保管好CSF疫苗,科学设计疫苗免疫程序,并加强疫苗免疫效果评估[18]。同时,要走出过分依赖疫苗的误区,将生物安全体系建设放在首位,积极探索封闭式、多点式饲养模式,严禁野毒株传入;加强饲养管理,减少应激,积极做好猪场保健工作。

