3种食源性细菌免疫磁珠联合ATP发光检测技术研究
寇晓晶,高 峰,谢 春
(1. 甘肃省动物疫病预防控制中心,甘肃兰州 730000;2. 盐城出入境检验检疫局,江苏盐城 224002;3. 南京农业大学,江苏南京 210014)
食源性疾病是指病原物质通过食物进入机体引发的中毒性或感染性疾病,常见的食源性疾病包括食物中毒、肠道传染病、人兽共患病、寄生虫病等[1]。据报道,在发达国家,每年罹患食源性疾病的人口比例高达30%[2]。在我国,2011年的食源性疾病监测显示,全国平均6.5人中就有1人次罹患食源性疾病。据世界卫生组织估计,在发达国家,食源性疾病的漏报率在90%以上,而在发展中国家,这个数字则要上升到95%以上,所以食源性疾病是当前世界上突出的食品安全问题之一。98.5%的食源性疾病由微生物污染引起,发病率居各类疾病总发病率前列,对人类健康、社会经济都会造成极大影响[3]。
沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌是食品中常见的致病菌,在国内外常常引起食源性疾病。如:2011年由单核细胞增生李斯特菌污染香瓜所引起的美国多州大型食源性疾病暴发,造成146种严重侵袭性疾病,30人死亡和1名孕妇流产,是美国近90年来致死性最强的一次食源性疾病暴发[4];Mihaiu等[5]报道罗马尼亚生鲜猪肉和鸡肉平均污染率为22.9%;李孝权等[6]参考《食品卫生微生物检验国家标准》(GB/T 4789),利用全自动荧光酶标免疫测试仪及全自动微生物分析仪,对可疑食品中食源性致病菌进行检测,在面包样品中检出了金黄色葡萄球菌和葡萄球菌肠毒素。近年来,全球一体化发展加速,受国际人口迁徙、贸易以及食物加工方式改变等因素的影响,食源性致病菌的传播速度不断加快,对人类健康造成的威胁逐渐加大,急切需要一种快速检测方法。
本研究将免疫磁珠技术和ATP发光技术联合用于食品微生物检测,选择沙门氏菌、单核细胞增生李斯特菌病和金黄色葡萄球菌3种最常见的食源性病原菌作为检测对象,建立了快速检测这3种食源性病原菌的富集及检测新方法。该方法不仅可大大缩短检测周期,还可提高检测的敏感性和特异性,具有推广应用前景。
1 材料与方法
1.1 实验菌株
鼠伤寒沙门氏菌(ATCC14028)、单核细胞增生李斯特菌(ATCC19115-1)、金黄色葡萄球菌(ATCC6538-1):由盐城检验检疫局检测中心实验室提供。
1.2 主要试剂
SS培养基、SC增菌液、LB培养基以及脑心浸液培养基(BHI):购自北京陆桥公司;胰蛋白胨:中国医药(集团)上海化学试剂公司生产;酵母粉:浙江省富阳市杭富生物制品厂生产;琼脂粉:国药集团化学试剂有限公司生产;Bac Titer-Glo发光检测剂 :Promega公司生产。
1.3 主要仪器和设备
免疫磁分离机:浙江大学生工食品学院研制;601型搅拌式电极架:海三信仪表厂生产;PHS-3BW微机型酸度计:上海理达仪器厂生产。
经预实验,免疫磁分离机的转速设置为6 r/min。因为在此转速下,离心管底部气泡和残留液少,因而更能准确反映试验结果。
1.4 免疫磁珠清洗
免疫磁珠(IMB)使用前,先取出小瓶装(2 mL/瓶,5×103个/mL)IMB,用手上下颠倒摇匀,然后取出0.3~0.9 mL IMB于1.5 mL离心管内,加入PBS缓冲液至1.0 mL;接着置于免疫磁分离机混匀,转速6 r/min,转时8 min,磁分离2 min;弃去上清液,再加入1.0 mL PBS清洗IMB 1 min;去磁,混匀,转速6 r/min,转时5 min,磁分离2 min;弃去上清液,重复1次;最后用PBS悬浮磁珠至0.3~0.9 mL,即回到初始容积量。
1.5 细菌悬液制备
取出0.5 mL用甘油保存的金黄色葡萄球菌菌种菌液,在生物安全柜中无菌接种在50 mL LB液体培养基中,37 ℃ 150 r/min振荡培养8 h。培养完成后,将菌液25 ℃ 3 000 r/min离心5 min;弃去上清液,在沉淀中加PBS缓冲液重新悬浮混匀。取出0.5 mL用甘油保存的单核细胞增生李斯特菌菌种菌液,在生物安全柜中无菌接种在50 mL LB液体培养基中,37 ℃ 150 r/min振荡培养8 h;培养完成后将菌液25 ℃ 3 000 r/min离心5 min;弃去上清液,加PBS缓冲液重新悬浮沉淀,用蜗旋振荡器混匀。取出0.5 mL甘油保存的沙门氏菌菌种菌液,在生物安全柜中无菌接种在50 mL LB液体培养基中,37 ℃ 150 r/min振荡培养8 h;培养完成后将菌液25 ℃ 3 000 r/min离心5 min;弃去上清液,加PBS缓冲液重新悬浮沉淀,用蜗旋振荡器混匀。
1.6 不同菌液免疫磁珠密度配比(平板计数法)
将免疫磁珠清洗后备用,将上述制备好的3种细菌悬液分别用PBS按10-1~10-6进行10倍梯度稀释,取10-4、10-5、10-63个稀释度菌液进行平板计数,每个稀释度做3个平行试验,同时设立空白对照。根据表1的比例在无菌EP管中加入各试剂。
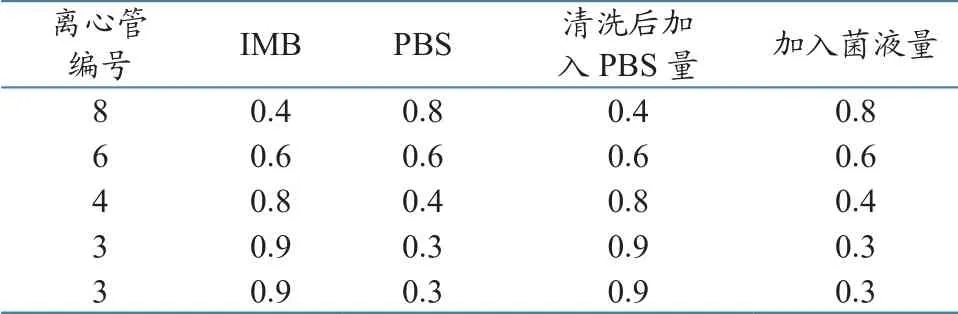
表1 不同配比的免疫磁珠和细菌悬液组成 单位:mL
调节磁分离机的参数为:转速6 r/min,转时20 min,混匀和磁分离5 min;吸走上清液,分别作好标记(waste,简称W);取1 mL PBS冲洗离心管中的菌体-免疫磁珠复合物,然后再次进行磁分离,转速6 r/min,转时15 min,磁分离2 min;弃去上清液,分别加入0.8 mL(8号离心管)、0.6 mL(6号离心管)、0.4 mL(4号离心管)、0.3 mL(3号离心管)PBS悬浮菌体-免疫磁珠复合物(result,简称R),去磁即可。
对于各个上清液W,10倍比梯度稀释至10-1~10-5,取10-4和10-52个密度进行平板计数,每个稀释度做3个平行试验。
对于各个菌体-免疫磁珠复合物,10倍比梯度稀释至10-1~10-5,取10-4和10-52个梯度进行铺平板。每个梯度3个平行。全部培养皿于37 ℃生化培养箱中培养20~24 h后菌落计数,接种量100 µL。
将所有接触过活菌的试验材料煮沸灭活30 h,将桌面等其它物品用75%酒精擦拭消毒,之后清洗试管等器皿,103 ℃烘箱中干燥30 min。
1.7 免疫磁分离技术特异性捕获(平板计数法)
将免疫磁珠清洗后备用,将上述制备好的3种细菌悬液分别用PBS按10-1~10-6进行10倍梯度稀释(Test,简称T),取10-4、10-5、10-63个稀释度菌液进行平板计数,每个稀释度做3个平行试验;取出37 ℃ 50 mL LB液体培养基中培养16 h的枯草芽孢杆菌(Bacillus subtilis,简称BS),用手晃动摇匀后,10倍比梯度稀释至10-1~10-6,取10-3、10-4、10-53个稀释度菌液铺平板,每个稀释度做3次平行试验,同时设立空白对照。
按表2中的要求,分别把3种菌液和BS悬菌液加入至灭菌并装有清洗好IMB的1.5 mL离心管中,6 r/min 20 min,磁分离5 min;倒掉上清液,取1 mL PBS冲洗离心管内的菌体-免疫磁珠复合物,6 r/min离心15 min,磁分离2 min;吸走上清液,加入0.3 mL(3E)、0.2 mL(2E)、0.1 mL(1E)PBS悬浮菌体-免疫磁珠复合物(Result,简称R),去磁即可。

表2 不同配比的菌悬液和BS菌悬液 单位:mL
对于各个上清液W,10倍比梯度稀释至10-1~10-5,取10-4、10-52个梯度,用显色培养基进行铺平板,每个梯度3个平行。
对于沙门氏菌菌体-免疫磁珠复合物悬浮液(3R、2R、1R),10倍比梯度稀释至10-1~10-6(107~ 102CFU/mL),取10-4~10-6(104~102CFU/mL)3个梯度,用SS固体培养基进行铺平板,每个梯度3个平行。
对于单核细胞增生李斯特菌菌体-免疫磁珠复合物悬浮液(3R、2R、1R),10倍比梯度稀释至10-1~10-6(107~102CFU/mL), 取10-4~10-6(104~ 102CFU/mL)3个梯度,用BHI固体培养基进行铺平板,每个梯度3个平行。
对于金黄色葡萄球菌菌体-免疫磁珠复合物悬浮液(3R、2R、1R),10倍比梯度稀释至10-1~10-6(107~ 102CFU/mL),取10-4~10-6(104~102CFU/mL)3个梯度,用LB固体培养基进行铺平板,每个梯度3个平行。全部培养皿于37 ℃生化培养箱中培养20~24 h后进行菌落计数,接种量100 µL。
1.8 ATP生物发光技术与免疫磁分离技术联合应用
将调整好菌落数的3种细菌悬液(OD600=0.100,108CFU/mL)稀释10倍后作为待检菌液(T)备用;将免疫磁珠清洗,将待检菌液与免疫磁珠按体积比1:3分别加入10个EP管中,使管内待检菌液体积为0.3 mL,免疫磁珠IMB 为0.9 mL。该体系中,由于免疫磁珠过量,此时可看作捕获率为100%。分别对10个管进行磁分离,将获得的悬浮菌体-免疫磁珠复合物收集到一个EP管中,弃上清液,用0.3 mL Tris-HCI缓冲液重悬复合物,然后加入BacTiter-Glo发光检测剂0.3 mL进行磁分离,6 r/min 离心2 min,磁分离1 min;迅速对该上清液10倍比梯度稀释至10-1~10-5(107~103CFU/mL),各取每个稀释度菌液100 µL检测菌液光源计数值,每个菌液重复检测3次,同时设置空白对照(50 µL Tris-HCI缓冲液+50 µL BacTiter-GIo发光检测剂)。
1.9 模拟添加样品中磁珠吸附率研究
按照 GB/T 4789. 38—2012 中提供的方法,称取 25 g市售婴儿奶粉,放入盛有 225 mL生理盐水的无菌均质袋内,10 000 r/min 均质2 min,制成 1:10 样品匀液,121 ℃ 高压灭菌 20 min 备用;将沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌株过夜培养,用1:10 样品匀液,分别调整菌液菌落数至终菌落数为107~102CFU/mL,再用匀浆机彻底混匀,制备成107~102CFU/mL的上述3种食源性致病菌人工污染模拟样品。
1.10 数据统计
采用方差分析的新复极差法(Duncan法),对各试验组数据进行差异显著性分析。
2 结果与分析
2.1 不同菌液-免疫磁珠密度配比
所有平板37 ℃培养24 h。合适的梯度计算公式为:(同一梯度下3个培养皿的菌落数之和/3)×10×该计数培养皿的稀释倍数(CFU/mL)
根据公式计算的免疫磁分离前后不同菌液、免疫磁珠配比下的菌落密度见表3。而IMB浓度为5.0×108个/mL,根据公式,捕获率= 磁分离后的菌落数/磁分离前的菌落数×100%。 计算出不同菌液、免疫磁珠配比下的捕获率见表4。
根据表4中的捕获率结果,绘制图1。由图1可以看出,沙门氏菌和单核细胞增生李斯特菌待检菌体浓度与IMB浓度之间体积比下降,则免疫磁珠的捕获率越高,即待检菌液中的细菌个体分配到的IMB越多,捕获率越高。当一个菌株能分配到38个免疫磁珠时,其捕获率分别可达到98.75%、99.49%和98.57%,近似全部的菌体能被IMB捕获到。金黄色葡萄菌菌液具有同样的趋势,但捕获率最高的条件为一个菌株分配到25个免疫磁珠。

表3 免疫磁分离前后不同菌液、免疫磁珠配比下的菌落数

表4 不同菌液、免疫磁珠配比下的捕获率
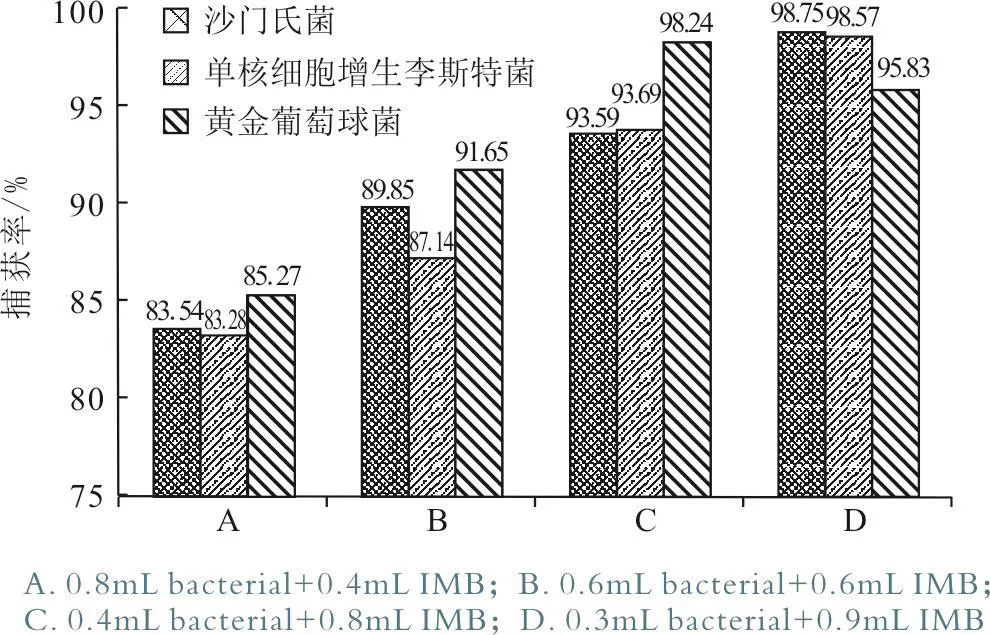
图1 不同菌体、免疫磁珠配比下的捕获率比较
2.2 免疫磁分离技术特异性捕获
所有的平板在37 ℃培养24 h后,经2.1所述公式计算得到沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌和枯草烟包杆菌的菌落数分别为0.93×108、1.2×108、1.25×108和1.55×106CFU/mL(表5)。3个离心管中,磁分离后各菌的捕获率见表6。
根据表6和图2的结果可以看出在控制总体积、IMB加入量以及待检菌和BS菌密度不变的情况下,当细菌体积减小,BS菌体积增加,其捕获率先下降后上升,出现下降可能是因为免疫磁珠的特异性受到了枯草芽孢杆菌的影响,因此对靶标菌的富集效率降低,当待检菌体积继续下降,使得免疫磁珠的与待检菌的比例大大过量,这可能是捕获率上升的原因。
2.3 ATP生物发光法与免疫磁分离技术联合应用
免疫磁分离后.各个稀释梯度下菌液的光源计数值(减去空白后)所得结果,绘制成相关性曲线见图3。由图3可知,沙门氏菌、单核细胞增生李斯特菌以及金黄色葡萄球菌的ATP生物发光技术与免疫磁珠联合应用的检测结果与传统的平板计数法具有良好的线性关系,3个待检菌的相关系数分别为R2=0.976 2,P<0.000 1; R2=0.986 6,P<0.000 1;R2=0.991 1,P<0.000 1。从结果来看,当菌液菌落数较高时(105~108CFU/mL)两种检测方法的结果几乎一致;当菌液菌落数较低时(103~ 105CFU/mL)两种方法存在一定差异,但是从总体来看,相关性良好。
从图3中可以看出,初始菌落数为107CFU/mL的待测菌液,经免疫磁分离技术浓缩后,待检菌液密度上升为108CFU/mL;ATP生物发光技术的最低检测限为103CFU/mL,因此当ATP生物发光技术与免疫磁珠分离技术结合后,可大大降低检测极限,使得最低检测限下降至102CFU/mL,因此ATP生物发光技术与免疫磁珠分离技术联合应用检测效率更高。
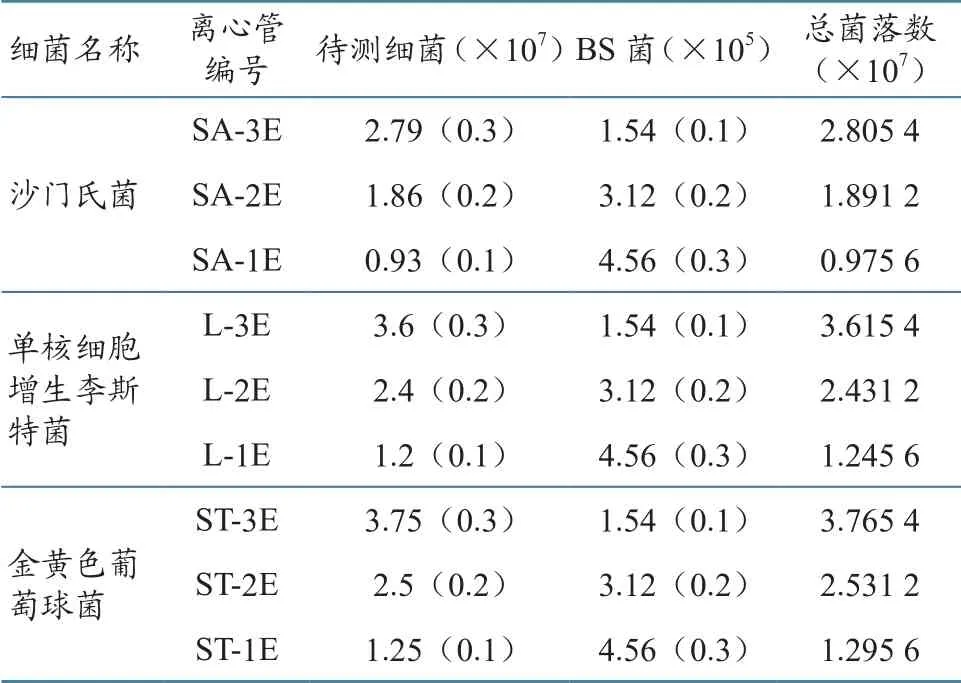
表5 各个离心管中的菌落数 单位:CFU/mL

表6 不同待测细菌和枯草芽孢杆菌配比下的捕获率
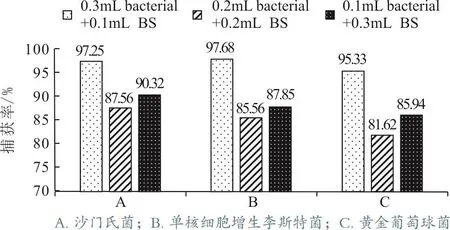
图2 不同的菌液配比的捕获率比较

图3 各菌落数下待捕获细菌的光源计数值与各菌落数之间的关系
2.4 模拟样本中3种细菌检测
模拟样本中的待捕获细菌的ATP发光检测结果见表7。表7数据显示,3种细菌由于使用了免疫磁珠的捕获,菌落数被浓缩了近1个梯度,原来为107~102CFU/mL的模拟样本,ATP发光检测分别接近108~103CFU/mL(表7)。
3 讨论
在食源性疾病中因微生物引起的比例最高。陈夏威等[7]用描述流行病学方法,对珠三角某市2001—2015年食源性疾病暴发事件进行统计发现:共报告食源性疾病暴发事件181起,发病4 493例,主要场所为集体食堂(占59.1%,107/181)和餐饮单位(占29.8%,54/181);由微生物引起的事件和涉及人数最多,事件数和发病数分别占总数的55.8%(101/181)和60.0%(2 696/4 493)。吴雨晨等[8]通过调查江苏省2016年食源性疾病,分析发现 2016年江苏省共发生食源性疾病暴发事件143起,由食源性致病菌引发的占63.64%。所以,加强食源性疾病监测、预警和系统建设,提升食源性疾病暴发事件现场流行病学调查处置能力具有重要意义。
目前国内外市场虽然也有多款微生物快速检测仪可供选择,但是这些快速检测仪多为国外进口产品,价格昂贵,如果再配上仪器所需要的配件、试剂、耗材及常规维护检修会大大增加检测成本。因此,建立一种快速检测食品微生物技术是我国食品安全领域科研工作者急需解决的问题。
ATP 生物发光法的优点是快速、简便、重现性好,但是该技术对于细菌样品的最低检测限为1 000个/mL,因此该技术的灵敏度可能会达不到卫生学要求[9]。为了提高微生物检测的灵敏度,将免疫磁珠分离法与ATP 生物发光技术联合使用,通过免疫磁珠分离技术对待检样品进行一定程度的浓缩,再通过ATP 生物发光技术进行检测,这样就大大提高了ATP 生物发光技术的灵敏度。同时免疫磁珠分离技术可以特异性结合待检样品,从而弥补了ATP生物发光技术无法区分不同微生物的缺陷。因此,两种技术的联合应用在微生物检测、细胞分离、免疫吸附等方面的应用越来越广泛[10]。该技术在医学卫生领域已发挥了很大作用,主要用于分离纯化和检测微生物[11],比如环境水及饮用水中微生物检测,食品样品中微生物检测[12],生物样品中细菌检测,人体内T、B淋巴细胞及多种肿瘤细胞检测[13]。本研究通过免疫磁珠的富集,使样品微生物浓度增加了10倍,原本为107~102CFU/mL的模拟样本,ATP发光检测后分别接近108~103CFU/mL,大大提高了样本检出率。这一结果与Yuxiao等[14]所做出的结果类似,进一步说明本研究发明的免疫磁珠富集后联合ATP发光技术检测食品中的沙门氏菌、单核细胞增生李斯特菌以及金黄色葡萄球菌的方法可行,并且具有快速、高敏感、高特异性以及价格低廉的特点。

表7 模拟样本中3种食源性致病菌免疫磁珠吸附后的ATP生物发光检测 单位:CFU/mL
4 小结
本研究比较了不同的菌体-免疫磁珠浓度配比下,免疫磁分离技术的捕获率,发现当菌体-IMB浓度配比为1:30时,沙门氏菌和单核细胞增生李斯特菌捕获率可达近100%,所有细菌可被免疫磁珠捕获。当菌体-IMB浓度配比为1:25时,金黄色葡萄球菌捕获率可达近100%,所有菌可被免疫磁珠捕获。在总体积0.4 mL不变、IMB加入量不变的情况下,比较了3种待测细菌和枯草芽孢杆菌不同体积比下的捕获率,均出现捕获率先下降后上升情况。免疫磁分离技术与ATP生物发光法联用技术与传统的细菌培养方法有良好的线性相关性,检测限可低达102CFU/mL。模拟样本中的待捕获细菌ATP发光检测发现,3种细菌由于使用了免疫磁珠捕获,浓度被浓缩了近10倍。

