鞘内注射IGFBP-3慢病毒载体缓解大鼠骨癌痛的实验研究
顾本进,秦宝莹,倪俊林,陈 诚,丁 健
(如皋市人民医院骨科,江苏226500)
癌症转移最常见的部位之一是骨骼,据统计30%以上晚期癌症患者发生骨转移,尤其常见于肺癌、前列腺癌及乳腺癌。骨转移诱导的疼痛称为骨癌痛(cancer-inclued bone pain,CIBP),是癌痛中最常见、最剧烈且难以控制的疼痛,严重影响患者的生活质量。目前治疗骨癌痛的方法有限,尽管世界卫生组织(WHO)癌症疼痛治疗指南推荐“三阶梯疗法”,但仍有约45%患者骨癌痛未得到有效控制。进一步深入研究骨癌痛机制,寻找新的更有效缓解骨癌痛的靶点,具有重要的临床意义。
大鼠骨癌痛模型能模拟人类骨癌痛的疼痛学行为,有助于骨癌痛发病机制及治疗的研究。骨癌痛是独特的疼痛类型,包含炎性疼痛和神经病理性疼痛成分,但又不是两者简单的总和。骨转移癌时破骨细胞破坏骨质增加,同时激活的成骨细胞释放Ⅰ型胰岛素样生长因子(insulin 1ike growth factor-Ⅰ,IGF-Ⅰ),IGF-Ⅰ通过其受体介导的信号传导通路,致使外周神经纤维辣椒素受体(TRPV1)上调,TRPV1能整合诱发痛觉的化学和热刺激信号,导致骨癌痛的发生。血清类胰岛素生长因子结合蛋白-3(IGFBP-3)与IGF-1的亲和力高于IGF-1与其受体的亲和力,推测骨癌痛大鼠背根神经节(dorsal root ganglion,DRG)细胞内IGFBP-3可以通过与IGF-1受体竞争,阻滞IGF-1与受体结合,从而缓解骨癌痛。本实验通过建立大鼠骨癌痛模型,采用von Frey测痛仪测量大鼠机械性痛反应阈值,探讨鞘内注射IGFBP-3过表达慢病毒后大鼠痛阈的变化,为临床缓解骨癌痛探索新的途径。
1 材料与方法
1.1 实验动物 36只健康雌性SD大鼠(南通大学实验动物中心提供),体重160~210 g。饲养的条件:饲养室室温(22±2)℃,湿度 40%~60%,通风良好,大鼠自由进食、饮水。随机分为骨癌痛组、假手术组、IGFBP3慢病毒载体治疗组、空载慢病毒对照组。
1.2 实验材料和仪器 麻醉用乙醚,水合氯醛,电动剃刀,医用生理盐水,手术用显微器材(上海市手术器械厂),25 μL、10 μL 微量移液器(镇海玻璃仪器厂),吸头,医用防护镜(美康),5 mL无菌注射器,医用胶水1.0mL(科峰医疗器械有限公司),医用缝合丝线(科峰医疗器械有限公司),癌细胞株Walker256(上海博格隆生物)。IGFBP3过表达慢病毒(滴度109TU·mL-1)及空载慢病毒(上海吉玛制药技术有限公司)。vonFreyfilament全套机械疼痛测定细丝(天津医工所),有机玻璃观察箱(120 cm×25 cm×35 cm),细铁丝网格操作平台。
1.3 骨癌痛模型建立 实验前将大鼠放置于行为实验架和盒子中适应3天,每天1~2小时。大鼠吸入乙醚麻醉,取仰卧位,剃刀剃除左侧胫骨近端毛发,碘伏消毒。在胫骨近端作长约0.5 cm切口,撑开皮肤切口显露胫骨近端。用粗针头(5号注射器)向下斜向旋转穿刺进入骨髓腔,换用微量注射器将10 μL Walker 256乳腺癌细胞悬液(2×107细胞)沿穿刺孔缓慢注射,骨蜡封闭穿刺孔,缝合伤口。假手术组大鼠按照上述方法注射10 μL生理盐水于骨髓腔。
1.4 实验动物鞘内注射[1]癌痛大鼠吸入乙醚麻醉,取俯卧位,背侧皮肤剃毛、碘伏消毒,选择腰5/腰6椎间隙穿刺进针,进入蛛网膜下腔时有“落空”感,能回抽出清亮的脑脊液,注入IGFBP3慢病毒4 μL。空载慢病毒对照组鞘内注入相同容量的慢病毒。待其自然苏醒后在正常环境中适应10 min,进行痛敏阈值检测,然后选不同时间点进行疼痛行为学检测。
1.5 大鼠机械痛阈检测
1.5.1 实验动物筛选:大鼠对机械痛的刺激行为反应存在个体差异,在正式实验前应筛选疼痛行为反应相当的大鼠。采用von Frey filament机械痛测量细丝进行痛阈测定,选用粗细不同的测量细丝以垂直方向针刺大鼠脚掌皮肤,根据大鼠抬足、舔足等行为进行判定。根据Chaplan等[2]报道,测定大鼠痛阈采用“up and down”方法。von Frey细丝(1 g~26 g)触压大鼠患肢脚掌中心部,渐进加力直至测量细丝折曲超过原有长度1 cm为止,每间隔5~10 s进行下一次,反复5次,5次中如果大鼠出现3次或以上抬足、舔足等行为即可判定为阳性,表明大鼠对这一强度的细丝机械性刺激敏感。如果大鼠无反应,则采用克数较大的下一级细丝重复实验,每次实验间隔至少15秒,直到大鼠出现抬足、舔足等阳性反应。当大鼠出现阳性反应时,换上一级克数较小的细丝再次进行实验。整个过程重复5次,大鼠机械性痛敏阈值即为诱发大鼠出现阳性结果的最低von Frey纤维丝力度。记录最后的filament,按表1换算机械痛阈值(见表1)。去除与样本均数相差大的大鼠,选用疼痛行为相当的大鼠进行正式实验。
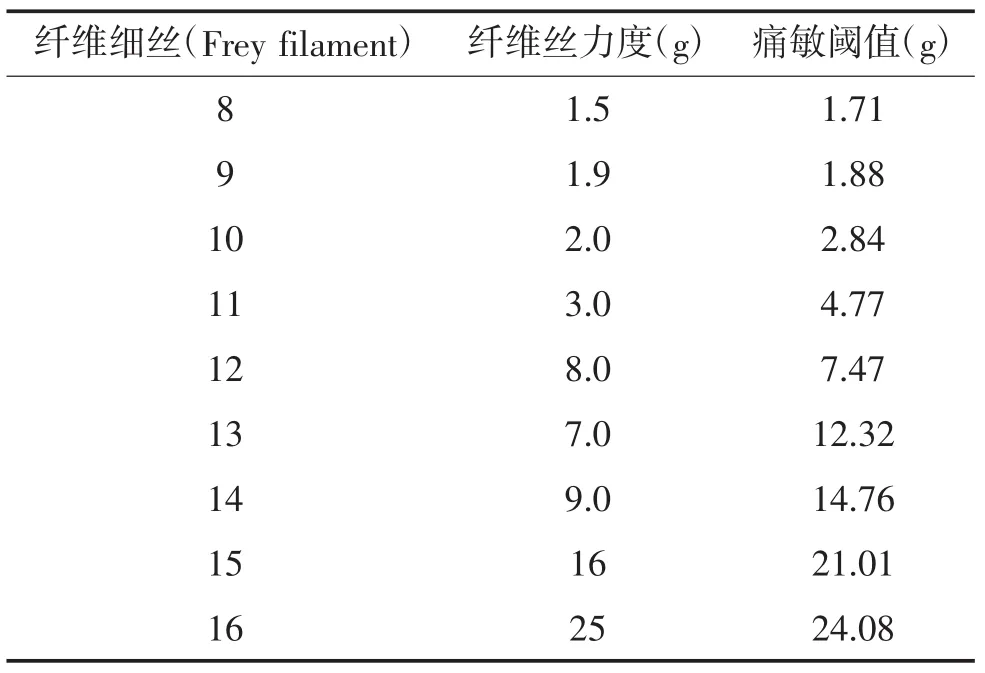
表1 纤维细丝刺激机械痛阈值换算表
1.5.2 机械痛阈检测:在大鼠接种肿瘤细胞前1天、接种后第7天、14天、21天,采用von Frey测痛仪测量大鼠左后肢的机械性痛反应阈值,方法同上。
1.6 统计学处理 使用SPSS 16.0统计学软件进行数据处理分析。计量资料以均数±标准差(±s)表示,组间差异性比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 接种后各组模型大鼠的体征和行为表现 接种后2~3天,大鼠外观、行为等方面无明显异常。接种后第4~5天,假手术组大鼠能正常摄食,动作迅捷,体重增长较快,但接种癌细胞的大鼠逐渐摄食量减少、步行缓慢,体重不再增加,行走时患肢有避免负重等现象。接种后14天,肿瘤接种组大鼠体重明显减轻,毛色嵴沉,反应迟钝,神情呆滞,患侧腿轻碰触即可诱发躲避等疼痛表现。3周左右接种癌细胞组大鼠的状态很差,精神萎靡,对外界刺激反应迟钝,患肢常悬空,局部肿胀明显,行走时基本不肯着地或拖行,此时大鼠开始出现死亡。
2.2 放射影像学检查 造模成功第1天行X线摄片,提示骨癌痛组大鼠胫骨近端骨组织未见明显的病理性改变,但周围组织密度增高,提示周围软组织肿胀可能。造模成功第14天、21天时,X线检查可见胫骨近端骨质密度不均匀,有骨膜反应,严重者见周围骨质破坏,软组织肿胀,部分大鼠甚至出现胫骨近端病理性骨折。而假手术组在术后第7天、14天、21天X线影像学检查均无明显异常改变。
2.3 肿瘤细胞接种后大鼠机械痛阈值变化 接种前、接种后第1天、3天、5天,四组大鼠机械性痛敏痛阈值相似。接种后第7天,骨癌痛组、IGFBP3慢病毒治疗组、空载慢病毒对照组大鼠的机械性痛敏阈值开始下降,第10天显著降低,三组大鼠机械性痛敏阈值相似。假手术组机械性痛敏阈值术前、术后无明显变化。骨癌痛组大鼠随着时间的延长,机械性痛敏阈值逐渐下降,接种后10天、14天、21天与假手术组比较,差异有统计学意义(P<0.05)。见表2。

表2 假手术组与骨癌组大鼠不同时间点的机械痛阈值比较 g
2.4 鞘内给药后机骨癌大鼠械痛阈值变化 鞘内IGFBP3慢病毒后,IGFBP3慢病毒治疗组大鼠机械性痛敏阈值升高,14天和21天分别为9.8±1.6 g和7.68±1.1 g,高于空载慢病毒组的4.8±2.3 g和3.9±0.98 g,差异均具有统计学意义(P<0.05)。见图1。

图1 IGFBP3慢病毒治疗组不同时间机械性痛敏阈值变化
3 讨 论
骨癌痛已成为困扰晚期癌症患者最常见的并发症之一,往往随着病情发展逐渐加重,患者的生活质量受到严重影响。目前对骨癌痛的治疗手段目前仍然有限,对骨癌痛的发生机制尚不甚明确。
研究表明,肿瘤主要由肿瘤细胞及其基质细胞组成,分泌能敏化或直接兴奋初级传入神经元的多种细胞因子。近年来研究发现辣椒素受体能够整合诱发痛觉的化学和热刺激信号[3-5],辣椒素受体(transient receptor potential vanilloid subfamily member 1,TRPV1)是一种表达于伤害感受器上的配体门控非特异性阳离子通道,广泛分布于背根神经节等中小型神经元中,在骨癌痛中正是这些初级神经元介导伤害信息的传入而导致疼痛。许多研究表明,辣椒素受体可以感受多种内、外源性理化刺激,如辣椒素、低pH环境、超过43℃温度、内源性大麻素及其他炎症介质,并将这些伤害性刺激传送至中枢[6],辣椒素受体参与炎性痛、神经病理疼痛和骨癌痛的发生机制。
另一方面,在骨转移癌发生时,破骨细胞破坏骨质增加,同时成骨细胞也被激活,激活的成骨细胞释放IGF-1增加,IGF-1与受体结合,激活酪氨酸激酶,启动下游的Ras蛋白激酶、丝裂原蛋白激酶(MAPK)和磷脂酰肌醇 3激酶(PI(3)K)等一系列酶促反应,通过不同信号传导通路上调外周神经纤维上TRPV1受体,从而加剧骨癌痛[7-15]。由于胰岛素样生长因子结合蛋白-3(IGFBP-3)与IGF-1结合力远高于IGF-1与其受体的结合力[16-17],循环中约75%IGFBP-3与IGF-1结合,阻止IGF-1与其受体结合。GFBP-3通过竞争性结合,抑制IGF-1在骨癌痛中加剧效应,从而发挥缓解疼痛的作用。
本实验结果显示,经胫骨近端注射乳腺癌肿瘤细胞株能成功建立骨癌痛大鼠模型;接种肿瘤细胞后行为学表现、影像学检查、行为学检测证实骨癌痛大鼠模型是成功的。癌痛大鼠鞘内注射IGFBP-3慢病毒载体,通过人为调高IGFBP-3蛋白含量后,和空载慢病毒对照组比较,其机械性刺激痛敏反应阈值明显提高,差异有统计学意义(P<0.05)。同时在造模成功第14天、21天给予鞘内注射给药后在不同时间段测痛敏阈值,发现在给药2 h后IGFBP-3慢病毒载体组癌痛大鼠的痛敏阈值到达最高峰,随着注射后时间的延长,其痛敏阈值渐渐降低,但在给药6h后仍较对照组明显提高,具有统计学的意义,其痛敏阈值在给药8 h后渐渐恢复至给药前的水平,结合行为学研究,说明鞘内注射IGFBP-3慢病毒载体后,IGFBP-3可以通过竞争性抑制IGF-1活性缓解骨癌痛引起的疼痛。在14天、21天鞘内重复给予IGFBP-3慢病毒载体,仍然反复出现以上实验骨癌痛大鼠的痛敏阈值转变情况,但是在第21天鞘内给药和第14天比较其痛敏阈值上调的程度有所降低,原因考虑可能和骨癌痛继续进展及产生IGFBP-3慢病毒载体的药物耐受有关。
综上所述,经胫骨注射Walker 256肿瘤细胞株可以成功建立稳定的大鼠骨癌痛模型,背根神经节水平的IGFBP-3可能参与骨癌痛的发生机制,IGFBP-3通过竞争性抑制IGF-1活性可以缓解大鼠骨癌痛。

