矢状位动态增强MRI定量分析联合扩散加权成像对直肠癌术前T、N分期的诊断价值
杨志勇, 严循成, 金建龙, 倪 建, 余秋里, 崔 磊
(1. 江苏省如皋市人民医院, 江苏 如皋, 226500; 2. 江苏省南通市第一人民医院, 江苏 南通, 226001)
直肠癌是指齿状线至乙状结肠直肠交界处的恶性肿瘤,是常见的消化道恶性肿瘤。近年来,直肠癌发病率呈逐年增高趋势,已成为中老年人死亡的主要病因之一。研究[1]证实,处于不同病理分期的结肠癌患者的治疗方案及预后显著不同,因而直肠癌的术前分期对治疗方案的选择至关重要。影像学诊断是直肠癌分期的重要方法,磁共振扩散加权成像(DWI)在腹部检查中已较为普遍[2]。在磁共振基础上改良的动态对比增强磁共振成像(DCE-MRI)能对肿瘤微血管循环进行较准确的评估。本研究比较DCE-MRI定量分析与DWI在直肠癌术前T、N分期中的价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年3月—2018年3月在本院治疗的直肠癌患者38例,其中男20例,女18例,年龄29~84岁,平均年龄55.50岁。纳入标准: ① 检查前未行放、化疗等治疗; ② 均经病理组织学诊断; ③ MRI扫描后1周内行手术治疗; ④ 患者及家属知情同意。排除标准: ① 影像图像有伪影或其他因素导致图像模糊; ② 有MRI检查禁忌证。
1.2 MRI检查
采用GE 750W 3.0T超导磁共振扫描仪, 32通道腹部相控线圈。常规检查T2WI矢状位(TR=3 466.00 ms, TE=85.00 ms, 矩阵360×360, NEX=2, 层厚5.00 mm, 层间距1.00 mm, FOV=260.00 mm×260.00 mm); T1WI轴位(TR=5.50 ms, TE=最小值,矩阵256×256, NEX=1, 层厚4.00 mm, 层间距1.00 mm, FOV=360.00 mm×360.00 mm); 高分辨T2WI轴位(根据直肠肿块调整的轴位, TR=4 836.00 ms, TE=102.00 ms, 矩阵320×288, NEX=2, 层厚3.00 mm, 层间距0.50 mm, FOV=180.00 mm×180.00 mm); T2WI-FS轴位(TR=4 895.00 ms, TE=102.00 ms, 矩阵320×256, NEX=4, 层厚5.00 mm, 层间距1.00 mm, FOV=240.00 mm×240.00 mm); 进行DWI轴位(b值取1 000.00 s/mm2, TR=6 200.00 ms, TE=最小值,矩阵128×128, NEX=1, 层厚4.00 mm, 层间距1.00 mm, FOV=360.00 mm×360.00 mm)扫描。
结束后进行矢状位DCE-MRI扫描: 应用LAVA Dyn-DCE序列(TR=5.40 ms, TE=2.00 ms, NEX=1, 层厚4.00 mm, 层间距1.00 mm, 矩阵256×192, FOV=280.00 mm×280.00 mm)进行矢状位扫描,对比剂运用Gd-DTPA, 由高压注射器自手背静脉注射,速度3.00 mL/s, 剂量为0.10 mmol/kg; 35个扫描时相不间断扫描,单个时相扫描时间8 s, 第3个时相扫描开始注入对比剂,总扫描时间280 s。范围包括整个盆腔。对比剂注射结束后即刻用20.00 mL生理盐水冲洗管道。DCE扫描后行T1WI轴位的普通增强扫描。
1.3 图像分析
1.4 术前影像学对直肠癌TN分期的评判标准
参考文献[3]并结合本组MRI图像,制定本组分期标准。常规MRI的T分期标准: T1期: 肿瘤信号局限于黏膜层内,所有序列均显示肌层完整; T2期: 肿瘤信号侵犯到肌层内,肌层外缘光整,肠周脂肪未见明显异常; T3期: 肿瘤信号突破肌层或浆膜层,肌层或浆膜层毛糙呈锯齿样改变,肠周脂肪内见异常信号,但与临近器官分界清晰; T4期: 肿瘤信号与临近器官境界不清,临近组织信号异常。DWI图像上肿瘤组织呈高信号, DCE-MRI图像上肿瘤组织明显强化,与正常肠壁的境界更清,T分期标准同常规MRI。
N分期标准: MRI图像中肠周所有可见到的淋巴结,常规MRI将短径大于5 mm, 边缘不光整, T2WI信号减低,判定为阳性淋巴结; DWI图像呈高信号及DCE-MRI呈高灌注,判定为阳性淋巴结。N0: 无阳性区域淋巴结; N1: 有1~3枚阳性区域淋巴结; N2: 有4枚及以上阳性区域淋巴结。
1.5 统计学处理
统计分析采用SPSS 19.0软件,符合正态分布的计量资料采用均数±标准差表示,组间比较使用t检验,非正态分布计量资料采用M(Q25~Q75)表示,组间比较使用秩和检验; 诊断价值采用受试者工作特征(ROC)曲线分析,以手术病理结果为金标准。P<0.05为差异有统计学意义。
2 结 果
2.1 MRI结果与病理结果比较
38例直肠癌患者均行经肛门微创手术(TME)及全淋巴结清扫,术中将淋巴结与MRI图像进行对照并标记。T分期结果: T1期2例, T2期10例, T3期21例, T4期5例。N分期结果: N0期22例, N1期12例, N2期4例。术前常规MRI检查TN分期,联合DWI及DCE-MRI定量参数分析后TN分期与病理结果对照见表1、2。

表1 常规MRI及联合DWI、DCE-MRI定量参数分析对直肠癌病理T分期效果比较

表2 常规MRI及联合DWI、DCE-MRI定量参数分析对直肠癌病理N分期效果比较
2.2 不同T分期DCE-MRI参数及表观扩散系数(ADC)比较
T3~T4期肿瘤的Ktrans、Kep显著高于T1~T2期(P<0.05), 而ADC值显著低于T1~T2期(P<0.05); T1~T2期与T3~T4期Ve、对比剂峰值时间(TTP)比较,差异无统计学意义(P>0.05), 见表3。
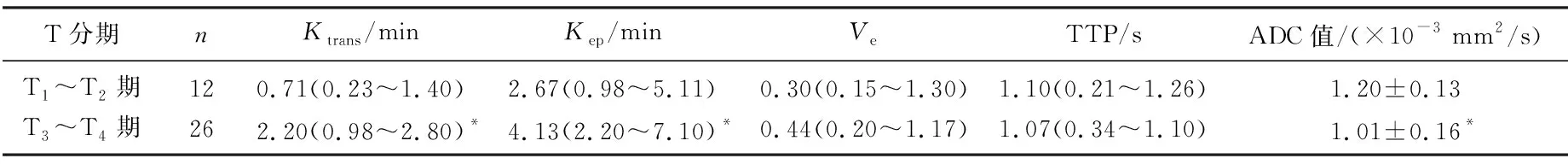
表3 不同T分期DCE-MRI参数及ADC比较
Ktrans: 容量转移常数;Kep: 速率常数;Ve: 细胞外血管外间隙容积比; TTP; 对比剂峰值时间; ADC: 表观扩散系数。
与T1~T2期比较, *P<0.05。
2.3 不同N分期DCE-MRI参数及ADC比较
N1~N2期转移性淋巴结的Ktrans、Ve显著高于N0期未转移淋巴结(P<0.05), 而ADC值显著低N0期(P<0.05); N0期与N1~N2期淋巴结的Kep、TTP比较,差异无统计学意义(P>0.05),见表4。
而此次我们设计的这个无线充电智能小车他就是这门技术的雏形,目前可以将这个小车改装,用STM32主芯片进行控制,电磁感应或者谐振耦合方式进行无线电能传输进行供电,可用于实验室两教室之间进行小物件运输。

表4 不同N分期DCE-MRI参数及ADC比较
Ktrans: 容量转移常数;Kep: 速率常数;Ve: 细胞外血管外间隙容积比; TTP; 对比剂峰值时间; ADC: 表观扩散系数。
与N0期比较, *P<0.05。
2.4 ROC曲线分析
Ktrans、Kep和ADC值判断T分期的ROC曲线下面积依次为0.913、0.907和0.901, 差异有统计学意义(P<0.05);Ktrans、Ve和ADC值判断N分期的ROC 曲线下面积分别为0.835、0.913和0.926, 差异有统计学意义(P<0.05)。见表5、图1。

表5 ROC曲线分析
Ktrans: 容量转移常数;Kep: 速率常数;Ve: 细胞外血管外间隙容积比; ADC: 表观扩散系数。

A. 判断T分期ROC曲线

B. 判断N分期ROC曲线
图1ROC曲线图
3 讨 论
直肠癌是常见的消化道恶性肿瘤,占胃肠道肿瘤的第2位,好发于40岁以上人群,男性发病比例高于女性[4]。手术、靶向治疗、放疗与化疗是治疗直肠癌的有效手段,但患者总体5年生存率仍处于较低的水平,仅为50.00%左右,其中30.00%的晚期直肠癌患者在较短的时间内即可出现疾病进展[5]。
基于影像技术及高场强磁共振和相控阵线圈的应用, MRI能够准确判断肿瘤位置及浸润深度,进而对肿瘤进行定位,指导手术范围[6]。高分辨T2WI可以进一步缩小扫描层厚和视野,提高图像空间分辨率,准确显示肿瘤对肠壁各层的浸润情况,提高直肠癌术前TN分期的准确性。有研究[7-8]表明高分辨磁共振对直肠癌的术前T分期准确度达到90.54%, 对转移阳性淋巴结的判断准确度可达到85.00%。本研究中常规MRI对直肠癌的T、N分期总准确度分别为65.80%、57.90%, 分析准确度较低的原因可能是本研究病例较少,存在统计误差。
DCE-MRI技术的原理主要是基于血管被注入顺磁性对比剂而缩短组织T1值,通过重复成像记录组织信号,并依据对比剂逐渐扩散至周围组织和利用专业软件得到定量参数[9]。该技术能够显示直肠组织微血管特征,进而评估肿瘤组织微血管循环。Ktrans、Kep及Ve均为DCE-MRI的常用参数。Ktrans可准确描述肿瘤与血管间隙对比剂的摄取及跨内皮细胞转运情况,其值越高则说明组织渗透性及血流量高,肿瘤恶性程度越高[10-11];Kep是组织对对比剂的廓清,能够将对比剂返回血管的反向转运参数进行准确描述;Ve是血管外细胞与肿瘤的间隙部分,可准确表示肿瘤血管外细胞的间隙体积分数。Yao等[12]研究发现,较高的Ktrans值与肿瘤较高的TN分期密切相关。Kim等[13]研究发现,Ktrans、Ve值与肿瘤的TN分期的相关性很差。Yeo等[14]研究表明,低分期肿瘤的Kep值要明显高于高分期肿瘤。本研究显示T3~T4期肿瘤的Ktrans值显著高于T1~T2期(P<0.05), 与Yao等研究相符。T1~T2期与T3~T4期肿瘤的Ve值无显著差异,这也与Kim等研究一致。T3~T4期肿瘤的Kep值显著高于T1~T2期(P<0.05), 这与Yeo等研究不符,可能是因为ROI选取的方法不同所致, Yeo等选取的是肿瘤横截面的全部面积,而本研究选取的是肿瘤连续3个层面的强化最明显区,而且ROI面积较小。
扩散加权成像是目前唯一能观察活体水分子微观运动的功能成像方法,可以反映水分子的扩散能力。DWI在直肠肿瘤的诊断中,尤其对于原发病灶的浸润深度、周围侵犯情况及淋巴结转移的判定有重要价值。DWI中的ADC值可对机体扩散成像进行观察描述,而b值可调整DWI对组织水分子运动敏感性的探测。有研究[15]将图像质量与不同b值下的ADC值进行比较,认为b=1 000 s/mm2是结直肠癌DWI检查的合理b值。因此,本研究中使用该b值,在显示的DWI图像上,肿瘤病灶呈高信号,与周围正常肠壁、肠周脂肪的低信号形成鲜明对比,明显提高了诊断的准确性。ADC值的定量测量是分析肿瘤良、恶性的另一个重要工具, ADC值可对病变的血流灌注或组织b值产生较大影响,由于肿瘤组织细胞间隙中的自由水减少,水扩散明显受限,导致ADC值明显降低。正常肠组织的ADC值明显高于直肠肿瘤组织。因而DWI技术可对直肠癌进行准确分期诊断。本研究DWI图像上,肿瘤病灶呈高信号,与周围正常肠壁、肠周脂肪的低信号形成鲜明对比,明显提高诊断的准确性。T3~T4期肿瘤ADC值显著低于T1~T2期(P<0.05)。
当直肠癌T分期越高,肿瘤浸润直肠壁越深,因此当直肠癌肿瘤浸润深度不确切或欠清晰时,可通过肿瘤组织的测量进行直肠癌的T分期诊断。本研究矢状位DCE-MRI扫描可更好地显示肿瘤的形态、大小及对肠壁的浸润程度。再联合DWI分析后对直肠癌的T分期诊断准确度89.40%, 明显高于常规MRI检查的65.80%, 略高于周妮娜等[16]单独应用DCE-MRI的83.30%。
常规MRI检查对转移性淋巴结的评估只能取决于淋巴结的大小及形态,该标准具有明显的局限性,如炎症反应也会导致淋巴结增大,而一些转移性淋巴结也会比较小。DWI和DCE-MRI定量参数分析可以很好地显示淋巴结的内部特性。因为转移性淋巴结与原发肿瘤结构相似,所以在DWI上显示为跟肿瘤相似的高信号, ADC上明显信号减低。在DCE-MRI中,转移性淋巴结的各定量参数数值(Ktrans、Kep、Ve)也与原发性肿瘤相仿。本研究联合DWI及矢状位DCE-MRI定量参数分析后对直肠癌进行N分期的诊断准确度(86.8%)明显高于常规MRI检查(57.9%); 不同N分期DCE-MRI参数及ADC比较结果显示, N1~N2期Ktrans、Ve均显著高于N0期(P<0.05), 而ADC值显著低于N0期(P<0.05)。
ROC曲线分析结果显示,Ktrans、Kep和ADC值判断T分期的ROC 曲线下面积分别为0.913、0.907和0.901;Ktrans、Ve和ADC值判断N分期的ROC 曲线下面积分别为0.835、0.913和0.926。上述结果提示DCE-MRI及DWI中的Ktrans、Kep和ADC值指标在评估术前直肠癌T分期中有重要的价值,而Ktrans、Ve和ADC值指标在评估术前直肠癌N分期中也有重要的价值。

