新型鸭呼肠孤病毒广东分离株σC蛋白基因序列分析
张思远,卢秀娴*,云 骜,梁昭平,潘俊斌,林举攀,叶贺佳
(1.广州市华南农大生物药品有限公司,广州510300;2.华南农业大学,广州510642)
近年来,一种新型鸭呼肠孤病毒(NDRV)疾病,称为北京鸭“脾坏死”病,在我国多个地区流行,该病的主要特征病变为肝、脾脏不规则出血、坏死与心肌、腔上囊出血,发病没有明显季节[1],与传统的番鸭呼肠孤病毒(MDRV)相比,具有更广泛的宿主,不同品种鸭均易感,发病率与病死率有较大差异,被感染的病鸭日龄越小,发病、病死率越高[2]。
2018年下半年,广东湛江某肉鸭养殖场樱桃谷肉鸭发病,临床主要表现为脚软、关节肿大等临床特征,解剖发现主要为肝脏肿大、脾脏有坏死灶等病变特征,该肉鸭群主要是1~2周龄的雏鸭发病,最早可见于3~5日龄,发病率60%以上,死亡率40%左右。根据临床诊断初步怀疑该病是由鸭呼肠孤病毒引起的疾病,但该病所引起的死亡率却不同于经典的北京鸭“脾坏死”病。本研究对采集的病死鸭病料进行了病原分离鉴定,对分离株的σC蛋白基因进行了克隆、测序和序列基因遗传变异分析,以期了解该病毒的变异情况,为该病的防控和诊断提供参考依据。
1 材料和方法
1.1 材料 病料为广东湛江某肉鸭养殖场临床发生“肝脾坏死症”死亡雏鸭的肝脏和脾脏;50枚9日龄健康樱桃谷鸭胚购自广东某健康种鸭养殖场,40只1日龄健康樱桃谷鸭购自广东某健康种鸭养殖场。
1.2 主要试剂 核酸提取试剂盒(9766)、pMD19-T载体(6013)购自 TaKaRa公司、DL2000 DNA Marker(BM101-01)购自北京全式金公司;2×Gotap Master Mix(M711)购自Promega公司;核酸染料(RT210)和反转录试剂盒(KP103)均购自TIANGEN公司。
1.3 病料处理 将病料剪碎研磨,与PBS按1∶3的比例制成组织匀浆液,将匀浆液置于冰箱-20℃冷冻并反复冻融3次,离心后取上清液过滤除菌、分装,分装量为1 mL/管,于-70℃及以下保存。
1.4 病原传代培养 病料滤液经尿囊腔接种9日龄鸭胚,0.2 mL/胚,收集接种后24~108 h死亡鸭胚,收获胚液,继续传代至鸭胚规律性死亡止。检测胚液对1%鸡红细胞悬液的血凝性。
1.5 RT-PCR检测 分别用以下4对引物对病料滤液及收获的胚液体进行RT-PCR检测。根据GenBank中已发表的番鸭细小病毒(MPV)、新型鸭呼肠孤病毒(NDRV)、番鸭呼肠孤病毒(MDRV)、鸭瘟(DPV)的基因序列,用Oligo7.0软件设计特异性检测引物,由上海生工生物工程有限公司合成,引物序列见表1。

表1 RT-PCR检测引物Tab 1 RT-PCR detection primers
1.6 组织切片病理观察 患鸭的脾脏和肝脏固定于10%的多聚甲醛溶液48 h,经脱水、透明、石蜡包埋、切片、H.E.染色,观察病理变化。
1.7 对鸭胚的半数致死量 胚液的 10-2、10-3、10-4和10-5稀释度分别经尿囊腔接种9日龄鸭胚各6枚,0.2 mL/胚,用蜡封孔,于37℃静置孵育,记录各稀释度24~108 h死亡鸭胚数,按Reed-Muench法计算ELD50。
1.8 动物回归实验 40只1日龄健康樱桃谷鸭,随机分为2组,攻毒组30只经皮下接种病毒液,接种剂量0.5 mL/只;对照组10只以同样的方式和剂量接种PBS。每日观察雏鸭的临床症状和死亡情况,观察10日后扑杀解剖2组雏鸭。
1.9 分离毒σC蛋白基因序列测定 根据σC基因两端外的保守序列设计1对扩增σC全长基因的引物,引物序列:P1(上游):5'-TTGAAAACTGAACAAAAGA - 3',P2(下游):5'- CCATAACTAA-CATAAGGGCA -3',预期扩增片段大小为 986 bp。经RT-PCR扩增σC基因全序列,回收RT-PCR产物,与pMD19-T载体相连转化至DH5α,经PCR鉴定后挑取阳性菌送华大基因公司广州测序部进行基因全长序列的测定。
1.1 0病毒σC蛋白基因序列分析 利用DNAStar等软件将病毒株基因序列与GenBank中登录的禽源呼肠孤病毒参考毒株进行比较。
2 结果与分析
2.1 病毒分离 将病料接种鸭胚,培养96~108 h后胚体死亡,胚胎体表充血、出血;死亡胚尿囊液清亮,胚胎蜷缩,见图1。该分离毒不能凝集1%鸡的红细胞。
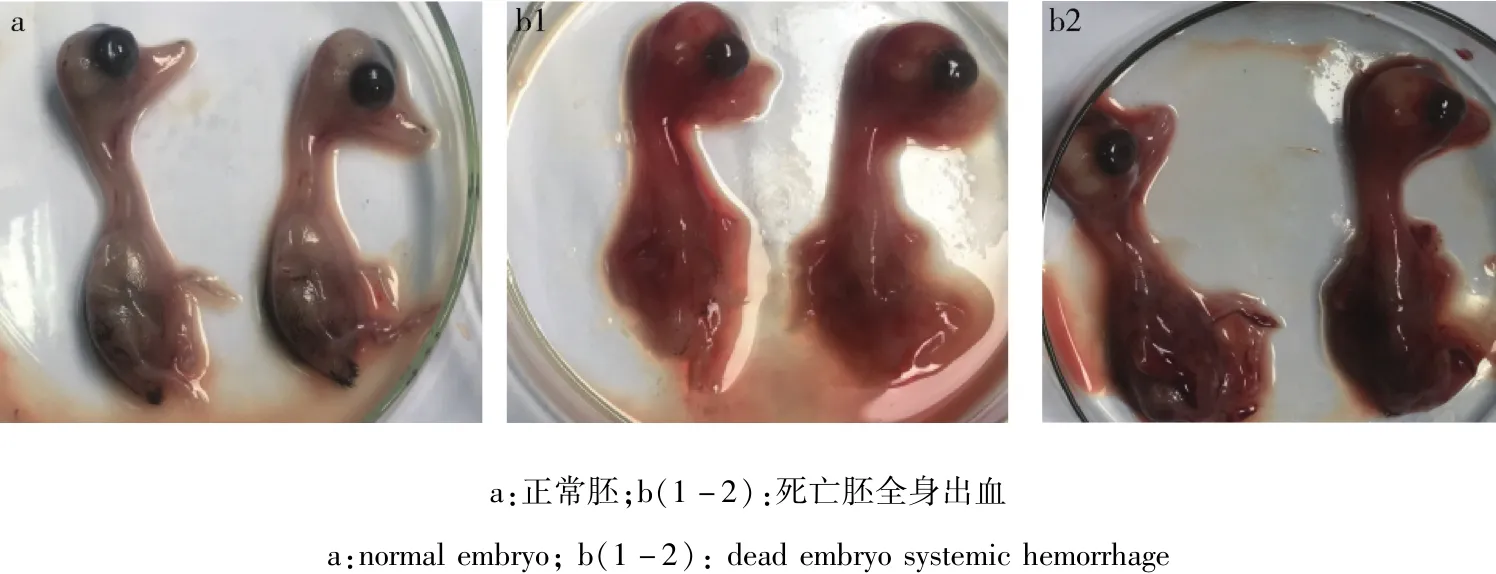
图1 死亡鸭胚胚体变化Fig 1 Death embryo body changes
2.2 RT-PCR检测结果 RT-PCR鉴定应用NDRV特异性引物能从病料滤液和分离的胚液种扩增到500 bp目的片段(图2),应用其他3种鸭的病毒特异引物不能从病料中扩增到目的片段,均为阴性。分离到的毒株命名为GD693。

图2 分离毒株RT-PCR检测结果Fig 2 RT-PCR results of isolated strains
2.3 组织切片病理观察 脾红白髓界限不清,组织结构崩解,被膜下形成炎症反应带;肝脏组织间出现大量的红细胞、出现局灶性坏死,空泡变性(图3)。
2.4 病毒半数鸭胚致死量(ELD50) 测定结果为:ELD50=10-4/0.2 mL。
2.5 动物回归实验 攻毒组鸭在接毒的第5天开始出现精神萎靡,排白色稀粪,食欲减退,观察期满10 d后剖检发现鸭出现与临床自然发病樱桃谷鸭一致的病理变化(图4);第2组对照无异常。
2.6 σC蛋白基因片段RT-PCR扩增结果 结果显示:NDRVσC蛋白基因扩增的片段长度约986 bp,与预期的结果一致(图5)。
2.7 σC蛋白基因序列测定与遗传进化分析 σC蛋白基因开放阅读框(ORF)为966 bp,编码321个氨基酸,是新型鸭呼肠孤病毒S1基因组第3个ORF编码的。GD693株与参考毒株σC基因核苷酸序列及推导氨基酸序列同源性比较结果表明,GD693株与 MDRV毒株D1546株的同源性为60% ~61%之间;与 NDRV代表毒株 091、NP03、TH11株的同源性为96.7%~98.6%之间。
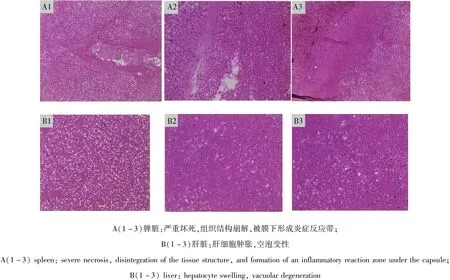
图3 病死鸭脾脏、肝脏组织病理切片图Fig 3 Histopathological section of the spleen and liver of dead duck
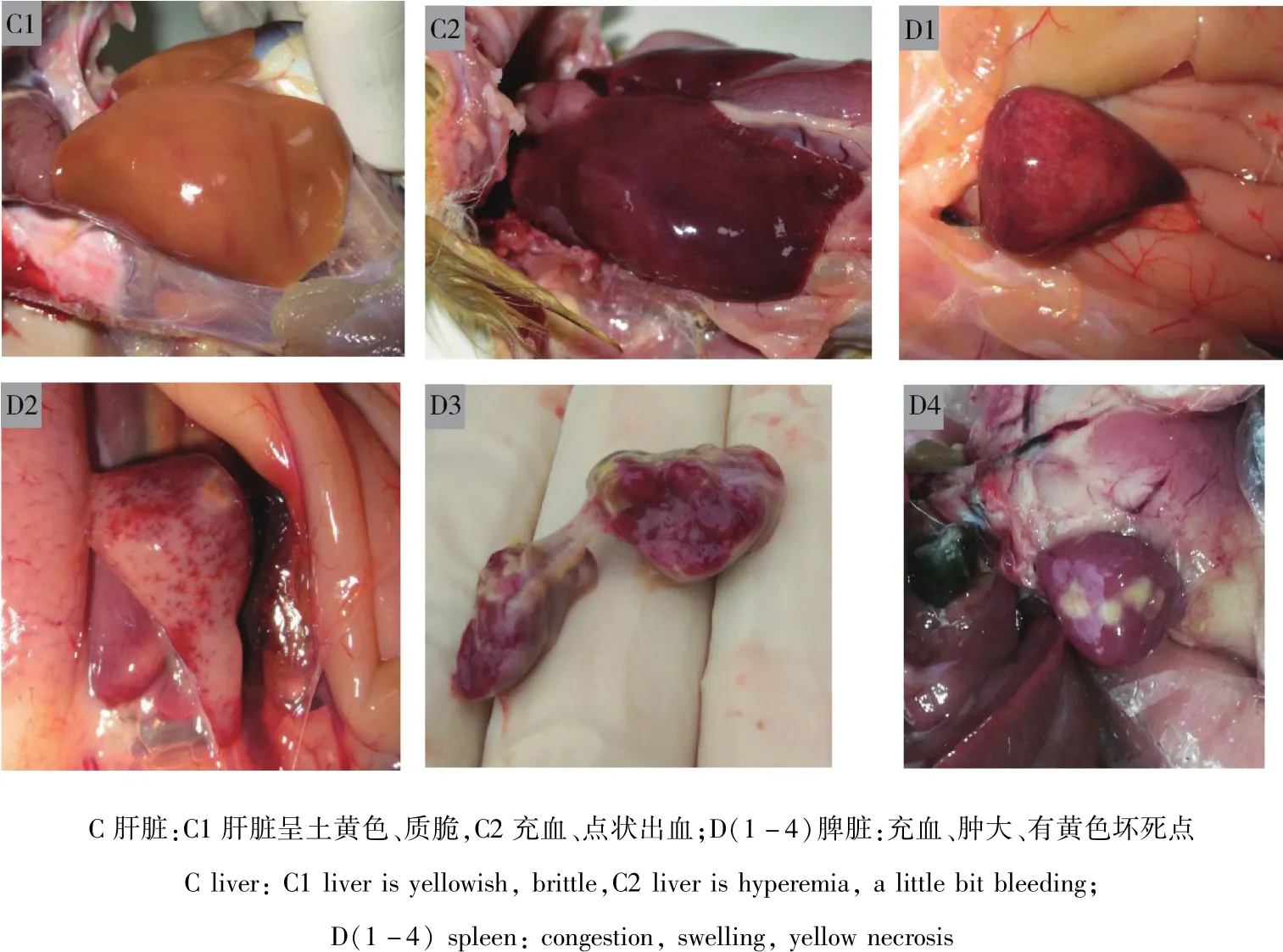
图4 动物回归实验Fig 4 Animal regression experiment
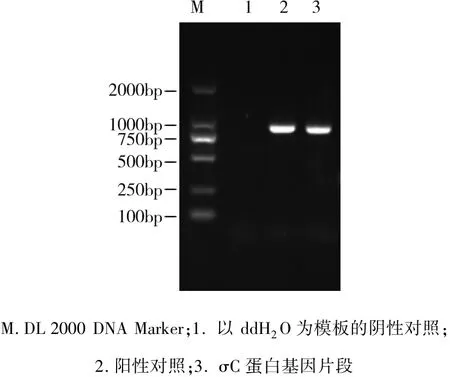
图5 σC蛋白基因片段RT-PCR扩增结果Fig 5 RT-PCR results ofσC protein gene segment
将GD396株与NDRV代表毒株091、TH11株的σC蛋白基因序列进行比较,GD396株核苷酸及氨基酸序列存在差异位点,氨基酸差异位点分别位于第25(T→K)、64(E→D)、65(L→M)、91(L→L)、132(T→ S)、138(R→Q)、150(P→ S)位氨基酸。核苷酸和氨基酸的序列改变,有可能会导致毒力相关位点发生改变,从而使毒株的毒力发生变化。
各毒株σC蛋白基因遗传进化树分析结果(图6)显示,可将水禽源呼肠孤病毒分为两个基因型,经典的MDRV和GRV属于基因1型,而NDRV及N-GRV属于基因2型。GD693毒株与NDRV代表毒株处于进化树的同一大分支,但却处于一个单独的分支,同属于基因2型,具有相近的遗传演化关系;与其他毒株处于进化树的不同分支,亲缘关系相对较远。
3 讨论与结论
本研究从临床表现为脚软、关节肿大的病死鸭中分离到NDRV,该病以脾脏坏死,肝脏点状或斑块状出血为主要特征的。经动物回归试验,可以复制出与临床自然病死鸭相似的病变。NDRV属于呼肠孤病毒科正呼肠孤病毒属,没有囊膜,呈二十四面体的双层衣壳结构,核酸是线性双链RNA,基因组由10个双链RNA基因片段组成,大片段(L1-L3)、中片段(M1 -M3)和小片段(S1 -S4)[3-4]。呼肠孤病毒在抗原致病性、基因编码蛋白的顺序及病毒基因间的同源性方面上完全不同于之前的MDRV 和鸡呼肠孤病毒(ARV)[5-6],宿主更加广泛,对各种品种鸭均有致病性[7],给我国水禽养殖业造成了一定程度的经济损失。
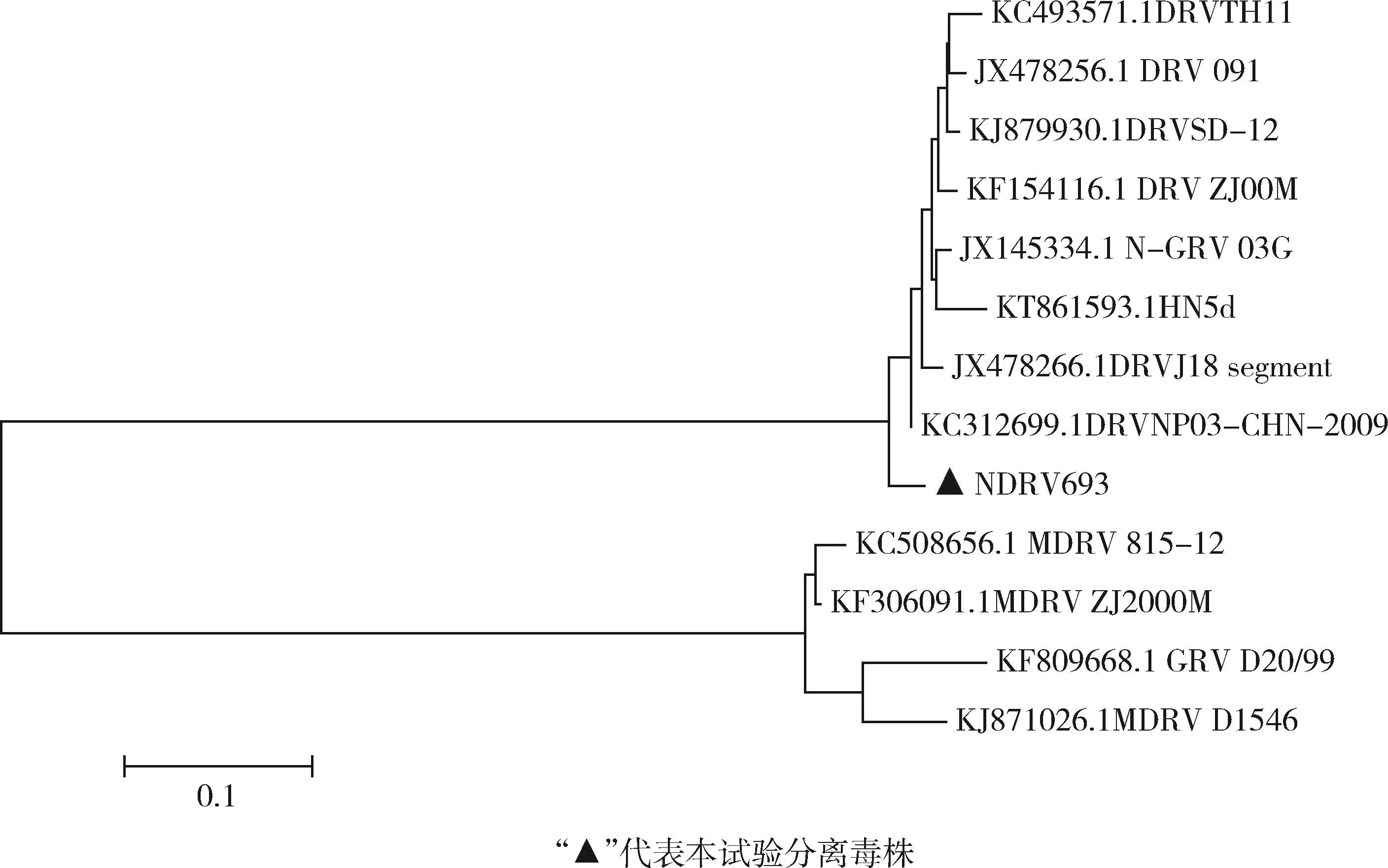
图6 NDRV GD693株与参考毒株σC蛋白基因序列的遗传进化树Fig 6 Inheritance of NDRV GD693 strain and reference strainσC protein gene sequence tree
不同水禽源呼肠孤病毒之间存在较高的序列变异性,外衣壳蛋白(μB、σB和σC)编码基因节段表现出更高的序列变异性,适合于不同禽源毒株的鉴别,其中变异性最大的是σC蛋白编码基因,而它在病毒的致病过程中发挥重要作用[8]。σC蛋白是一种结构蛋白,是由NDRV S1基因编码的,在呼肠孤病毒基因组编码的所有σ类蛋白中是最小的,同时是病毒的主要免疫蛋白,负责宿主细胞的附着,通过受体介导的方式对靶细胞进行识别与结合来启动病毒感染过程,可诱导机体产生特异性保护性中和抗体[9]。NDRV的σC基因在分子大小和基因同源性方面与鸡呼肠孤病毒(鸡病毒性关节炎)存在很大的差异[10]。
将GD693株的σC蛋白基因序列与参考毒株进行了比对分析,结果显示,所分离的GD693株与MDRV毒株的同源性比较低(90% ~92%),而与NDRV代表毒株同源性则较高(95% ~97%)。遗传进化树显示,GD693株与MDRV则处于不同的分支,而与NDRV代表毒株处于同一进化大分支,但又处于不同的小分支,表明可能它们来源于共同的祖先,但在病毒流行过程中形成了不同分支。将GD396株与NDRV代表毒株091、TH11株的σC蛋白基因序列进行比较,GD396株及氨基酸序列存在6个差异位点,可能会使病毒对鸭的致病性增强,据此推测GD693株可能是对鸭具有较高致病性的变异株,关于毒力的増强机制,仍需进一步研究。
本研究通过对NDRV的毒力、致病性及主要抗原σC蛋白的变异分析,为今后新型鸭呼肠孤病毒分子流行病学研究、疾病防控和诊断提供参考依据。疫苗免疫是预防本病的主要防控措施,但目前还没有商品化的疫苗,因此研发新疫苗对该病的防控非常必要。

