常规超声与超声造影在肾肿瘤伴静脉瘤栓“301分级系统”诊断中的临床应用研究
李秋洋 李楠 黄庆波 彭程 马鑫 张旭 罗渝昆 唐杰
1中国人民解放军总医院超声诊断科100851北京
2中国人民解放军总医院泌尿外科
肾肿瘤合并静脉瘤栓患者的首选治疗方案是肾肿瘤根治性切除联合静脉瘤栓取出术,无转移患者的术后5年生存率达60%[1-2]。该手术是泌尿外科领域最具挑战性的手术之一,难度大、风险高,围术期瘤栓脱落易导致患者死亡,而科学、有效的术前决策是降低围术期死亡率的关键。经典的Mayo分级系统在开放手术的策略的制定中发挥了重要作用[3],降低了该类手术的风险,然而该分级系统不适合指导制定机器人及腹腔镜微创手术的手术策略。2017年,北京市瘤栓协作小组结合肾肿瘤伴静脉瘤栓的诊疗特点和现状,依据与术前影像学可辨认的重要解剖标志[4],提出了新的瘤栓分级系统——“301分级系统”,并纳入包括瘤栓高度在内的多种考量因素,为每一级分类制定了相应的处理策略[5]。在新的分级系统中,如何通过影像学检查充分评估影响手术决策的因素,辅助手术策略的制定成为影像科医师和临床医生关注的重点。随着超声技术的不断发展及超声造影技术的出现,大大扩大了超声的应用范围,提升了超声的应用价值。本研究旨在探讨常规超声及超声造影在肾肿瘤伴静脉瘤栓的“301分级系统”诊断中的临床应用价值。
1 资料与方法
1.1 临床资料
回顾性分析2016年1月-2018年12月收治的80例肾肿瘤伴静脉瘤栓患者资料,男62例,女18例,年龄24~86岁,中位年龄55.5岁。肾脏肿瘤位于左侧30例,右侧50例。入选标准:①所有患者术前均经常规超声、超声造影、CT和(或)MRI检查发现有肾肿瘤伴静脉瘤栓;②能够得到术后明确的病理学检查结果;③患者签署知情同意书。排除标准:①存在超声造影剂说明书中提及的禁忌证;②患者依从性较差,未通过手术获得明确的病理学检查结果。80例患者中,19例根据专科医生建议已于术前接受2~3个治疗周期的靶向治疗。本研究上报并通过医院伦理委员会批准。
1.2 仪器与方法
仪器:采用迈瑞Resona 7超声诊断仪,SC6-1U腹部凸阵探头;Acuson Sequoia 512超声诊断仪,4V1探头和Philips ie33型超声诊断仪,S7-2t多平面经食道探头。
超声造影剂:意大利Bracco公司的SonoVue造影剂冻干粉,使用生理盐水5 mL溶解,充分振荡混匀至乳白色液体后经患者肘部浅静脉团注1.0 mL,使用5 mL生理盐水冲注。
所有患者均在术前行常规超声与超声造影检查。先用常规超声对肾肿瘤的部位、大小、空间解剖关系及静脉瘤栓的前后径、高度进行常规超声多切面扫查;然后转换为超声造影模式观察肾肿瘤的血流情况,重点观察肾静脉、下腔静脉的受累情况以及瘤栓内的血流灌注信息;对于瘤栓高度达第二肝门的患者,转换经食道超声探头观察膈肌上下及心房内瘤栓的情况。
通过常规超声结果将全部患者按照“301分级系统”进行分级,0级:瘤栓局限于右肾静脉内;0a级:瘤栓局限于左肾静脉内,未超过肠系膜上动脉;0b级:瘤栓局限于左肾静脉内,但超过肠系膜上动脉;Ⅰ级:第一肝门以下的下腔静脉瘤栓;Ⅱ级:第一肝门以上至第二肝门的下腔静脉瘤栓;Ⅲ级:第二肝门至膈肌水平的下腔静脉瘤栓;Ⅳ级:超过膈肌水平的下腔静脉瘤栓[4-5]。通过超声造影,判断静脉瘤栓是否合并血栓,即瘤栓内可见造影剂灌注,血栓内未见造影剂灌注。
对于接受靶向治疗的19例患者,在靶向治疗前后分别对其进行常规超声及超声造影检查,对比治疗前后原发肿瘤的大小、瘤栓直径及下腔静脉内瘤栓高度的变化和原发肿瘤及瘤栓内是否有坏死,评估术前靶向治疗疗效。
1.3 分级方法
将超声检查结果与影像学金标准MRI比较。瘤栓分级最终由高年资外科医师根据术中情况及病理结果确定。
2 结果
80例肾肿瘤伴静脉瘤栓患者均接受术前常规经腹部超声和经食道超声检查,静脉内瘤栓表现为肾静脉及下腔静脉管腔内径增宽,管腔内可见低或中等回声充满静脉管腔或与管壁之间有空隙。术前按照“301分级系统”将患者进行分级(图1):0级(右)5例,0a级(左)4例,0b(左)3例,Ⅰ级22例,Ⅱ级33例,Ⅲ级7例,Ⅳ级6例(图2)。19例接受术前靶向治疗的患者,治疗前按“301分级系统”分级:Ⅰ级3例,Ⅱ级13例,Ⅲ级4例,Ⅳ级2例,治疗1~6个周期(中位值2周期)后,11例瘤栓高度明显降低,瘤栓高度平均变化-0.58 cm(-4.87~1.02 cm),瘤栓最大径平均变化-0.32 cm(-1.34~0.25 cm)。4例患者(21%)接受靶向治疗后瘤栓成功降级(图3),其中1例由Ⅳ级降至Ⅲ级,2例由Ⅲ级降至Ⅱ级,1例由Ⅱ级降至Ⅰ级。通过超声造影发现,靶向治疗后14例患者肾脏肿瘤及静脉瘤栓内可见明显的坏死灶(图4),提示靶向治疗有一定临床疗效。
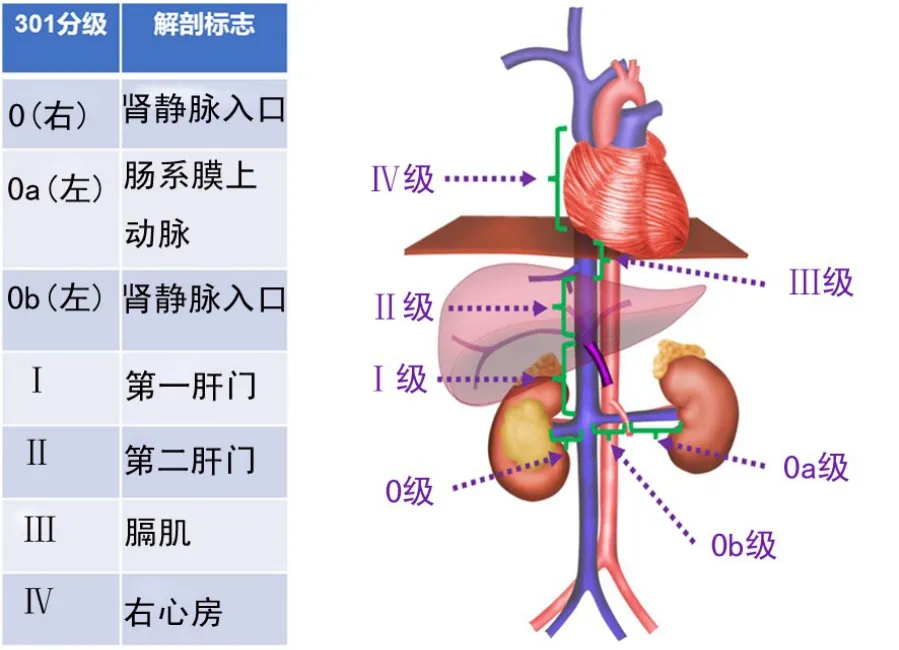
图1 “301分级系统”解剖标志及图示
通过超声造影发现,80例肾肿瘤伴静脉瘤栓患者中,12例(15%)患者下腔静脉内瘤栓合并血栓(瘤栓的超声造影表现为注射造影剂后静脉内栓子呈现快速高增强,血栓的超声造影表现为无增强,见图5)。瘤栓合并血栓的12例患者的瘤栓均位于下腔静脉内,按照“301分级系统”,Ⅰ级3例,Ⅱ级4例,Ⅲ级2例,Ⅳ级3例,其中4例合并近心端血栓,8例合并远心端血栓,血栓长至髂血管内6例,同时合并近心、远心端血栓1例,合并下肢静脉血栓1例。

图2 经腹部超声和经食道超声按照“301分级系统”将瘤栓进行分级
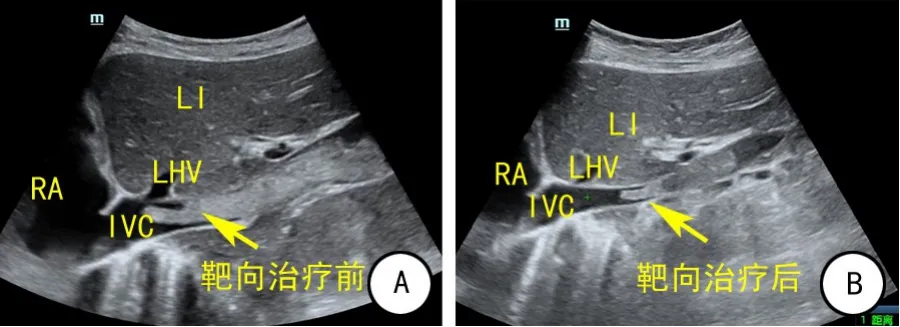
图3 靶向治疗前后常规超声图像
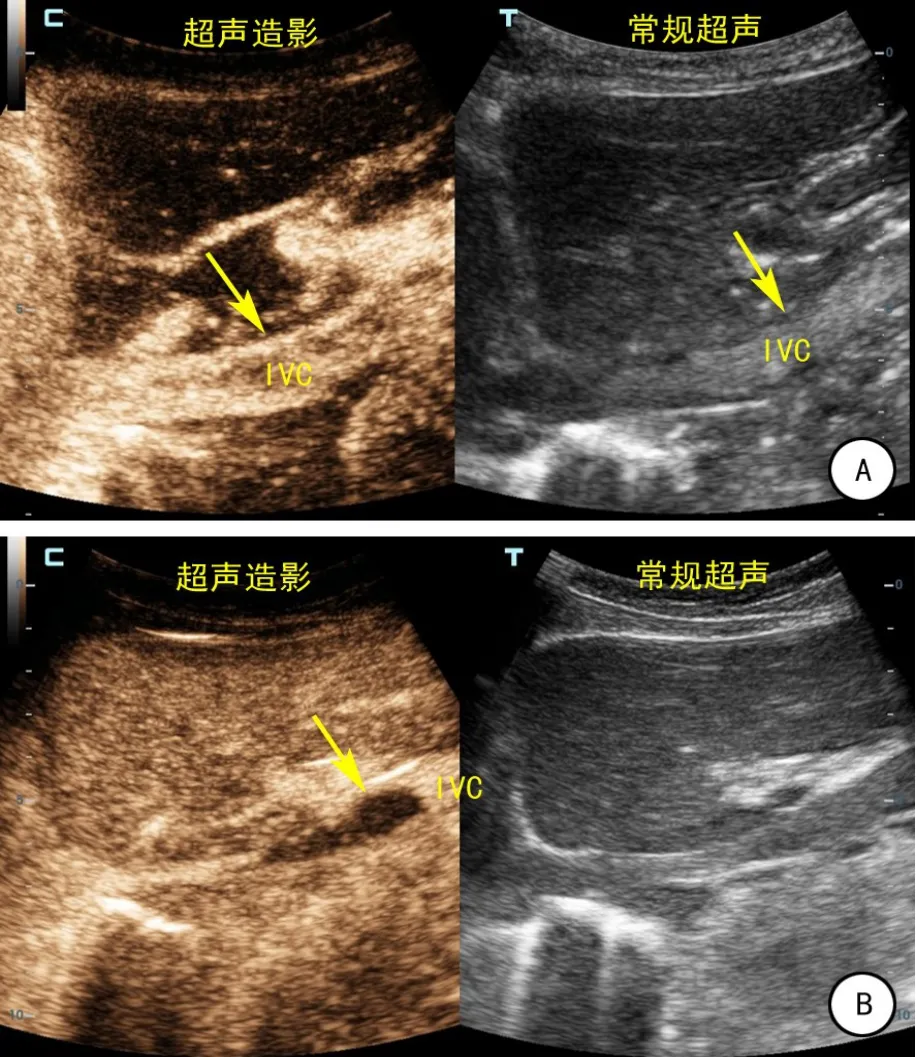
图4 靶向治疗前后超声造影图像
超声检查结果与影像学金标准MRI比较,瘤栓分级诊断的符合率为100%。
80例患者均采用按照“301分级系统”对应的手术策略进行手术,其中8例合并远心端血栓患者接受下腔静脉离断术,手术均顺利完成,术后所有患者均恢复良好出院,中位术后住院时间7 d(3~30 d)。术后病理提示透明细胞癌60例,乳头状细胞癌7例,血管平滑肌脂肪瘤4例,其余类型9例。瘤栓分级最终由高年资外科医师根据术中情况确定,超声的诊断结果与手术中诊断结果的符合率为98.75%,1例术前超声诊断为Ⅳ级的瘤栓患者术中经食道超声诊断降为Ⅲ级。
3 讨论
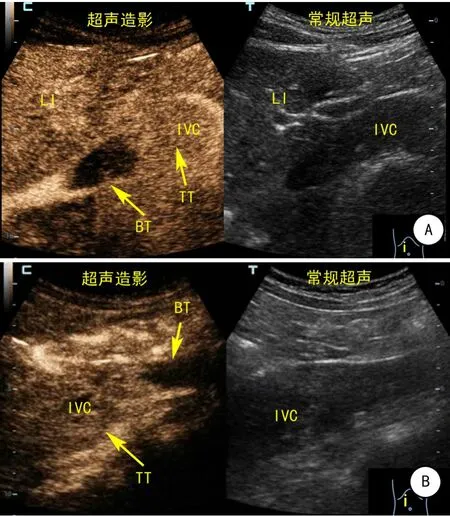
图5 下腔静脉内瘤栓合并血栓常规超声和超声造影表现
肾肿瘤合并静脉瘤栓形成占肾癌的4%~10%[3],手术是目前最有效的治疗方法,如果能在术中彻底清除瘤栓,可以提高患者的总体生存率[6]。而瘤栓的高度决定了具体的手术策略,按照不同的高度对应不同手术策略的原则制定手术方案,可最大程度降低手术风险。目前针对肾肿瘤合并静脉瘤栓最经典的分级方法是2004年Blute等[3]提出的 Mayo Clinic瘤栓五级分类法:0级,肾静脉瘤栓;Ⅰ级,距肾静脉小于2 cm的下腔静脉瘤栓;Ⅱ级,距肾静脉2 cm到肝静脉水平以下的下腔静脉瘤栓;Ⅲ级,肝静脉水平至膈肌以下的下腔静脉瘤栓;Ⅳ级,膈肌以上至右心房内下腔静脉瘤栓。不同的分级对应不同的手术策略:0级,单纯肾肿瘤根治术;Ⅰ级,将瘤栓挤回肾静脉后行肾肿瘤根治性切除术;Ⅱ级,翻肝,在肝静脉以下阻断并切开下腔静脉取出瘤栓;Ⅲ级,需行静脉转流;Ⅳ级,建立体外循环后行瘤栓切除术。该分级系统在开放性手术治疗肾肿瘤伴静脉瘤栓时代对于规范手术策略,减少该类手术并发症及降低手术风险等方面发挥了非常重要的作用。随着腹腔镜及达芬奇机器人手术技术的不断进步,下腔静脉瘤栓取出术逐渐进入微创时代,而机器人辅助腹腔镜下腔静脉瘤栓取出术也日趋成熟[7-8]。我们回顾性总结分析了100例瘤栓微创手术经验,以解剖标志为基础,提出了适合腹腔镜及机器人等微创手术的瘤栓新的分类标准——“301分级系统”标准[4-5]。该分级系统与Mayo分级系统主要不同之处有两点:①对于左肾静脉内瘤栓,“301分级系统”以肠系膜上动脉为界分为0a与0b两级,0a级手术方案等同于普通的肾肿瘤根治术,而0b级由于肠系膜上动脉的阻碍,完成切肾需要将患者翻身,转换切口[9];②“301分级系统”将第一肝门与第二肝门分别作为分界点,若下腔静脉内瘤栓位于肾静脉开口水平到第一肝门水平段(“301分级”Ⅰ级),术中不需要翻肝及离断相关的静脉组织;若下腔静脉内瘤栓位于第一肝门水平到第二肝门水平段(“301分级”Ⅱ级),术中翻肝时需要离断数条肝短静脉并显露肝后段下腔静脉。以上两点不同之处涉及的三个解剖学标志:肠系膜上动脉、第一肝门及第二肝门,以往多通过术前MRI辨认。对于超声检查来说,将肝脏作为良好的声窗显示这些结构并不困难(图2)。一旦瘤栓高度超过第二肝门,则可选择经食道超声探头,迅速准确地明确瘤栓的范围及具体高度。
肾肿瘤伴静脉瘤栓合并血栓并不罕见,我中心和国外中心报道的发生率分别为13.9%和15.0%。可能的原因为:①瘤栓造成下腔静脉血流回流受阻,流速减低,②瘤栓自身破溃或者侵袭血管壁造成血管内皮的损伤可以激活凝血系统形成血栓[11]。“301 分级系统”提出根据血栓的部位采取不同的治疗策略,手术处理原则如下:近心端血栓高度等同于瘤栓高度,风险更高,发展更快;远心端血栓与侧支循环侧支血管建立有关,血栓的长度决定是否旷置。既往研究结果显示腔静脉瘤栓伴血栓形成更容易合并更高的瘤栓级别、广泛的术前转移、造成更差的术后生存情况和围手术期结果[12]。对于腔静脉瘤栓合并血栓的患者行手术治疗具有一定的挑战性,极易引发围术期致死性的并发症,术前应进行充分的预案并做好围术期管理,因此术前检查鉴别栓子的性质具有重要的临床意义。常规超声对二者鉴别有一定困难。超声造影剂微泡的平均直径仅有2.5 μm,远小于栓子内的滋养动脉管径,故可随血流进入栓子内,且不进入细胞间隙,是真正的血池造影剂,因此,超声造影能够获得瘤栓内的血流灌注信息,显著提高微小血管内血流信号的检出率,可用于鉴别腔静脉内栓子的性质,反映栓子内的真实血管情况。与常规超声相比,超声造影具有明显优势。
近年来随着靶向治疗药物在转移性肾癌领域取得的良好疗效,逐渐有学者报道将其应用于肾肿瘤合并静脉瘤栓的术前辅助治疗,其目的是先将原发灶缩小及瘤栓高度降低再予以手术,以降低手术难度,减少手术风险,提高患者的生活质量等[13]。根据我中心的临床经验[14],术前靶向治疗对于“301分级系统”Ⅲ~Ⅳ级瘤栓患者获益显著。瘤栓降级可显著降低手术难度,避免翻肝、开胸等高难度的术中操作,有利于微创技术的开展和应用。目前临床对于肾肿瘤合并静脉瘤栓靶向治疗后的评估方法为每个周期行影像学检查(CT/MRI)和实验室检查,主要观察指标为靶向治疗后原发肿瘤体积和瘤栓高度的变化。常规超声和超声造影作为新兴的检查手段,不仅可评估瘤体大小和瘤栓高度,还可以对肿瘤及瘤栓内血管及组织成分变化进行早期功能评估。目前国际公认的评价靶向治疗疗效最准确的方法为增强MRI,但其易受呼吸运动的干扰,部分特殊患者无法进行检查,且设备要求较高,扫描层面数量有限,同时费用较高。常规超声可以确定靶向治疗前后肾脏肿瘤大小和静脉内瘤栓的高度变化,超声造影可以实时判断靶向治疗后肾脏肿瘤及静脉瘤栓内坏死灶的范围,并且不受时间、场地的限制,具有安全、无辐射,重复性好等优势,为完善靶向治疗疗效评估提供了新的技术手段。
总之,常规超声和超声造影作为实时、无创的检查技术,对肾肿瘤合并静脉瘤栓患者按照“301分级系统”进行瘤栓分级诊断及对静脉内瘤栓与血栓进行鉴别诊断具有重要意义,并且对接受靶向治疗患者的疗效评估具有指导性意义,有较高的临床应用价值。

