脓毒症患者外周血血小板-白细胞聚集体及其分类水平对合并ARDS的预测价值*
左 蕾,吴永红,拜合提尼沙·吐尔地△
(1.新疆医科大学第一附属医院RICU,新疆乌鲁木齐 830054;2.简阳市人民医院呼吸内科,四川简阳 641400)
脓毒症是临床上常见的由感染引起的全身各系统炎性反应综合征,而肺是脓毒症全身炎性反应综合征中最易和最早受累的器官[1],各种炎症细胞、炎症介质和凝血因子可以引起肺泡细胞损伤,并导致严重的肺水肿、肺不张和难以被纠正的低氧血症,最终形成急性呼吸窘迫综合征(ARDS)[2-3]。ARDS的早期预测对于减少发病率和病死率十分关键,目前临床上常用“柏林标准”作为ARDS的诊断依据[4],虽然提高了诊断的准确率,但仅对血氧饱和度进行分级,无法预测疾病的发生;而常用的急性生理学与慢性健康状况评分系统 Ⅱ(APACHEⅡ)评分及序贯器官衰竭评估(SOFA)评分尽管在临床应用较为广泛,但其预测效能较低[5]。血小板-白细胞聚集体(PLA)主要包括血小板单核细胞聚集体(PMA)、血小板中性粒细胞聚集体(PNA)和血小板淋巴细胞聚集体(PLyA),是由受炎症刺激激活后的血小板与白细胞表面的黏附分子通过配体相互结合和(或)与纤维蛋白原在黏附分子之间的桥接作用形成,因而可以视为肺损伤较为敏感的指标,与脓毒症及ARDS的发生和发展有着密切联系[6],但PLA及其分类的水平在预测脓毒症合并ARDS中的诊断价值尚不明确,为此,本院对150例脓毒症患者进行了一项前瞻性研究,现报道如下。
1 资料与方法
1.1一般资料 选择在2015年1月至2018年5月期间于本院就诊的150例脓毒症者,根据是否发生ARDS分为脓毒症组(非ARDS患者,90例)和ARDS组(发生ARDS患者,60例)。两组患者的基线资料比较,差异无统计学意义(P>0.05),见表1。
1.2纳入与排除标准
1.2.1纳入标准 (1)所有脓毒症患者均符合国际脓毒症定义会议脓毒症诊断标准,合并ARDS患者符合脓毒症和“ARDS柏林标准”的诊断标准;(2)所有患者近3个月未使用免疫抑制剂。
1.2.2排除标准 (1)合并血液疾病者;(2)HIV感染者;(3)妊娠者;(4)肺纤维化、慢性阻塞性肺疾病者。
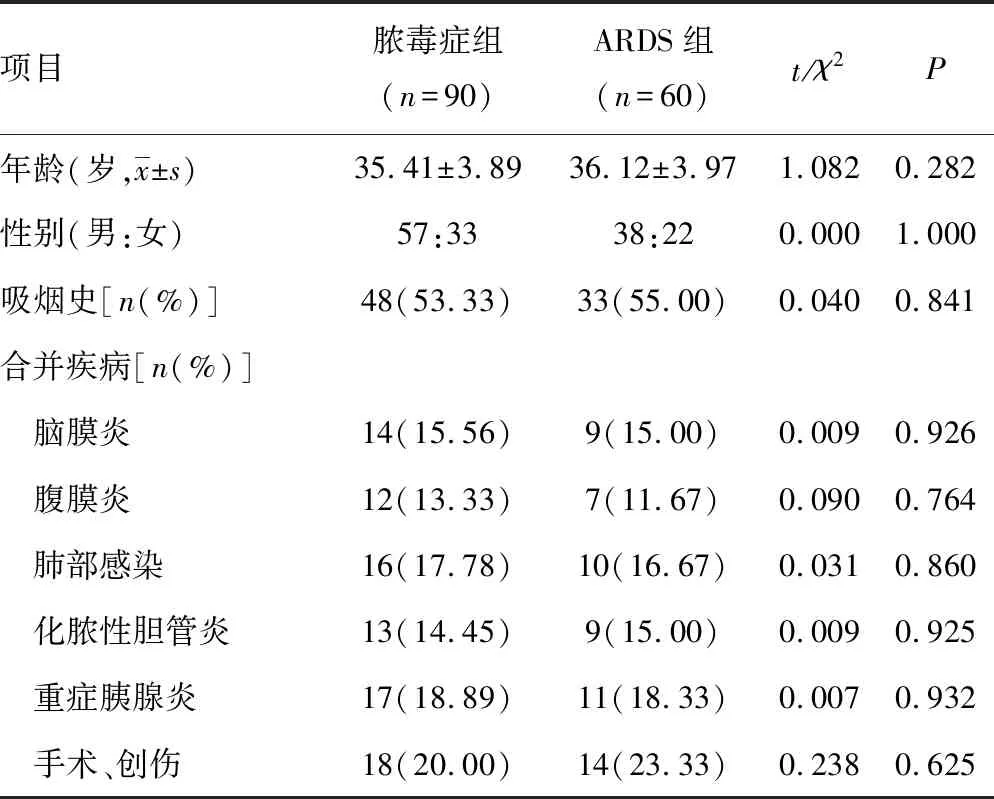
表1 两组患者基线资料对比
1.3方法
1.3.1标本收集 所有病例均于确诊为脓毒症时抽取肘静脉血3 mL,弃除前2 mL以避免针头对血管刺激引起血小板活化,将剩余1 mL置于乙二胺四乙酸二钾(EDTA-K2)抗凝的流式检测管中。
1.3.2标本检测 使用FACS Calibur流式细胞仪(美国Becton Dickinson公司)进行检测,检测前首先用Flow Check荧光微球进行光路和流路校准,并根据CD45阳性将白细胞与其他血细胞及细胞碎片区分,根据CD42阳性区分未与血小板结合的白细胞,以CD45与CD42a双阳性代表PLA,结果用PLA与白细胞的数量百分比表示,PLA(%)=[(CD45+CD42a双阳性颗粒) /CD45阳性颗粒]×100%,并同时记录PLA、PMA、PLyA、PNA的百分比。
1.3.3评价指标 比较两组患者血清PLA、PMA、PNA、PLyA水平和APACHEⅡ、SOFA评分(入院24 h完成,取最差值),“ARDS柏林定义”作为“金标准”,绘制受试者工作特征(ROC)曲线评价上述各指标对ARDS的预测价值。诊断价值包括诊断准确率、灵敏度、特异度、阳性预测值和阴性预测值。准确率=(真阳性数+真阴性数)/总例数×100%,灵敏度=真阳性数/(真阳性数+假阴性数)×100%,特异度=真阴性数/(真阴性数+假阳性数)×100%,阳性预测值=真阳性数/(真阳性数+假阳性数)×100%,阴性预测值=真阴性数/(真阴性数+假阴性数)×100%。

2 结 果
2.1两组各项指标间的对比 ARDS组患者的PLA和PMA水平以及APACHE Ⅱ和SOFA评分明显高于脓毒症组,差异有统计学意义(P<0.05),ARDS组和脓毒症组的PNA和PLyA水平比较,差异无统计学意义(P>0.05),见表2。

表2 两组各项指标水平和评分对比

图1 应用不同指标预测脓毒症合并ARDS的ROC曲线
2.2应用不同指标预测脓毒症合并ARDS的ROC曲线 ROC曲线显示,PMA预测脓毒症合并ARDS的曲线下面积最高(AUC=0.860,P=0.029),其次为SOFA评分、APACHEⅡ评分和PLA(AUC=0.741,0.723,0.669,P=0.040、0.044、0.046),其中PMA的AUC分别高于PLA(Z=3.469,P=0.001)、APACHEⅡ评分(Z=2.536,P=0.011)和SOFA评分(Z=2.430,P=0.015),PMA的最佳截点为≥13.99%,见图1、表3。
2.3不同指标预测脓毒症合并ARDS的诊断效能 PMA预测脓毒症患者发生ARDS的准确率、灵敏度、特异度、阳性预测值和阴性预测值均分别高于PLA、APACHEⅡ评分和SOFA评分。其中,PMA预测的灵敏度为86.67%,明显高于其他几项指标预测的灵敏度(F=9.257,P=0.004),见表4。

表3 应用不同指标预测脓毒症合并ARDS的曲线下面积
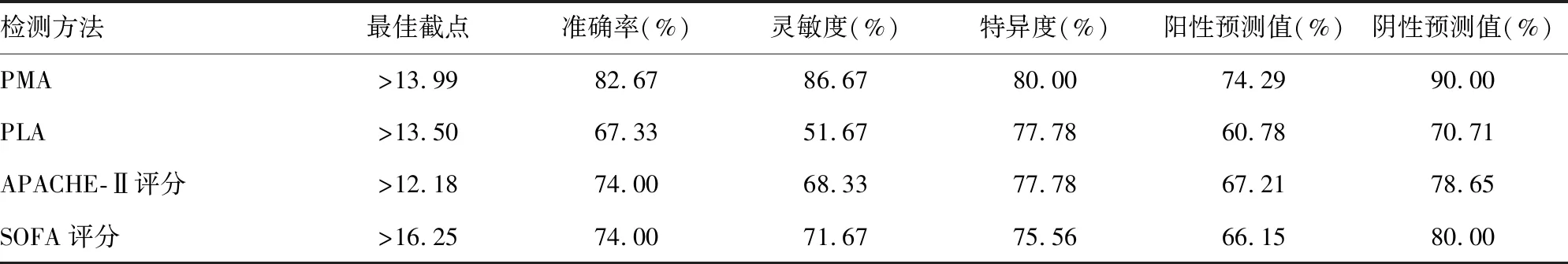
表4 不同指标预测脓毒症合并ARDS的诊断效能
3 讨 论
受炎症和凝血反应的影响,部分脓毒症患者病情进展迅速,可在短时间内并发ARDS。而随着外科手术、严重感染、车祸、创伤、急腹症等诱发因素的持续影响,脓毒症合并ARDS的发生率呈逐年增加趋势,严重影响脓毒症患者的治疗和预后(病死率高达40%)[7]。对ARDS早期预测并及时干预可以减少ARDS的发生和降低死亡风险。目前主要通过监测血氧饱和度水平来预测,但其特异度和灵敏度相对较低。血小板的过度活化是脓毒症并发ARDS的重要因素,其中,PLA在血小板活化和炎性反应中起着桥梁作用,并与肺部损伤呈现明显的相关性。外周血PLA及其分类的水平可以通过流式细胞仪进行实时、定量检测,技术成熟、可靠[8],其或许可成为早期预测脓毒症合并ARDS的主要生物标志物量化指标。
脓毒症时在内外毒素的共同作用下,活化的炎症细胞大量释放炎症因子和细胞因子,形成正反馈级联反应导致血管内皮细胞损伤,内皮细胞下胶原暴露引起血小板活化与白细胞的黏附,形成PLA[9]。而在并发ARDS后,白细胞不仅释放大量的蛋白酶损伤肺泡细胞、增加毛细血管通透性和扰乱肺通气血流比值,造成呼吸窘迫[10],还促进组胺、白三烯等促炎介质的大量释放造成肺毛细血管内皮细胞受损,进一步放大脓毒症对于血小板和单核细胞的激活效应,进而提高PLA水平,特别是其中PMA的水平[11]。本研究对150例脓毒症患者确诊时的PLA及其分类水平与是否发生ARDS进行分析,由表2结果可见,ARDS组患者的血清PMA、PLA高于脓毒症组,这提示合并ARDS的患者具有更高的PMA水平。PMA是指血小板与单核细胞的聚集体,主要由单核细胞和血小板活化、聚集结合形成[12]:活化的血小板表面表达大量的P-选择素,并与单核细胞表面P-选择素受体-1(PSGL-1)结合,而单核细胞在炎性反应时其表面较中性粒细胞和淋巴细胞PSGL-1的表达更为显著,因而表现出更为明显的差异性[13]。宗晓龙[14]的研究显示,ARDS患者血清PMA升高与炎症介质的释放密切相关,其水平升高是血管内皮细胞损伤和血管通透性增加的重要标志,在预测ARDS发生中具有较高的临床价值。此外,还有研究报道,PMA可能是更敏感的血小板活化指标,其在启动外源性凝血途径中具有重要作用[15],与ARDS肺毛细血管微血栓形成关系密切,可造成低氧血症的进一步加重[16]。
本研究中,由ROC曲线分析可见PMA预测脓毒症合并ARDS的曲线下面积最高,并明显高于APACHEⅡ和SOFA评分以及PLA水平,且以PMA≥13.99%作为最佳截点时,预测脓毒症患者发生ARDS的灵敏度为86.67%,明显高于PLA水平、APACHEⅡ评分和SOFA评分(P<0.05)。目前已有的检测血小板活化指标如P-选择素、溶酶体蛋白等多通过间接或半定量测定,缺乏一定准确率和灵敏度;PMA与其他PLA分类指标相比,在血小板和白细胞聚集过程中,单核细胞与血小板聚集的时间更早,聚集物占比率更高,因而PMA相较于以往作为“金标准”的P-选择素灵敏度更高,可作为评价血小板活化和预测ARDS的指标[17]。此外,与常用的APACHEⅡ和SOFA危重评分相比,PMA显示出了较高的预测ARDS的效能,这与RONDINA等[18]应用PMA水平预测脓毒症患者预后的结果较为相似,WU等[19]研究认为,与危重评分中的呼吸循环等常规指标相比,PMA水平能够更早的反映机体(尤其是肺部)的炎症程度,对于ARDS的预后具有更好的灵敏度。
4 结 论
综上所述,脓毒症合并ARDS患者具有较高的外周血PLA水平,其中PMA升高更为明显;PMA早期预测ARDS的灵敏度更高,其最佳截点为≥13.99%。

