大肠癌组织中VEGF-D、VEGFR-3表达及淋巴管生成的相关性研究
朱建洲,于 农,刘 芳
(苏州高新区人民医院检验科,江苏苏州 215129)
随着人们生活水平提高、饮食结构的变化,我国大肠癌的发病率逐渐升高,严重威胁着人们的生命健康[1]。目前已经研究发现,淋巴转移是影响大肠癌患者预后的一个主要因素,淋巴管可作为癌细胞转移和扩散的主要通道,肿瘤微转移,特别是淋巴结微转移逐渐受到临床重视[2-3]。随着现代生物学和免疫学检测技术的发展,最新研究发现,血管内皮生长因子D(VEGF-D)及其受体VEGFR-3的表达与淋巴管的生成密切相关,探讨VEGF-D、VEGFR-3与临床病理参数的关系,研究影响大肠癌淋巴管生成及转移的机制,对大肠癌临床分析、预后判断以及抗癌方法的制定都有着重要的意义[4-5]。因此本次研究特选取本院大肠癌患者83例,分别取其癌标本和癌旁大肠组织,现将结果报道如下。
1 资料与方法
1.1一般资料 选取本院2014年8月至2016年8月收治的大肠癌患者83例,其中男58例,女25例,年龄47~79岁,平均(63.17±14.68)岁;结肠癌39例,直肠癌46例;肿瘤直径为1~12 cm,平均(6.57±4.29)cm;溃疡性生长37例,浸润型生长33例,肿块型生长13例;高分化17例,中分化47例,低分化19例;根据Dukes分期:A期19例,B期21例,C期32例,D期11例。纳入标准:(1)经肠镜检查确诊为大肠癌;(2)无消化性溃疡以及胃肠道手术病史;(3)手术前均未进行任何治疗;(4)患者对本次研究知情并签署知情同意书。排除标准:(1)术前进行过化疗治疗者;(2)不适宜进行手术者。
1.2方法 每例大肠标本取大肠癌组织及距离癌肿边缘5 cm,经病理证实无癌细胞残存的正常肠组织1块,所有标本在肿瘤切下后1 h内置于液氮中保存。应用流式细胞术与免疫组化法对大肠癌组织和正常组织中的VEGF-D、VEGFR-3的表达进行检测,VEGF-D、VEGFR-3抗体均购自武汉博士德生物技术有限公司,免疫组化试剂盒购自北京中杉金桥生物技术有限公司。(1)流式细胞检测:选取待测的新鲜组织约30 g,用剪刀将组织剪碎,用镊子将组织物在120目锈钢网上轻轻搓动,收集搓完后组织,制成1×106个/mL的单细胞原液,取出1 mL原液分别加入VEGF-D、VEGFR-3抗体,操作步骤严格按照说明书进行。(2)免疫组化法:根据试剂盒说明滴加一抗VEGF-D、VEGFR-3和生物素化二抗及试剂SABC,用DBA显色,苏木素复染,中性树脂封片待检。每张切片观察10个高倍视野,以细胞中有棕黄色颗粒且染色强度高于背景非特异性着色为阳性细胞。
1.3观察指标 (1)采用美国BD公司生产的流式细胞仪测定VEGF-D、VEGFR-3水平,以荧光指数(FI)表达VEGF-D、VEGFR-3的相对含量,计算公式:FI=蛋白表达的平均荧光强度-对照样品平均荧光强度/正常对照样品平均荧光强度。(2)微血管计数在盲法下进行,每张切片由两名病理医师分别进行计数,微血管密度(MVD)的计数根据淋巴管淋巴管内透明质酸受体-1(LYVE-1)、同源异型核转录因子(Prox-1)染色结果判断,LYVE-1、Prox-1阳性的管腔视为淋巴管,先于低倍镜(40倍和100倍)下确定3个脉管着色最为密集的区域,然后改为200倍视野下计数淋巴管或微血管数目,每例计数5个视野,取其均值作为该病例的微淋巴管密度和微血管密度。正常大肠组织选择阳性染色脉管最丰富的区域,在200倍视野下分别计算淋巴管和微血管数目,计数5个视野,最后取其均值。LYVE-1、Prox-1的检测分别应用山羊抗人LYVE-1单克隆抗体和山羊抗人Prox-1单克隆抗体进行免疫组织化学染色。

2 结 果
2.1VEGF-D、VEGFR-3在大肠癌、正常肠组织中的表达 大肠癌组织中VEGF-D、VEGFR-3表达水平较正常大肠黏膜组织显著升高,差异有统计学意义(P<0.05)。见表1。

表1 VEGF-D、VEGFR-3在大肠癌、正常肠组织中的表达

表2 VEGF-D、VEGFR-3的表达与大肠癌临床病理特征的关系
2.2VEGF-D、VEGFR-3的表达与大肠癌临床病理特征的关系 肿瘤直径<3 cm的大肠癌患者VEGF-D、VEGFR-3水平均显著低于肿瘤直径≥3 cm的患者,差异有统计学意义(P<0.05);浸润深度未及浆膜患者VEGF-D、VEGFR-3水平均显著低于浸润浆膜及以外患者,差异有统计学意义(P<0.05);Dukes分期为A+B期患者VEGF-D、VEGFR-3水平均显著低于C+D期患者,差异有统计学意义(P<0.05)。见表2。
2.3微淋巴管密度与VEGF-D、VEGFR-3表达的关系 VEGF-D、VEGFR-3蛋白表达阳性标本其癌旁微淋巴管密度较阴性标本均显著较高,差异有统计学意义(P<0.05)。见表3。
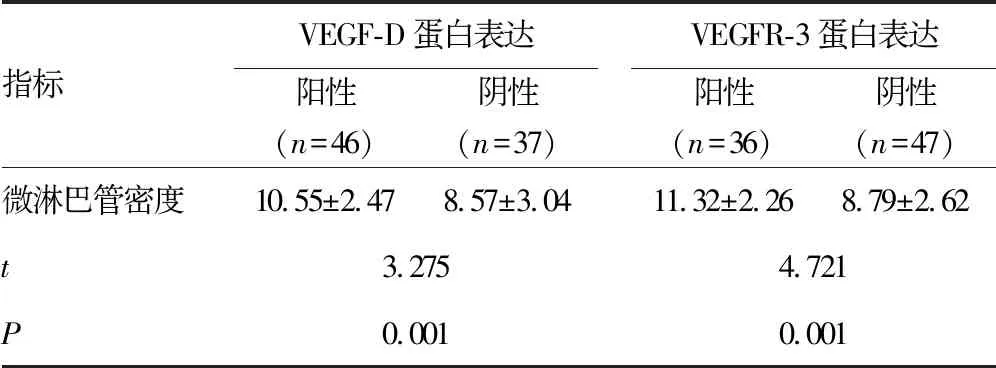
表3 微淋巴管密度与VEGF-D、VEGFR-3表达的关系
3 讨 论
近年来,我国大肠癌的发病率呈逐年上升趋势,严重危害着人们的生命健康。浸润与转移是恶性肿瘤重要的生物学特性,随着研究的深入人们发现,淋巴转移是导致癌细胞发生转移的主要途径[6-7]。正常的大肠组织的毛细血管管腔较小,且数量较少,而恶性肿瘤周边的淋巴管密度会显著增加,淋巴转移提示着肿瘤的发展,而淋巴管腔的生成是受淋巴管生成因子以及其受体介导和调控的,对淋巴管生成因子及其受体的表达进行探究,对大肠癌患者预后的判断有着重要意义[8-9]。血管内皮生长因子(VEGF)是内皮细胞中具有特异性的有丝分裂原,具有明显的促进某些内皮细胞有丝分裂的作用,特别是促进血管的生成[10]。VEGF-D属于VEGF,是一种重要的淋巴管生成因子,可以作用于淋巴管内皮细胞上与其受体VEGFR-3结合并激活,促进淋巴管内皮细胞的增殖和淋巴管的生成,调控血管以及淋巴管内皮细胞的新生,在肿瘤的生长和转移方面起着重要的作用[11-12]。VEGFR-3是一种受体络氨酸激酶,广泛分布于早期的胚胎血管内细胞上,在胚胎发育后期以及正常的成体中,VEGFR-3只特异性表达在淋巴管内皮细胞中,处于相对静止的状态,而一旦机体发生炎性反应或有肿瘤生成,VEGFR-3便会再次被激活与其配体结合,诱导内皮细胞的增殖与迁移[13-14]。
赵云霞等[15]研究者认为,在恶性肿瘤组织中VEGF-D的表达诱导会使VEGFR-3水平上升,并激发VEGFR-3活化,活化后的VEGFR-3介导的信号转导通路会促使淋巴管生成,导致癌细胞的浸润和转移。通过本次研究发现,大肠癌组织中VEGF-D、VEGFR-3表达水平较正常大肠黏膜组织显著较高,这说明VEGF-D的高表达与大肠癌的生长、转移有关,VEGF-D、VEGFR-3表达的升高能反应肿瘤预后情况,能继续促进淋巴管内皮的生长。肿瘤直径<3 cm的大肠癌患者VEGF-D、VEGFR-3水平均显著低于肿瘤直径≥3 cm的患者,浸润深度未及浆膜患者VEGF-D、VEGFR-3水平均显著低于浸润浆膜及以外患者,Dukes分期为A+B期患者VEGF-D、VEGFR-3水平均显著低于C+D期患者,VEGF-D、VEGFR-3的表达能反应大肠癌临床病理特征,提示VEGF-D、VEGFR-3参与到了肿瘤的生长、浸润与转移。VEGF-D与VEGFR-3相结合,诱导肿瘤内以及肿瘤周边淋巴管的增生,淋巴管的表面积以及通透性增加,趋化肿瘤细胞进入到淋巴管内,肿瘤细胞通过间质液流动运转至淋巴管中,最终发生淋巴转移[16-17]。VEGF-D、VEGFR-3蛋白表达阳性标本其癌旁微淋巴管密度较阴性标本均显著较高,VEGFR-3与VEGF-D结合后发生磷酸化,使多条细胞内信号传导通路被激活,淋巴内皮细胞发生增殖分化,新生的淋巴管尚且缺乏连续的基底膜,内皮细胞间的连接较为疏松,且间隙较大,而肿瘤内的淋巴管较为密集,随着肿瘤的生长,瘤间质渗出物的增加,逐渐向周围毛细淋巴管扩张,因此肿瘤周边的淋巴管密度较正常组织更为密集。
4 结 论
在大肠癌发生发展过程中,VEGF-D、VEGFR-3发挥了一定作用。大肠癌中VEGF-D、VEGFR-3可能与肿瘤周边淋巴管生成相关,其表达上升诱导淋巴管生成。可将VEGF-D、VEGFR-3作为评估大肠癌淋巴结转移、淋巴管浸润能力的辅助指标。

