一种基于重组截短Gcaa407~614蛋白的赤羽病病毒抗体间接ELISA方法的建立
王建华,赵 丹,陈本龙,张俊哲,王玉玲,肖 妍
(天津海关,天津 300456)
赤羽病是由赤羽病病毒(Akabane virus,AKAV)引起的牛、绵羊和山羊等动物的一种通过吸血蚊和库蠓等传播的虫媒传染病,临床上以流产、早产,产死胎、木乃伊以及胎儿畸形、新生胎儿关节弯曲和积水性无脑综合征为特征[1]。本病主要在非洲以及澳大利亚、日本和韩国等一些热带和亚热带地区流行[2-5]。20世纪90年代以来,我国上海、天津和新疆等地均有本病的报道[6-7]。该病给流行国家及地区的牛、羊养殖业造成了一定经济损失。随着全球性气温变暖,本病流行的范围和时间呈扩大和延长趋势,对我国牛、羊养殖业的威胁不容忽视。在病毒学分类上,AKAV属于布尼病毒科(Buny aviridae)布尼病毒属辛布(Simbu)病毒血清群成员,为单股负链RNA 病毒。其基因组由大(L)、中(M)、小(S)3个RNA 片段构成,其中M RNA 编码1个由1 401个氨基酸组成的M蛋白前体。该前体进一步裂解为Gn 和Gc囊膜糖蛋白和1个非结构Nsm蛋白[8-9]。研究证实,AKAV Gc蛋白为由869个氨基酸组成的囊膜蛋白,不仅参与病毒粒子对宿主细胞的侵入、装配和成熟过程,也可刺激动物机体产生中和抗体[10-12],提示该蛋白可作为检测AKAV抗体的候选抗原之一。针对AKAV血清抗体的检测,目前国内外已建立了琼脂凝胶免疫扩散试验、血凝抑制试验和微量血清中和试验(SNT)。这些方法特异性较好,但敏感性较低。酶联免疫吸附试验(ELISA)结合仪器设备特别适合大量血清样本的抗体检测,是当前国内外多数动物疫病血清抗体检测的首选方法和研发重点。目前仅有IDvet等少数几家外国公司研制出商品化的AKAV抗体ELISA检测试剂盒。国内对进境奶牛的赤羽病检疫仍严重依赖国外生产的抗体检测试剂盒,且来源受限,检疫成本高。因此,开展这方面的研究工作,对于提升我国赤羽病检疫与防制能力具有重要的实际意义。本研究基于重组截短Gcaa407~614蛋白建立了一种AKAV抗体间接ELISA检测方法,并进行了特异性、敏感性、准确性和重复性等试验,为进一步研制AKAV抗体ELISA检测试剂盒提供了依据。
1 材料与方法
1.1 菌株、参考血清和主要试剂
宿主菌E.coli. BL21(DE3):Biomed公司产品;牛白血病阳性血清、牛传染性支气管炎阳性血清、牛蓝舌病阳性血清、牛病毒性腹泻-黏膜病阳性血清、IDvet Screen Akabane Compitition试剂盒:ID.vet公司产品;山羊抗AKAV阳性血清:用纯化的AKAV抗原免疫山羊制备的抗血清,由昆明海关检验检疫技术中心艾军博士馈赠;AKAV阳性牛血清、阴性牛血清:采自经IDvet Screen Akabane Compitition试剂盒和微量血清中和试验检测结果分别为强阳性和阴性牛的血清,由天津海关动植物与食品检测中心反刍动物检疫实验室保存;HRP标记的兔抗山羊二抗、山羊抗牛二抗:JACKSON 公司产品;氨苄青霉素、IPTG和Ni2+-NTA Agarose:GIAGEN 公 司 产 品;BugBuster®Master Mix和Immobilon-PSQPVDF膜:MERCK公司产品;DAB显色试剂盒:碧云天生物技术公司产品。
1.2 AKAV Gc蛋白抗原表位区预测和主要抗原区原核表达载体的构建
使用IEDB数据库(Immune Epitope Database,http∶//www.iedb.org/)的在线分析软件Bepipred Linear Epitope Prediction 2.0,对AKAV Gc蛋白(GenBank:BAG54921.1)进行线性抗原表位区预测分析,选取包含Gc蛋白主要线性抗原表位区域的编码序列,送由上海捷瑞生物技术公司经密码子优化后进行人工合成,以BamHⅠ/SalⅠ位点连接到原核表达载体pET-32a(+),构建重组表达载体,命名为 PET-32a(+)-Gcaa407~614,通过测序证实插入的表达序列是否正确。
1.3 重组蛋白诱导表达
将重组表达载体 PET-32a(+)-Gcaa407~614转化的E.coli BL21(DE3)工程菌扩大培养,按1%的比例接种于含Amp(终浓度为50 μg/mL)的新鲜LB培养基中,37 ℃振荡培养至OD600nm=0.6时,加入 IPTG 至终浓度为 1 mmol/L,37 ℃诱导培养6 h,离心收集菌液;按5 mL/g湿菌比例,加入细菌裂解液BugBuster®Master Mix,混匀,作用10 min,4 ℃、12 000 r/min 离心20 min,分别收集菌体的裂解液、上清和沉淀,加入等量2×Loading Buffer,沸水水浴5 min;按常规方法进行SDSPAGE,分析重组蛋白的表达情况。
1.4 重组蛋白纯化与复性
用500 mL新鲜LB培养液按1.3的条件诱导培养重组菌,6 000 r/min 离心5 min,收集菌体,用0. 1 mol/L、pH7.5的PBS液洗涤菌体1次,6 000 r/min 离心5 min,收集菌体,然后按5 mL/g 湿菌比例,加入细菌裂解液BugBuster®Master Mix,混匀,冰浴10 min,4 ℃、12 000 r/min 离心20 min,加入20 mL含2%脱氧胆酸钠的包涵体洗涤液,室温振荡洗涤30 min,4 ℃、12 000 r/min 离心10 min,弃上清,用8 mol/L尿素溶解包涵体沉淀。将包涵体溶解液移入装有Ni+-NTA树脂的重力柱,在室温条件下结合1 h,用40 mmol/L咪唑浓度的洗涤液(8 mol/L尿素、50 mmol/L NaH2PO4、300 mmol/L NaCl、40 mmol/L咪唑,PH8.0)洗涤3次,每次10 min,最后用300 mmol/L咪唑浓度的洗脱液(8 mol/L尿素、50 mmol/L NaH2PO4、300 mmol/L NaCl、300 mmol/L咪唑,PH8.0)洗脱重组蛋白。将纯化的重组蛋白trGcaa407~614转入透析袋中,在4 ℃、缓慢磁力搅拌条件下,放入0. 1 mol/L PBS液(pH7.5)中透析,每隔12 h更换1次透析液,共3次。用IMPLEN超微量分光光度计测定重组蛋白浓度,用SDS-PAGE分析重组蛋白trGcaa407~614的纯度,-20 ℃分装保存。
1.5 重组蛋白抗原性鉴定
将纯化的trGcaa407~614经SDS-PAGE电泳后转移至PVDF膜上,用Quickblok TM封闭液封闭过夜,洗涤;一抗为1∶50稀释的山羊抗AKAV阳性血清,37 ℃ 孵育1 h,洗涤;二抗为1∶5 000稀释的HRP标记的兔抗山羊二抗IgG,37 ℃ 孵育1 h,洗涤;使用DAB试剂盒显色,拍照。
1.6 间接ELISA方法建立
1.6.1 抗原最佳包被浓度及抗体最适稀释倍数确定 用0.05 mol/L pH9.6的碳酸盐缓冲液,将纯化的 trGcaa407~614作 0.5、1.0、2.0、4.0 和 8.0 μg/mL 5个稀释,包被酶标板,100 μL/孔;将AKAV阳性牛血清和阴性牛血清分别用抗体稀释液倍比稀释(体积比分别为 1∶40、1∶80、1∶160、1∶320)后加入酶标板,100 μL/孔;按常规间接 ELISA法操作,以方阵法进行试验,选择P/N(阳性血清OD450nm/阴性血清OD450nm)最大,且P在1.0左右的抗原包被浓度和血清稀释倍数作为抗原最佳包被浓度和抗体最适稀释倍数。
1.6.2 最佳封闭液确定 分别选择1.0%明胶、5%小牛血清、5%马血清、5%兔血清和2% BSA作为封闭液,封闭2 h,用阴、阳性血清按照前述ELISA步骤和判断方法进行试验,选择最佳封闭液。
1.6.3 酶标抗体最佳工作浓度确定 将HRP标记的山羊抗牛IgG-HRP二抗分别作1∶2 500、1∶5 000、1∶10 000、1∶20 000、1∶40 000 的倍比稀释,加入酶标板,100 μL/孔,用阴、阳性血清按照前述ELISA步骤和判断方法进行试验,选择最佳酶标二抗工作浓度。
1.6.4 阴阳性临界值判定标准确定 取32份经IDvet Screen Akabane Compitition试剂盒和微量血清中和试验检测结果为阴性的牛血清,按优化后的间接ELISA法进行检测。将32份阴性血清的平均OD450nm值和3倍标准方差之和(X+3SD)作为阴性样品值的上限,则待检血清样品的OD450nm值大于该上限时判定为阳性,反之为阴性。
1.6.5 特异性试验 对牛传染性鼻气管炎病毒(IBRV)阳性血清、牛病毒性腹泻病毒(BVDV)阳性血清、牛白血病病毒(BLV)阳性血清和蓝舌病病毒(BTV)阳性血清以及阴性血清,按优化后的间接ELISA 法进行检测,考察该方法的特异性。
1.6.6 敏感性试验 将AKAV阳性牛血清分别做 1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280、1∶3 200的倍比稀释,按优化后的间接ELISA 法进行检测,考察该方法的敏感性。
1.6.7 重复性试验 以同一批次制备的纯化trGcaa407~614作为包被抗原,按优化的间接ELISA 法分别检测3份血清样品,每份样品重复3孔,考察该方法的批内重复性;另以不同批次制备的纯化trGcaa407~614作为包被抗原,按优化的间接ELISA 法分别检测3份血清样品,每份样品重复3孔,考察该方法的批间重复性。
1.7 临床样本检测
选取273份本实验室保存的2015—2018年来自澳大利亚进口奶牛的血清样本(这些样本预先经IDvet Screen Akabane Compitition试剂盒和微量血清中和试验检测),用本研究建立的间接ELISA法进行AKAV抗体检测,并与这两种方法的检测结果进行比较。
2 结果
2.1 Gc蛋白主要抗原区预测及重组表达载体构建
对AKAV Gc蛋白主要线性抗原表位区域的预测结果见表1。由表1可知,在Gc蛋白中可能存在3个主要线性抗原表位区域(Val247—Gln376、Arg380—Gly576和 Cys635—Gly810),分别由130、197和176个氨基酸组成,选取基本涵盖Gc蛋白第2个主要线性抗原表位区域的Gln407—Gly614氨基酸编码序列作为表达序列,对该序列经密码子优化后进行人工基因合成,与原核表达载体pET-32a(+)连接,构建重组表达载体PET-32a(+)-Gcaa407~614,经测序证实所合成的基因序列及其编码氨基酸序列完全正确,具体见图1。

图1 人工合成的DNA序列及编码的氨基酸序列
2.2 重组蛋白诱导表达及纯化
SDS-PAGE结果显示,在37 ℃、1 mmol/L的IPTG诱导后6 h,含有原核表达载体PET-32a(+)-Gcaa407~614的重组菌裂解液在约46 kD处出现特殊的蛋白条带,与预期的重组蛋白分子量一致,而未诱导的重组表达菌裂解液中缺失此蛋白条带,用凝胶成像仪蛋白条带分析软件测得该重组蛋白的表达量约占菌体总蛋白的30%左右,进一步分析表明表达的重组蛋白以包涵体形式表达。对用8 mol/L尿素变性的包涵体采用Ni+2-NTA树脂的重力柱洗脱法进行纯化,选取20~80 mmoL/L咪唑浓度分别进行洗涤。试验结果显示,用40 mmoL/L咪唑浓度的洗涤液洗涤杂蛋白,获得了纯度和浓度分别为94%和2.4 mg/mL的重组蛋白,取得较好的纯化效果,命名为 trGcaa407~614,见图 2。

表1 AKAV Gc蛋白线性抗原表位区域预测结果

图2 重组蛋白trGcaa407~614的表达和纯化的SDS-PAGE分析
2.3 重组蛋白Western blot鉴定
以山羊抗AKAV阳性血清对纯化的重组蛋白进行Western blot检测,发现在约46 kD处出现1条清晰的特异性反应条带(图3),表明重组蛋白trGcaa407~614可被山羊抗AKAV阳性血清识别。

图 3 重组蛋白 trGcaa407~614 的 Western blot分析
2.4 间接ELISA方法的建立
2.4.1 抗原最佳包被浓度及抗体最适稀释倍数确定 结果如表2所示,当抗原包被浓度为4.0 μg/mL时,血清浓度为1∶80,此时P/N值最大(8.59),阳性血清 OD450nm≥1。因此,抗原最佳包被浓度为4.0 μg/mL,血清最适稀释倍数为1∶80。
2.4.2 最佳封闭液的确定 结果如表3所示,封闭液选择1.0%明胶时,P/N值最大且阳性血清≥1.0,阴性血清OD450nm<0.3。

表2 最适抗原包被浓度和血清稀释度确定
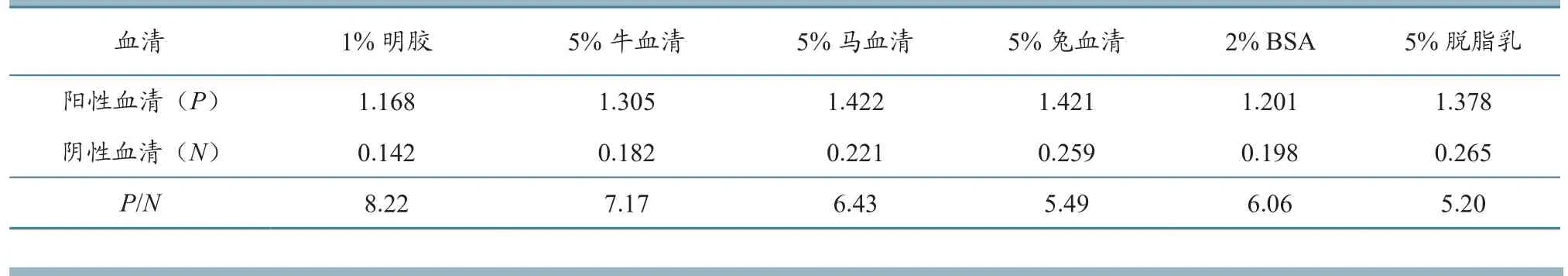
表3 不同封闭液条件下AKAV阴、阳性血清检测结果(OD450 nm)

表4 酶标抗体最佳工作浓度确定
2.4.3 酶标抗体最佳工作浓度确定 结果如表4所示,当酶标二抗选择1∶5 000浓度时,P/N值最大且阳性血清OD450nm≥1.0,阴性血清OD450nm<0.3。
2.4.4 阴阳性临界值判定标准确定 结果如表5所示,32 份阴性样品的平均OD450nm值为 0.207,SD值为0.037,阴性样品值的上限X+3SD=0.207+3×0.037=0.318。因此,当待检血清样品的OD450nm值大于0.318时判定为阳性,小于或等于0.318时判定为阴性。
2.4.5 特异性试验 结果如图4所示,仅有AKAV阳性血清的检测结果为阳性,而IBRV、BVDV、BLV和BTV的阳性血清检测结果为阴性,表明该trGcaa407~614-ELISA方法具有良好的特异性。
2.4.6 敏感性试验 结果如图5所示,当血清做1∶1 280 稀释时,OD450nm值高于0.318,表明该trGcaa407~614-ELISA 方法对 1∶1 280 稀释的 AKAV 阳性血清仍可检出阳性。
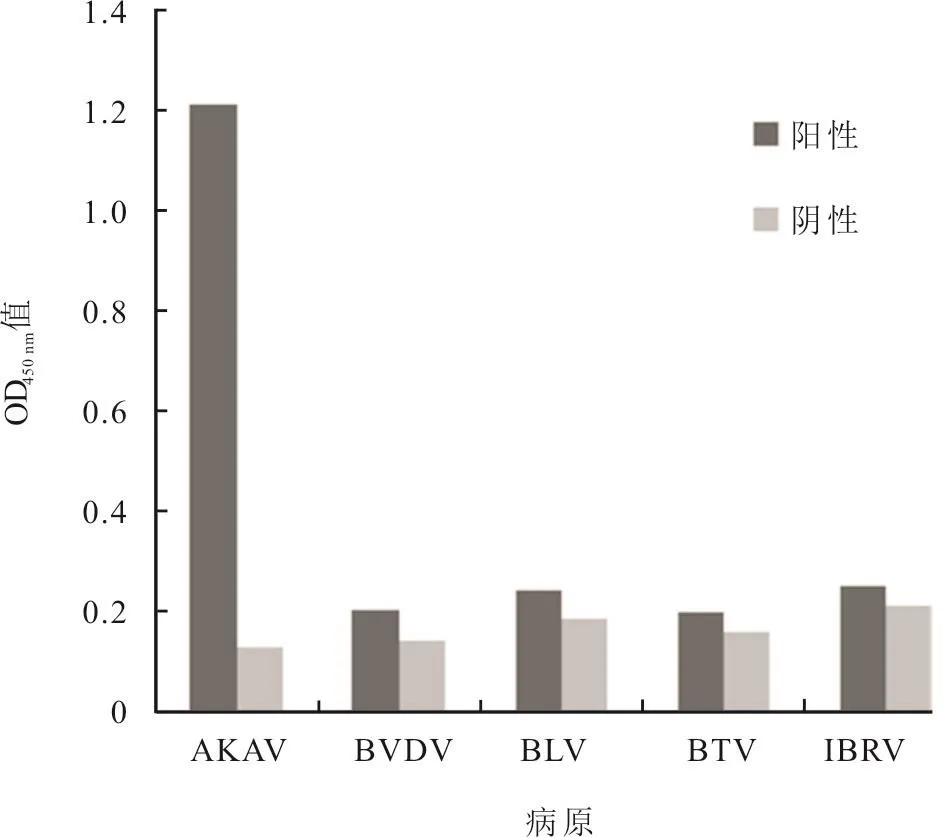
图4 特异性试验结果
2.4.7 重复性试验 结果如表6所示,3份血清样品的批内重复试验和批间重复试验的变异系数均低于10%,表明该trGcaa407~614-ELISA方法具有良好的重复性。

表5 AKAV阴性血清检测结果

表6 重复性试验结果
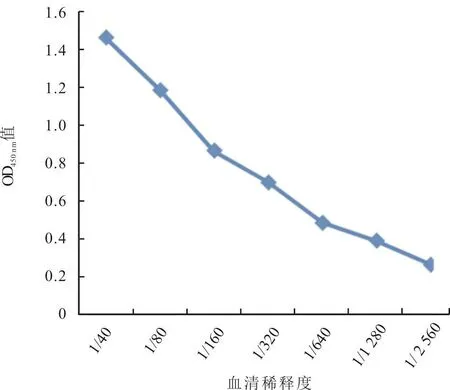
图5 敏感性试验结果
2.5 临床样本检测
用本研究建立的间接ELISA法对273份血清样本进行抗体检测,发现在11份经IDvet Screen Akabane Compitition试剂盒检测为阳性的牛血清中,8份 为 SNT检 测 阳 性,10份 为 trGcaa407~614-ELISA检测阳性(表7),trGcaa407~614-ELISA方法与SNT和IDvet Screen Akabane Compitition试剂盒检测的阳性符合率分别为80.0%(8/10)和90.9%(10/11)。
3 讨论
近年来我国在AKAV抗体ELISA检测方法的研究方面取得了一些进展,但仍然处于试验和评价阶段。已报道的AKAV抗体ELISA检测方法多采用纯化的全病毒抗原或表达的重组核蛋白抗原为包被抗原[12-14],由于辛波病毒群S基因序列同源性很高,其编码的N蛋白是群特异性抗原,易与同群的病毒感染产生的抗体发生交叉反应,因此基于全病毒抗原或表达的重组核蛋白抗原建立的AKAV抗体ELISA检测方法在特异性等方面还存在亟待解决的技术问题。研究发现,辛布病毒群M基因节段的序列变异性较大,其编码Gc蛋白的氨基酸序列同源性仅为33.1%~47.3%,而Gc蛋白在AKAV各分离株之间的同源性却很高[15-18],这提示选用Gc蛋白为检测抗原,可能是提高AKAV血清抗体ELISA检测方法特异性的有效途径。与AKAV全抗原制备工艺和成本相比较,利用原核表达系统制备重组Gc蛋白,具有表达量高、生产周期短和成本低的优点,在AKAV抗体ELISA检测试剂盒研发上具有实际应用价值。为此,本研究基于对AKAV Gc蛋白线性抗原表位区域的在线预测分析结果,选取Gc蛋白Gln407—Gly614区域的编码基因序列,按照大肠杆菌密码子的偏爱性进行了密码子优化和人工合成,通过构建重组原核表达载体实现了该编码序列在大肠杆菌中的高效表达。Western blot结 果 显 示, 重 组 rHis-Gc407aa—614aa蛋白能够被AKAV阳性血清识别,具有良好的抗原性。本研究利用Ni+2-NTA树脂亲和层析方法,获得了较高浓度和纯度的重组蛋白trGcaa407~614,并以该纯化的重组蛋白建立了间接ELISA方法。试验结果表明,该ELISA方法检测AKAV抗体具有较好的特异性、敏感性和重复性。SNT试验是确定AKAV抗体阳性血清的标准方法,其对273份血清样本的AKAV抗体检测结果表明,本研究建立的间接ELISA法的检出率略高于SNT方法,但低于商品化的IDvet Screen Akabane Compitition试剂盒,提示本研究建立的间接ELISA法有待于进一步改进和完善。为此,在后续研究工作中,将以重组蛋白trGcaa407~614为抗原制备特异性单克隆抗体,建立基于trGcaa407~614及其单克隆阿抗体的阻断ELISA方法,从而更好地保证AKAV抗体ELISA检测方法的特异性。

表7 trGcaa407-614-ELISA对273份血清样本的检测结果

