1,25-(OH)2-D3对脑梗死大鼠神经功能、脑组织内细胞凋亡及Wnt/β-catenin通路的调节作用
杨国防,刘向哲,王彦华,王新志,彭珂
(1.河南中医药大学第一附属医院脑病一区,河南郑州450000;2.河南中医药大学,河南郑州450000)
脑梗死是临床上常见的脑血管疾病,颅内动脉的闭塞会引起脑组织发生不可逆的缺血缺氧性损害[1]。近年来溶栓治疗、介入治疗等再灌注治疗手段发展迅速,虽然脑梗死发生后尽早进行再灌注治疗能够有效恢复缺血脑组织的血供,但神经细胞对缺血缺氧的耐受性差,再灌注治疗时已经发生了不同程度的缺血缺氧损害,容易在治疗后遗留神经功能缺损[2]。1,25-(OH)2-D3是体内维生素D的活性形式,由维生素D经两次羟基化反应合成,不仅参与钙磷代谢的调控,还被证实能够在多种组织和细胞中通过抗炎、抗凋亡等途径发挥保护作用[3]。Wnt/β-catenin通路是细胞内发挥促增殖、抗凋亡作用的信号通路,研究证实激活该通路能够减轻大脑的缺血缺氧损伤及缺血再灌注损伤[4]。为了明确1,25-(OH)2-D3在脑梗死过程中的神经保护作用及分子机制,本研究具体分析了1,25-(OH)2-D3对脑梗死大鼠神经功能、脑组织内细胞凋亡及Wnt/β-catenin通路的调节作用。
1 材料与方法
1.1 实验动物及材料
SPF级别的成年雄性SD大鼠,体质量240~280g,购自广东省实验动物中心,合格证号SCXK(豫)2019-0035。1,25-(OH)2-D3购自Sigma公司,TUNEL染色试剂盒购自上海碧云天公司,Bcl-2、Bax、β-catenin的单克隆抗体购自Abcam公司。
1.2 方法
1.2.1 动物分组及给药方法 SD大鼠随机分为假手术组、脑梗死组、干预组,脑梗死组、干预组采用线栓法建立脑梗死大鼠模型:腹腔注射10%水合氯醛麻醉后摆放仰卧位,做颈正中切口后分离左侧颈总动脉、颈内动脉、颈外动脉,用缝线结扎颈外动脉并离断,用动脉夹暂时夹闭颈总动脉,在颈外动脉末端处剪一小口,将线栓伸入至大脑中动脉,深度约1.8~2.0 cm,遇到阻力后停止并固定线栓,缝合切口完成造模。假手术组仅进行腹腔麻醉及分离左侧颈总动脉、颈内动脉、颈外动脉的操作。干预组在造模前8天每天给予1.0 μg/kg的1,25-(OH)2-D3腹腔注射,同时在造模后即刻给予 1.0 μg/kg的1,25-(OH)2-D3腹腔注射。
1.2.2 神经功能评估 建模成功后24小时,按照5分法评估各组大鼠神经功能:无神经损害症状为0分,对侧前爪不能完全伸展为1分,行走时向对侧旋转为2分,行走时向对侧倾倒为3分,不能自发行走或意识丧失为4分。
1.2.3 脑梗死体积测定 完成神经功能评估后,各组随机取6只大鼠用于脑梗死体积的测定,解剖脑组织后在脑磨具中切为厚度2 mm的脑片,用2%四唑红(TTC)溶液染色30分钟后拍照记录,红色染色部分为正常脑组织、白色染色部分为脑梗死组织,以脑梗死组织体积/(脑梗死组织体积+正常脑组织体积)的比值作为脑梗死体积。
1.2.4 TUNEL染色 完成神经功能评估后,各组随机取6只大鼠,处死后解剖得到梗死部位的脑组织,一半用于多聚甲醛固定后制作切片,用TUNEL试剂盒进行染色后在显微镜下观察,随机计数5个高倍视野下TUNEL阳性染色细胞所占比例。
1.2.5 基因表达的Western blot测定 取用于TUNEL染色后剩余的另一半脑组织,加入蛋白裂解液提取总蛋白后进行蛋白质印迹法(Western blot)。在SDS-聚丙烯酰胺凝胶的点样槽内加入蛋白样本,垂直电泳后进行转膜,将蛋白样本从聚丙烯酰胺凝胶转移至硝酸纤维素(NC)膜,NC膜放置在5%脱脂牛奶封闭2小时,而后在4℃孵育1:1 000稀释的Bax、Bcl-2、Caspase-3、β-catenin、GSK-3β及β-actin的抗体过夜,第二天取出用TBST缓冲液洗涤三遍后孵育第二抗体1小时,再用TBST缓冲液洗涤三遍后加入显影液,在显影系统内显影得到蛋白条带,用Image-J软件扫描蛋白条带灰度值,计算 Bax/β-actin、Bcl-2/β-actin、Caspase-3/β-actin、β-catenin/β-actin、GSK-3β/β-actin 的比值作为 Bax、Bcl-2、Caspase-3、β-catenin、GSK-3β 的表达水平。
1.3 统计学方法
采用SPSS 21.0软件分析数据,计量资料以“±s”表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能评分及脑梗死体积比较
脑梗死组大鼠的神经功能评分明显高于假手术组及干预组,差异均有统计学意义(P<0.05);干预组大鼠的脑梗死体积明显低于脑梗死组,差异有统计学意义(P<0.05)。
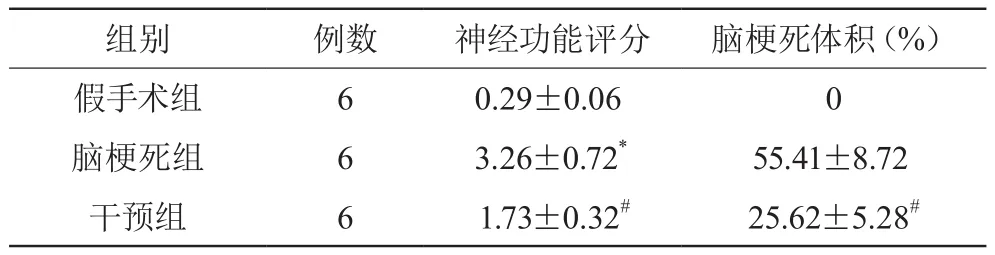
表1 各组间脑组织中β-catenin、GSK-3β表达量的比较
2.2 各组脑组织TUNEL阳性率比较
TUNEL染色检测脑组织中的细胞凋亡,染色图如图1所示。计数各组大鼠脑组织中TUNEL阳性染色细胞所占比例,脑梗死组大鼠脑组织的TUNEL阳性率明显高于假手术组及干预组,差异均有统计学意义(P<0.05)。见表2。

图1 各组大鼠脑组织的TUNEL染色图

表2 各组脑组织中TUNEL阳性率比较
2.3 各组脑组织中凋亡基因表达比较
Western blot检测脑组织中凋亡基因Bax、Bcl-2、Caspase-3的蛋白表达,蛋白电泳图如图2所示。计算各组大鼠脑组织中凋亡基因的表达量,脑梗死组大鼠脑组织中Bax及Caspase-3的表达量均明显高于假手术组及干预组,Bcl-2的表达量明显低于假手术组及干预组,差异均有统计学意义(P<0.05)。见表3
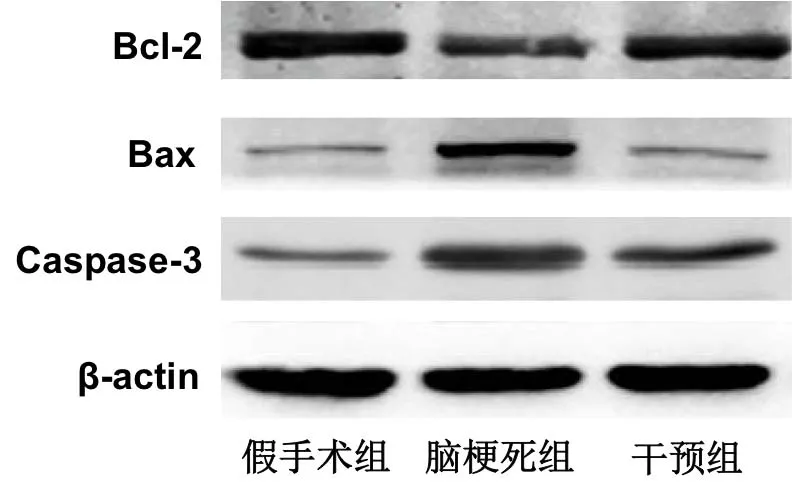
图2 各组大鼠脑组织中Bax、Bcl-2、Caspase-3的蛋白电泳图

表3 各组脑组织中Bax、Bcl-2、Caspase-3表达量的比较
2.4 各组间脑组织中β-catenin、GSK-3β表达的比较
Western blot检测脑组织中凋亡基因β-catenin、GSK-3β的蛋白表达,蛋白电泳图如图3所示。计算各组大鼠脑组织中凋亡基因的表达量,如表4所示,脑梗死组大鼠脑组织中β-catenin的表达量均明显低于假手术组、GSK-3β的表达量明显高于假手术组,干预组大鼠脑组织中β-catenin的表达量均明显高于脑梗死组、GSK-3β的表达量明显低于脑梗死组,差异均有统计学意义(P<0.05)。
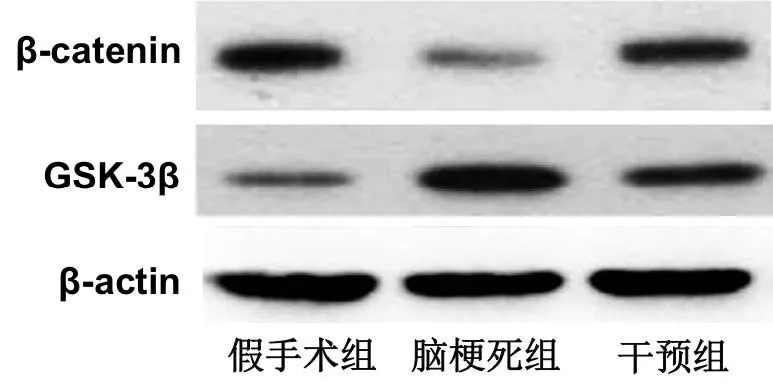
图3 各组大鼠脑组织中β-catenin、GSK-3β的蛋白电泳图

表4 各组脑组织中β-catenin、GSK-3β表达量比较
3 讨论
脑梗死是具有较高致残率和致死率的脑血管疾病[5]。近年来随着糖尿病、高血压等代谢性疾病发生的增多,脑梗死的发病率也呈逐年升高趋势,针对脑梗死的治疗也取得了长足进步,静脉溶栓及介入取栓等治疗手段能够使缺血脑组织及时获得血流再灌注[6]。尽管如此,脑组织中神经细胞对缺血缺氧的耐受能力较差,在接受再灌注治疗时已经发生了不可逆损害,治疗后遗留神经功能缺失[7]。此外,再灌注治疗对时间窗的要求严格,大多数错过再灌注治疗时间窗的脑梗死患者会遗留更为严重的神经功能缺损[8]。因此,如何在脑梗死发生后有效的保护神经功能是临床研究的热点。
1,25-(OH)2-D3是维生素D的活性形式,由维生素D经过连续两次羟基化反应生成,具有调节钙磷代谢、增加血浆中钙磷水平以满足骨代谢需求的作用[9]。近年来相关的研究发现1,25-(OH)2-D3具有除调节钙磷代谢外的其他多种生物学活性,其中由1,25-(OH)2-D3介导的细胞保护作用受到越来越多的关注。心肌、肝脏、牙龈等多个组织的基础研究发现,1,25-(OH)2-D3能够通过抗凋亡、抗炎、抗氧化等机制来减轻不同病理因素引起的组织和细胞损伤[10]。为了明确1,25-(OH)2-D3在脑梗死中的治疗价值,本研究首先通过线栓法建立了脑梗死大鼠模型,通过观察神经功能评分及脑梗死面积发现:脑梗死组大鼠的神经功能评分明显升高、梗死脑体积达到(55.41±8.72)%。在成功建立脑梗死大鼠模型的基础上给予1,25-(OH)2-D3干预并观察到:干预组大鼠的神经功能评分及脑梗死体积均明显低于脑梗死组,提示1,25-(OH)2-D3能够在脑梗死大鼠模型中发挥神经保护作用。
线粒体途径细胞凋亡的激活是脑梗死过程中介导神经功能损害的重要病理环节[11]。Bax和Bcl-2是线粒体膜上调控线粒体途径凋亡的分子,前者能够形成细胞色素C的孔道,促进线粒体内的细胞色素C进入胞浆并激活Caspase介导的级联放大反应,最终通过激活Caspase-3来引起细胞凋亡;后者能够与Bax形成异源二聚体并阻碍细胞色素C的释放,最终通过拮抗Caspase的级联激活来抑制细胞凋亡[12]。本研究对脑梗死大鼠脑组织中线粒体途径凋亡基因表达的分析显示:脑梗死组大鼠脑组织中Bcl-2的表达量明显降低,而Bax、Caspase-3的表达量明显增多,提示脑梗死模型大鼠的脑组织中线粒体凋亡明显增强。进一步分析1,25-(OH)2-D3干预对脑梗死大鼠脑组织中线粒体凋亡的影响可知:干预组大鼠脑组织中Bcl-2的表达量明显高于脑梗死组,Bax、Caspase-3的表达量明显低于脑梗死组,提示1,25-(OH)2-D3干预能够抑制脑梗死大鼠脑组织中的细胞凋亡。
Wnt/β-catenin通路是细胞中调节细胞增殖、凋亡的重要信号通路[13]。Wnt是该通路的上游信号分子,发生活化后能够使细胞内β-catenin、GSK-3β、APC、Axin形成的复合体发生解离,GSK-3β对β-catenin的水解作用减弱,进而造成β-catenin在细胞浆中不断堆积并逐步向细胞核转移;进入细胞核的β-catenin能够通过Tcf/Lef来调节Bax、Bcl-2等基因的表达。本研究对Wnt/β-catenin通路的分析显示,脑梗死组大鼠脑组织中β-catenin的表达量均明显降低、GSK-3β的表达量明显升高,而在使用1,25-(OH)2-D3干预后的干预组大鼠脑组织中β-catenin的表达量均明显升高、GSK-3β的表达量明显降低,提示Wnt/β-catenin通路在脑梗死过程中受到抑制,1,25-(OH)2-D3干预能够激活脑梗死组织中的Wnt/β-catenin通路,进而通过该通路介导的促增殖及抗凋亡效应来实现保护脑梗死大鼠神经功能的目的。
综上所述,1,25-(OH)2-D3用于脑梗死大鼠能够改善神经功能、减轻脑组织内细胞凋亡,激活Wnt/β-catenin通路是其可能分子机制,为临床上探寻脑梗死新的治疗药物提供了依据。

