镁条燃烧制备氮化镁的简易方法研究
王彦军 施彩娟


摘要:介绍了用镁条与空气中的氮气反应制备氯化镁的实验方法,装置简单,操作便捷,现象明显,实验可在2min内完成,十分适合于课堂演示。并通过热力学分析,对实验产物中“氮化镁”表层出现的“外白内黄”现象进行理论分析和实验证实。
关键词:氮化镁;镁条:空气;实验改进
文章编号:1008-0546(2019)05-0089-03
中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.05.028
一、问题的提出
苏教版《化学1》“镁的提取和应用”Ⅲ介绍了镁能与空气中的氧气、氮气、二氧化碳反应,然而课堂演示实验“镁条在空气中燃烧”,常规操作往往只能看到比较熟悉的白色固体氧化镁,学生对黄色固体氮化镁却很陌生。但教材中并没有镁与氮气反应的演示实验,因此学生缺少必要的感性认识,不利于学生对该知识的理解。如果通过系列实验制备纯净氮气与镁粉反应,固然能够得到氮化镁,然而,这样的实验流程繁琐且费时,显然不适合课堂演示。
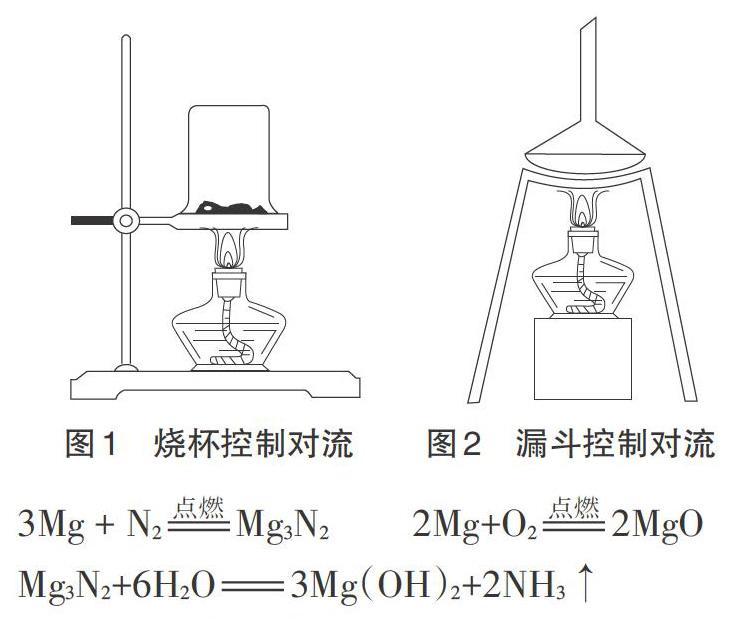
代冬梅、丁伟利用图1装置控制空气对流,《高中化学实验创新与研究》中利用图2装置控制对流,其原理均是利用过量镁粉在不对流的空气中燃烧(镁条引燃),耗尽氧气后制得氮化镁。笔者按照上述方法反复试验,发现虽然能够成功制得氮化镁,但是黄色固体量很少,而且镁条引燃过程中会有大量镁粉喷散且燃烧不充分,并有镁粉混杂在产物中,效果不是最理想。
笔者经多次尝试,设计了一种较为理想的实验方法,简单快捷,现象明显。
二、实验原理
在空气中,镁主要是与活泼的氧气反应,而与氮气反应的程度很弱;如若控制空气不对流,消耗掉了空气中的氧气后,则过量的镁与氮气的反应将占到主要作用。涉及的化学反应如下:
三、实验仪器与药品
蒸发皿、200mL烧杯、坩埚钳、镁条、酒精灯、酚酞试液、红色石蕊试纸、试管、石棉网。
四、实验改进
1.实验步骤
(1)取6cm长镁条(过量),打磨光亮,折成z形,使3片等长镁条紧贴。
(2)取蒸发皿置于石棉网上,准备好200mL烧杯,烧杯口刚好能扣住蒸发皿内壁最佳(防止空气对流)。
(3)用坩埚钳夹持镁条,引燃后立即移到蒸发皿上方,用烧杯罩住蒸发皿,使镁条与外界空气近乎隔离,待镁条快燃尽时松手移出坩埚钳,如图3。
(4)静置、冷却后取下烧杯,用镊子或剪刀拨开片状镁条灰烬,观察现象,如图4。
(5)将燃烧生成物取少量置于试管中,加入适量水,向试管内滴加酚酞试液,观察现象,再将润湿的红色石蕊试纸置于试管口,观察试纸是否变色,如图5。
2.实验成功的关键点
(1)镁条过量且多片折叠,过量镁条一方面消耗掉氧气,同时产生高温,为氮气和镁条反应提供能量。
(2)选择合适大小的烧杯罩住蒸发皿,阻隔空气交换。
五、实验结果分析与解释
1.实验现象及产物成分分析
通过多次实验发现,过量镁条在“密闭”空间内燃烧过程中,发出耀眼的白光,产生大量白烟(烧杯罩牢,不会外泄),烧杯内壁附着一薄层白色固体,蒸发皿内固体产物呈片状褶皱,几乎保持三片镁条紧靠原型,其中最外侧表层呈白色(如图6),内侧及夹层处有大量黄色氮化镁固体生成(如图7)。
(1)燃烧产物中Mg3N2的实验验证
取一片燃烧产物(黄色固体)于试管中,加适量蒸馏水,立即听到嘶嘶的响声,可见氮化镁剧烈水解,在试管口处用湿润的红色石蕊试纸检验,试纸变蓝,再向试管内滴加酚酞,溶液明显变红,且试管底部有白色固体沉积,正是氮化镁的水解生成的氢氧化镁和原燃烧产物中的氧化镁(如图8)。
(2)烧杯内壁上白色固体的成分分析
用药匙刮取烧杯内壁上白色固体少许于试管中,重复上述操作,发现滴加酚酞后溶液略显粉红,在试管底部有固体沉积,而试管口处的湿润的红色石蕊试纸未变蓝色,由此我们猜测烧杯内壁附着的白色固体成分为MgO和少量Mg3N2,因为Mg3N2量很少,所以水解产生的Mg(OH)2和NH3的量也很少,这似乎可以完美的解释上述实验现象。但事实真的是这样吗?上述反应是在近乎密闭的空气中发生的,也就是说与镁条反应的氮气肯定多于氧气,那么猜测Mg3N2量很少显然是不合理的。
事实上,附着在烧杯内壁上白色固体是由镁条燃烧产生的“白烟”沉积而成,而“烟”的形成又主要与金属单质的沸点、纯度和“烟”的相对密度、熔点等因素有关。查阅文献数据可知金属镁的沸点为1170°C,镁条在相对封闭的空气中燃烧时固体表面原子会剧烈气化,因此很容易被氧化成相对分子量较小的MgO和Mg3N2,从而形成漂浮在空气中的“白烟”。又因为“白烟”中Mg3N2极易水解,所以实验时空气中H2O量是必须要考虑的因素。至此我们可以得出近乎合理结论:烧杯内壁附着的白色固体在相对湿度较大的环境中主要是Mg(OH)2和MgO;而在相对干燥的环境中主要是Mg3N2和MgO。笔者查阅气象资料显示,实验当天浙江海盐地区空气的相对湿度在65%(中午)~83%(傍晚),综合上述分析便可对实验现象做出完美的解释。
需要指明的是,在不对流的空气中CO2的含量极低,受实验条件所限,本实验中并未观察到产物中含单质碳的直接证据。
2.产物外侧表层“白色固体”成因分析
按照上述步骤反复实验,所得产物始终会出现“外白内黄”现象,尝试用3根等长镁条,分别以单片、双片(对折)、三片(z形)同样操作完成实验,单片镁条燃烧产物表面几乎呈白色,只有少许氮化镁外漏,而多片镁条燃烧产物“外白内黄”,有大量黄色固体存在。分析可能原因為:
(1)反应过程中产生“白烟”冷凝后覆盖在产物表面所致。
分析上述数据,很容易发现氮化镁燃烧为低温自发反应,即氮化镁在高温有氧环境中会自动转化为氧化镁,而要由氧化镁和氮气再逆向转化生成氮化镁,条件要求则很高,反转温度需要达到10917K,也就是说该反应可逆性很差,氮化镁不小心就会被氧气氧化,而氮化镁一旦被氧化,则不会再逆向转化得到氮化镁。
综上分析,产物外侧表层“白色固体”成因,被“白烟”覆盖的可能性较小,因内层都是黄色固体,而过程中白烟是持续产生的,这与表层白色“很薄”似乎说不通。气象资料显示,实验当时浙江海盐空气湿度为70%,结合理论研究和实验现象分析为“白色固体”成因(2)、(3)可能性更大。由于实验条件所限,尚未做热重法等精确分析。
六、实验改进的意义
实验改进的优点:仪器简单、操作便捷、现象明显,十分适合课堂演示或学生实验,建议在教材中增加氮化镁制备的演示实验。
我们一直强调核心素养导向的课堂教学,实验无疑是化学课堂上核心素养落地的有效载体。本实验通过烧杯来阻隔空气交换,间接改变镁条燃烧的实验环境,实现了氮化镁制备实验与性质实验的直观性、对比性、探究性和简约性。潜移默化中培养学生的变化观念和问题意识,引导学生开展实验创新和基于数据演绎的证据推理,让学生在思考与实践中实现素养达成。

