TMEDA的甲基C-H键活化研究
华宇鹏,王浩宇,袁鸿,郭志强,魏学红*
(1.鄂尔多斯应用技术学院,内蒙古 鄂尔多斯 017000;2.山西大学 化学化工学院,山西 太原 030006;3.山西大学 大型科学仪器研究中心,山西 太原 030006)
0 引言
C—H键是有机化合物中最常见的一种共价键,主要包括C(sp)—H、C(sp2)—H与C(sp3)—H三种类型,且稳定性(键能)依次增大。C—H键活化是通过断裂未活化的C—H键并生成新的共价键,如C—C键、C—N、C—O、C—M(M:金属)等。C—H键活化是有机合成领域中重要的合成方法,具有反应效率高、原子经济性高、产生废物少等优点,能够直接高效合成一些常规方法难以合成的化合物。C—H键活化受到化学工作者的广泛关注,研究主要集中在活化的区域选择性、催化系统及其机理研究等方面[1-4]。
C—H键活化通常需要金属催化剂来催化,包括贵金属催化剂、过渡金属以及碱金属催化剂[5-9]等。正丁基锂作为烷基化试剂已经商业化,但对于一些稳定的C—H键还是很难实现活化。N,N,N′,N′-四甲基乙二胺(TMEDA)通常作为金属络合助溶剂被用于金属化反应,其甲基上的C—H键不被正丁基锂活化,而以稳定的[(n-BuLi)2(TMEDA)2]二聚体结构存在。目前,仅有几篇文献曾报道TMEDA被部分活化并参与化学反应,例如:Frank曾报道用叔丁基锂能够部分锂化TMEDA的甲基,正丁基锂和叔丁醇钠的混合物可以锂化TMEDA的亚甲基[10-11]。Mulvey课题组报道LiTMP(TMP=2,2,6,6-四甲基哌啶)和三叔丁基铝的混合物可以使TMEDA的甲基去质子化[12-13]。因此,由于TMEDA化学性质的稳定性,正丁基锂活化TMEDA甲基C—H键的文献仍未见报道。TMEDA在化学反应中多数是作为溶剂或金属的配位试剂,很少被用于有机合成的反应物。
本文提供了一种用正丁基锂在温和的条件下对TMEDA的甲基选择性活化的方法,并进一步合成一类新型的含氮氧三齿化合物。该类含氮氧三齿化合物制备方法简单,反应条件温和,成本较低,其制备方法可作为一种新的合成思路应用于有机合成化学。
1 实验部分
1.1 实验试剂与仪器
实验中用到的羰基化合物、TMEDA与其他胺类化合物经过相应的纯化后在氮气中保存待用(购买于阿拉丁试剂公司)。n-BuLi(2.5 mol·L-1,正己烷溶液)(Alfa Aesar试剂公司,分析纯);Bruker AVANCE Ⅲ HD 600超导核磁共振仪,Bruker D8 Venture X单晶衍射仪,Thermo Scientific Q Exactive型液相色谱串联质谱仪。
1.2 TMEDA的甲基C—H键选择性活化
通过对实验过程的监测我们偶然发现,正丁基锂可以活化TMEDA甲基的C—H键,并与环己酮加成得到一个N,N,O-化合物。经文献检索[10-18],我们认为体系中应该存在可以活化TMEDA甲基C—H键的试剂,反应如式1所示。

Scheme 1 Synthetic route ofn-BuLi activated TMEDA式1 n-BuLi活化TMEDA的合成路线
1.3 N,N,O-化合物的合成设计
基于以上背景,我们模拟上述实验过程,设计用正丁基锂对TMEDA的甲基C—H键选择性活化去氢,并与羰基类化合物加成,经过多步反应合成稳定的N,N,O-化合物,如式2所示。
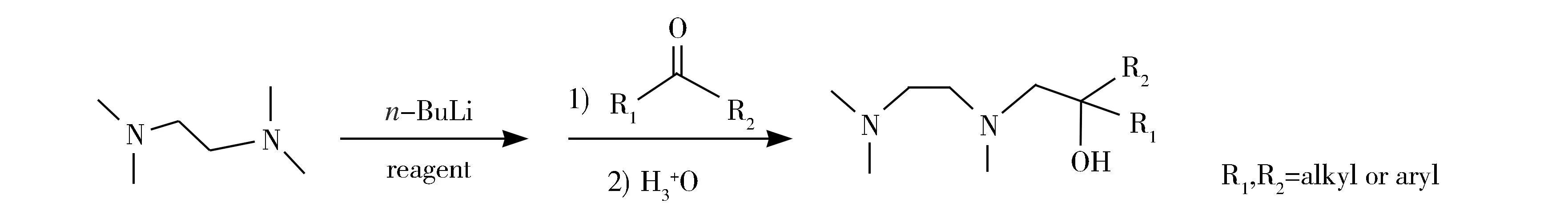
Scheme 2 Synthesis design of N,N,O-compounds式2 N,N,O-化合物的合成设计
2 结果与讨论
在研究TMEDA活化反应的过程中,首先用正丁基锂直接对TMEDA的甲基去氢,与环己酮发生加成反应,跟踪监测反应过程和最终产物,反应中没有N,N,O-化合物生成(表1,Entry 1)。然后在上述反应体系中加入MgBr2或MeMgBr时同样没有得到预期的结果(表1,Entries 2、3)。当N,N-二甲基邻甲苯胺参与反应时,分离得到产率为18%(按TMEDA的量计算)的N,N,O-化合物(表1,Entry 4)。该实验过程证明N,N-二甲基邻甲苯胺能使反应中TMEDA甲基上的氢原子被活化。随后换用其他类型的胺类化合物进行活化研究,当加入N,N-二甲基苯胺时,分离后可达42%的产率(表1,Entry 8),而其他的胺类化合物都没有预期产物生成(表1,Entries 6-8)。然后选用与N,N-二甲基苯胺结构类似的芳香族甲基苯基醚参与反应,检测到有痕量产物生成,而且选择性很低(表1,Entry 9)。然后,考察了溶剂、反应时间、n-BuLi及N,N-二甲基苯胺用量对反应产率的影响(表1,Entries 10-15),筛选出的最优反应条件为:N,N-二甲基苯胺用量为1.1当量,正丁基锂用量为1.2当量,乙醚,活化反应回流1 h(表1,Entry 12)。结果表明,N,N-二甲基苯胺可以使得正丁基锂在温和的条件下对TMEDA的甲基C—H键实现活化,并进一步合成得到分离产率为84%的N,N,O-化合物。

表1 n-BuLi活化TMEDA合成N,N,O-化合物
在上述优化条件下,选用不同的羰基化合物与活化后的TMEDA进行加成反应,合成不同结构的N,N,O-化合物,如式3所示。结果表明,我们成功的合成了3个N,N,O-化合物,分离产率为74%~84%,并用1H、13C NMR、元素分析等手段对其结构表征。

Scheme 3 Synthesis of N,N,O-compounds式3 N,N,O-化合物的合成
2.1 化合物2-1-2-3的合成与表征
HOC(CH2)5CH2N(Me)CH2CH2NMe2(2-1)在氮气保护下往盛有80 mL无水乙醚溶剂的250 mL的Schlenk瓶中依次加入TMEDA (11.02 g,73 mmol)与N,N-二甲基苯胺(10.13 mL),搅拌均匀。控制温度在0℃时缓慢滴入35.04 mL的正丁基锂(2.5 mol,正己烷),微沸回流1 h,冷却到0℃,缓慢滴入7.54 mL环己酮(73 mmol),继续回流2 h。继续将反应液冷却在0℃,用蒸馏水(50 mL)水解,分别用50 mL质量分数5%的盐酸洗涤5次。合并无机相,用质量分数10%的NaOH调至弱碱性,用20 mL的CH2Cl2萃取3次,合并有机相,干燥,旋蒸后得浅黄色油状物,减压蒸馏收集78℃~81℃馏分得的无色液体2-1(产率为84%)。13C NMR (CDCl3,δ/ppm):22.37(C6H10),26.17(C6H10),36.46(C6H10),45.06(NC2H6),46.97(NCH3),57.38(NC2H4N),57.69(NC2H4N),66.58(C6H10CH2),70.52(C6H10COH).1H NMR (CDCl3,δ/ppm):1.26-1.33(m,3H,C6H10),1.43-1.44(m,2H,C6H10),1.54-1.55(m,3H,C6H10),1.64-1.69(m,2H,C6H10),2.25(s,6H,NC2H6),2.36(s,4H,NC2H4N),2.40(s,3H,NCH3),2.55-2.57(t,2H,C6H10CH2),5.25 (br,1H,C6H10OH). Anal. Calcd for C12H26N2O: N,13.07;H,12.23;C,67.24.Found:N,13.01;H,11.28;C,67.18.MS (m/z):HRMS (ESI): calcd for C12H26N2O ([M+H]+):215.2123,found:215.2119.
HOC(CH3)(Ph)CH2N(Me)CH2CH2NMe2(2-2)合成方法参照化合物2-1,将苯乙酮缓慢滴加到锂化后的反应液中参与反应,经反应后减压蒸馏收集103℃~106℃馏分,得产率为76%浅黄色油状产品2-2。13C NMR (CDCl3,δ/ppm):28.21(C6H5CCH3),44.80(NC2H6),45.97(CCH2NCH3),56.37(NC2H4N),57.29(NC2H4N),68.40(CCH2),73.07(C6H5COH),125.34(C5H10),125.98(C5H10),127.78(C5H10),148.44(C5H10).1H NMR(CDCl3,δ/ppm):1.48(s,3H,CCH3),2.07(s,3H,CCH2NCH3),2.33 (s,6H,NC2H6),2.33-2.37(m,2H,NC2H4N),2.47-2.49(s,2H,NC2H4N),2.66-2.72(m,2H,C6H5CCH2),7.21-7.22(m,H,C6H5),7.31-7.34(m,2H,C6H5),7.48-7.49(m,2H,C6H5).Anal. Calcd for C14H24N2O: N, 11.85; H, 10.24; C, 71.14. Found: N, 11.92;H, 10.29; C, 71.06.
HOC(CH2)4CH2N(Me)CH2CH2NMe2(2-3)合成方法参照化合物2-1,将环戊酮缓慢滴加到锂化后的反应液中,反应后经减压蒸馏收集64℃~67℃浅黄色馏分2-3,产率为74%。13C NMR (CDCl3,δ/ppm):24.37(C5H8),38.96(C5H8),45.03(NC2H6),46.93(NCH3),57.35(NC2H4N),57.65(NC2H4N),74.14(C5H8CH2),80.32(C5H8COH).1H NMR(CDCl3,δ/ppm):1.46-1.49(m,2H,C5H8),1.62-1.65(m,2H,C5H8),1.72-1.75(m,4H,C5H8),2.12(s,6H,NC2H6),2.18(s,4H,NC2H4N),2.27(s,3H,NCH3),2.43(t,2H,C5H8CH2),5.09(br,1H,C5H8OH). Anal. Calcd for C11H24N2O: N, 13.98; H, 12.08; C, 65.95. Found: N, 14.11; H, 12.17; C, 65.90.
2.2 化合物2-4的结构表征
为了进一步确定化合物2-1的分子结构组成,使其与HBr水溶液反应转化为季铵盐。在冰水浴中,将1.0 g质量分数为48%的HBr水溶液滴入到2-1(1.31 g)的10 mL Et2O溶液中,均匀搅拌,生成的白色固体被过滤后用THF重结晶,分离得到1.45 g无色晶状化合物[{HOC(CH2)5CH2N(Me)CH2CH2NMe2}HBr](2-4), 产率为84%。对其培养单晶结构,经Bruker D8 Venture X单晶衍射仪检测,结构如图1所示。从2-4的晶体结构可以证实,TMEDA分子的甲基C—H键被n-BuLi锂化,随后与环己酮发生了加成反应;新的C1—C7共价键已经生成,C(1)-C(7)-N(1)键角为114.2(6)°,键长为1.532(10)Å,环己酮的六元碳环结构保持椅式构型。部分键角与键长值参见表2。
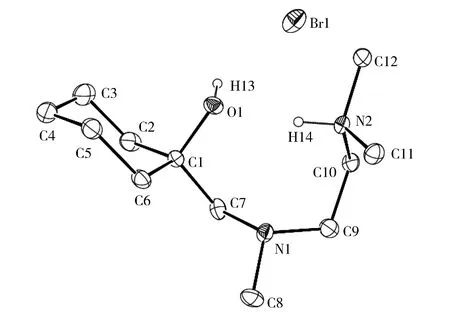
Fig.1 Molecular structure of 2-4图1 化合物2-4的晶体结构

N(1)—C(7)1.473(9)N(1)—C(8)1.488(9) N(1)—C(9)1.488(9)C(1)—O(1)1.446(8) N(2)—H(14)0.93(6)C(1)—C(7)1.532(10) O(1)—H(13)0.8400 C(1)—O(1)—H(13)109.5O(1)—C(1)—C(6)105.5(5) C(1)—C(7)—N(1)114.2(6)C(7)—N(1)—C(9)110.2(6) O(1)—C(1)—C(7)108.6(5)C(7)—N(1)—C(8)112.9(5) C(10)—N(2)—C(11)113.1(6)C(11)—N(2)—C(12)111.4(6) C(10)—N(2)—H(14)107(4)C(10)—N(2)—C(12)111.3(5) C(12)—N(2)—H(14)104(4)C(11)—N(2)—H(14)109(4)
3 结论
本文报道了一种新的活化C—H的方法,即N,N-二甲基苯胺存在时,在温和的条件下n-BuLi对TMEDA的甲基C—H键实现高选择性活化。活化后的TMEDA进一步与羰基化合物加成合成新的N,N,O-化合物。通过优化实验对反应条件进行筛选,实验表明,N,N-二甲基苯胺用量为1.1当量,n-BuLi用量为1.2当量,乙醚,活化反应回流1 h,得到3个新的N,N,O-化合物2-1-2-3和一个晶体结构化合物2-4。通过核磁、元素分析和X-ray单晶衍射技术对2-1-2-4的结构进行了表征。总之,TMEDA的甲基C—H活化具有反应效率高、原子经济性高、产生废物少等优点,为碳碳键和碳杂键的构建提供了新的合成策略,同时为TMEDA作为反应原料参与有机合成化学反应提供可能。

