VEGF和Bcl-2双基因修饰的MSC对缺氧心肌细胞凋亡的影响
倪晓彬, 蔡志雄, 李和慨, 易敏
1汕头市中心医院心血管内科(广东汕头 515031); 2南方医科大学珠江医院心脏中心(广东广州 510280)
心肌梗死是导致人类死亡的主要疾病之一[1]。骨髓间充质干细胞(MSC)移植治疗心肌梗死很有发展及应用前景,但临床试验的结果显示这种细胞移植的方法对心肌梗死的治疗效果不太理想,其主要原因之一是移植到梗死局部区域的MSC存活及滞留率低[2-4]。要使MSC移植发挥对心肌梗死更好的治疗作用必须改善MSC在梗死局部区域的存活及滞留率。Bcl-2是调控细胞存活和凋亡的重要基因[5-6]。VEGF是重要的促血管生成细胞因子,VEGF对增强心肌梗死后心脏局部血管新生和改善心功能的作用已得到证实[7]。在之前的研究中我们成功构建了VEGF和Bcl-2双基因修饰的MSC,体外实验结果证实其在糖氧剥夺环境下能更强旁分泌多种细胞因子[8]。2016年10月至2017年3月,我们将VEGF和Bcl-2双基因修饰的MSC与新生SD大鼠心肌细胞共培养并缺氧处理24 h,研究其是否能减少缺氧心肌细胞的凋亡。
1 材料与方法
1.1 材料 SD大鼠MSC购自中国Cyagen公司;VEGF和Bcl-2双基因修饰的MSC(MSC+BV)为本实验室之前所构建并保存[8];出生1~3 d的新生SD大鼠购自南方医科大学实验动物中心。
1.2 主要试剂与仪器
1.2.1 主要试剂 胎牛血清、胰蛋白酶、PBS(Invitrogen),DMEM、青霉素-链霉素(Gibco),DAPI染色液(Sigma),TUNEL染色试剂盒(Roche)、Annexin V-FITC/PI试剂盒(eBioscience)。
1.2.2 主要仪器 超净工作台、二氧化碳培养箱、三气培养箱(Thermo),荧光显微镜(NIKON),高压消毒灭菌锅(Astell),倒置相差显微镜(Leika),BD Accuri C6流式细胞仪(BD),Transwell嵌套培养六孔板(Coring,货号:CNG3412)。
1.3 新生SD大鼠心肌细胞分离与培养 使用出生1~3 d的新生SD大鼠,在胸骨左缘用小剪刀剪开皮肤和肋骨后用镊子将心脏整体离断夹出并放到D-Hanks 液皿中清洗,离体心脏清洗后置于加入 0.25% EDTA 胰酶的培养瓶中,4℃消化过夜,加入DMEM培养液放置至37℃水浴箱5 min以中止胰酶消化,弃上清液后加胶原酶消化液(D-Hanks液50 mL+牛血清白蛋白500 mg +Ⅱ型胶原酶40 mg),放置至37℃水浴箱1 min后弃上清液,将消化后的心脏组织移至有磁珠的培养瓶,加入胶原酶消化液在37℃搅拌20 min后将液体移到15 mL离心管,800 r/min离心3 min,弃上清,用含血清的DMEM反复吹打混匀,移至细胞培养皿,在37℃细胞培养箱中培养90 min。取出培养皿,在超净工作台内将细胞悬液吸出,混匀后移入新的皿中,再次放于箱中培养,每天换液,第7天可处理细胞。
1.4 心肌细胞与MSC的缺氧共培养 使用Transwell嵌套共培养系统, 0.4 μm的嵌套膜孔径使得细胞不能通过,仅允许培养液中营养物质及细胞因子进行交换,其示意图见图1。
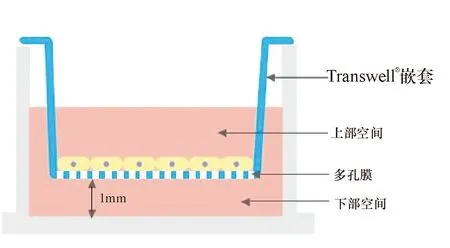
图1 Transwell嵌套共培养系统示意图
将冻存的MSC及MSC+BV细胞复苏,接种至T25培养瓶放至培养箱培养。第2天在其生长至80%融合时消化并将其按1×105的数量接种至Transwell嵌套多孔膜上。将心肌细胞以1×105的数量接种至六孔Transwell共培养板上,正常培养48 h。将接种有MSC或MSC+BV的Transwell嵌套置于接种有心肌细胞的六孔培养板上面,加入含10%FBS的DMEM,置于培养箱正常培养24 h后更换无血清的DMEM并置于三气培养箱中(94%N2、5%CO2、1%O2)培养24 h。实验分组:正常培养组、缺氧培养组、与MSC共培养缺氧组、与MSC+BV共培养缺氧组。
1.5 TUNEL染色检测缺氧状态下与MSC共培养的心肌细胞凋亡 在Transwell六孔板置入无菌细胞爬片后按1.4描述的方法进行心肌细胞与MSC或MSC+BV的缺氧共培养,按试剂盒说明书进行TUNEL染色操作。
1.6 Annexin V-FITC/PI流式细胞术检测缺氧状态下与MSC共培养的心肌细胞凋亡 按1.4描述的方法进行细胞共培养及缺氧处理后将心肌细胞按试剂盒说明书操作立即行Annexin V-FITC/PI流式细胞术检测凋亡。
1.7 统计学方法 采用SPSS 20.0统计软件,计量资料以均数±标准差表示,两组间比较用t检验,多组比较采用ANOVE方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 新生SD大鼠心肌细胞培养后形态 最初分离的心肌细胞呈球型,置于培养箱中培养4 h后开始贴壁生长,12 h后几乎全部贴壁,细胞呈三角形或者多边形。心肌细胞一开始即有频率为40~60次/min的搏动,48 h后搏动的频率为80~100次/min,搏动趋向同步性。细胞形成单层细胞或者相互交织形成细胞簇。见图2。

图2 新生SD大鼠心肌细胞的镜下观察(光镜下×400)
2.2 TUNEL染色法 荧光显微镜下观察TUNEL染色的心肌细胞,蓝色为DAPI染色的存活的心肌细胞核,绿色为凋亡的心肌细胞核。TUNEL染色结果:正常培养组心肌细胞凋亡率为(9.1±1.6)%,缺氧培养组心肌细胞凋亡率为(36.8±1.4)%,两组差异有统计学意义(P<0.01);与MSC共培养缺氧组心肌细胞凋亡率为(28.7±1.6)%,与缺氧培养组心肌细胞凋亡率比较,两组差异有统计学意义(P<0.01);与MSC+BV共培养缺氧组心肌细胞凋亡率为(16.3±2.7)%,与与MSC共培养缺氧组比较差异有统计学意义(P<0.01)。见图3。
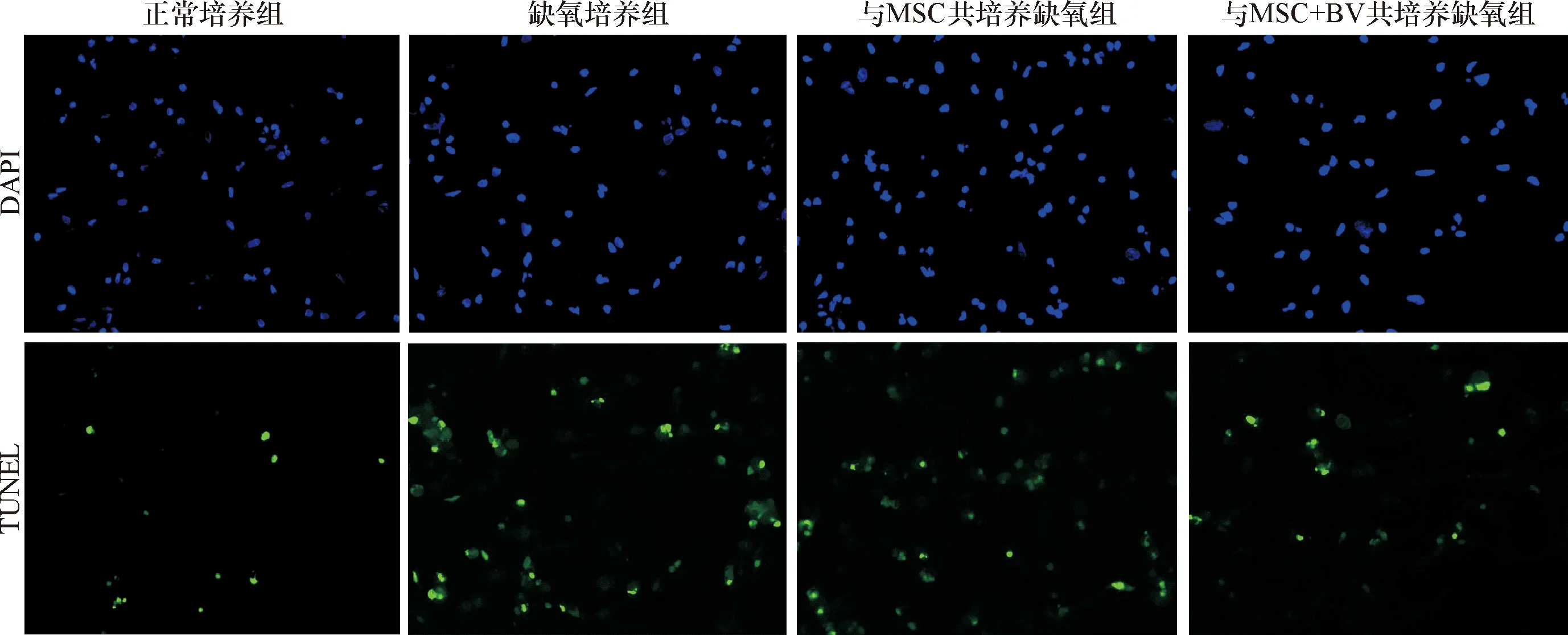
图3 荧光显微镜下TUNEL染色检测与MSC缺氧共培养的心肌细胞凋亡(TUNEL染色,×400)
2.3 Annexin V-FITC/PI流式细胞术 流式细胞术检测结果为:正常培养组心肌细胞凋亡率为(7.6±2.1)%,缺氧培养组心肌细胞凋亡率为(34.7±3.3)%,差异有统计学意义(P<0.01);与MSC共培养缺氧组心肌细胞凋亡率为(28.2±1.3)%,与缺氧培养组比较差异有统计学意义(P<0.01);与MSC+BV共培养缺氧组心肌细胞凋亡率为(14.2±1.7)%,与与MSC共培养缺氧组比较差异有统计学意义(P<0.01)。见图4。

图4 Annexin V-FITC/PI流式细胞术检测与MSC缺氧共培养的心肌细胞凋亡
3 讨论
MSC不单具有向多种细胞分化的能力,也能通过旁分泌效应分泌多种类的细胞因子。MSC分化为心肌细胞和旁分泌效应是MSC移植能治疗心肌梗死起治疗作用的主要机制[9-11]。MSC 可旁分泌多种细胞因子和蛋白质[12],主要分有以下分类[13]:(1)生长因子,比如血管内皮生长因子和成纤维细胞生长因子等;(2)干细胞特异性活性因子,如干细胞衍生因子等;(3)化学趋化因子,比如巨噬细胞集落刺激因子、胰岛素样生长因子结合蛋白和单核细胞化学诱导蛋白-1等;(4)调节肽,如脑钠素、心钠素、降钙素基因相关肽和降钙素等。在之前的研究[8]中,我们已经证实VEGF和Bcl-2双基因修饰能增强MSC在糖氧剥夺环境下旁分泌HGF、bFGF、IGF-1和VEGF这4种细胞因子。在本研究中我们分别将新生SD大鼠心肌细胞与VEGF和Bcl-2双基因修饰的MSC以及未经基因修饰的MSC用Transwell嵌套缺氧共培养的方法来研究VEGF和Bcl-2双基因修饰的MSC是否通过旁分泌效应减少缺氧心肌细胞的凋亡。TUNEL染色及Annexin V-FITC/PI流式细胞术两种凋亡检测方法的结果均表明缺氧处理增加了心肌细胞凋亡,与未经基因修饰的MSC共培养能减少缺氧心肌细胞凋亡,而与VEGF和Bcl-2双基因修饰的MSC共培养的缺氧心肌细胞凋亡则进一步减少。这说明VEGF和Bcl-2双基因修饰的MSC对比普通MSC更能减少缺氧心肌细胞凋亡。采用共培养的实验方式表明,VEGF和Bcl-2双基因修饰的MSC减少缺氧心肌细胞凋亡的作用来自于增强的MSC的旁分泌效应。
综上所述,VEGF和Bcl-2双基因修饰MSC可以通过旁分泌效应减少缺氧心肌细胞凋亡,这对基因修饰MSC策略改善细胞移植对心肌梗死治疗效果提供了新的思路。

