新视角重探小鼠胶质细胞体外培养技术与炎症模型
吴相枝,徐铭枝,张东伟,付 洁,王 伊,宋海峰
(1. 安徽医科大学,安徽 合肥 230032;2. 军事科学院军事医学研究院生命组学研究所,特殊环境组学研究室,蛋白质药物国家工程研究中心,北京 102206)
小胶质细胞是位于中枢神经系统(central nervous system,CNS)的固有免疫细胞,约占中枢神经系统总细胞数的10%~12%,在神经保护和神经损伤中起到重要作用[1-2]。一方面,它起到免疫监视和趋化作用,构成CNS特有的免疫系统[3]。另一方面,多种CNS疾病都与非正常激活状态的小胶质细胞相关,包括脑卒中、阿尔茨海默症、帕金森病等[4]。
原代与永生化的小胶质细胞是研究神经系统疾病的常用工具。从数量、均一性、获得的难易程度等考虑,永生化的小胶质细胞优于原代细胞,但永生化细胞在连续的传代培养中,可能失去某些重要的特征和功能[5-6]。因此,原代胶质细胞的生物学相关性更好,更贴近体内真实情况[7]。故原代胶质细胞的体外培养在相关疾病机制研究以及新药研发中具有不可替代的作用[7]。胶质细胞炎症反应模型是CNS药理学研究的重要体外模型,对CNS相关疾病的新药发现至关重要[7-8]。自初次获得原代小胶质细胞以来,其提纯与培养技术早已成熟固化[5]。虽然D-型多聚赖氨酸(poly-D-lysine,PDL)存在细胞毒性问题,但在胶质细胞培养中仍广泛使用[5-11]。近年来,在细胞外基质包被技术[12-13]、炎症因子定量检测技术[14]、细胞共培养与协同性研究技术等方面,都有了新的突破[15]。在新材料、新技术得到广泛应用的背景下,我们有必要重新审视固化多年的原代胶质细胞分离培养技术[11-16]。本研究将新型包被材料(Matrigel、胶原蛋白)与传统的小胶质细胞包被材料(PDL)进行比较,并利用多因子检测技术对细胞炎症反应进行全面的定量评价。分析了多种影响原代胶质细胞炎症模型的因素,从多个新的角度为未来中枢神经系统细胞炎症模型的建立提供指引,并提出了优化后的技术建议。
1 材料
1.1 试剂胎牛血清、高糖DMEM、胰酶、Hank′s缓冲液、磷酸盐缓冲液(phosphate buffer saline,PBS)、抗生素(美国Gibco公司);PDL溶液(碧云天, C0312);I型胶原蛋白 (collagen I, Solarbio公司, C8062);Matrigel (美国Coring, 356234);RNA提取试剂盒(德国QIAGEN, 74106);反转录试剂盒(美国Bio-Rad, 1708891);qPCR荧光染料 (诺维赞, Q321-03);ICC用抗Iba1抗体(日本Wako, 019-19741);抗GFAP(ab4674)抗体、鸡IgY、polyclonal-Isotype Control(ab37382)、抗Tuj1抗体(ab18207)、兔IgG、polyclonal-Isotype Control(ab171870)、抗Iba1抗体[1022-5](FITC) (ab15691)、小鼠IgG2b[PLPV219](FITC)-Isotype Control(ab91368),均购自英国Abcam公司;Alexa Fluor®488 AffiniPure羊抗兔IgG(H+L)(翊圣生物, 33106ES60);Alexa Fluor®647 AffiniPure羊抗鸡IgY(IgG)(H+L)(美国Jackson, 103605155);荧光法吞噬检测试剂盒(美国AAT-Biolite)。
1.2 仪器细胞计数仪(上海睿钰生物科技有限公司);qPCR仪(美国Bio-Rad);体视镜(北京福凯仪器有限公司);倒置显微镜 (日本Olympus);流式细胞仪(美国BD);Incucyte S3活细胞动态成像与分析系统(美国Essen BioScience)。
1.3 实验动物新生24 h内的C57BL/6J乳鼠,北京维通利华实验动物技术有限公司生产[SCXK (京)2016-0006],不区分♀♂。
2 方法
2.1 培养材料表面处理用PBS稀释PDL溶液至终浓度为0.1 g·L-1,包被24孔板和75 cm2培养瓶,室温静置15 min。使用前,PBS清洗2次。Matrigel、I型胶原蛋白包被方式按说明书使用。
2.2 细胞悬液制备及培养新生24 h内的C57BL/6J小鼠乳鼠CO2吸入处死后,取下头部置于Hank′s缓冲液中,在体视镜下去除脑膜,仅保留双侧大脑半球。去膜后的脑放入含0.1% BSA DMEM培养基中;1 500 r·min-1离心5 min;加入培养基将组织吹碎,用70 μm细胞筛过滤后,再次离心。重悬后的细胞接种至PDL包被、未包被的75 cm2培养瓶,以及PDL包被的60 mm培养皿中培养。并取出部分留样(d 0)。
2.3 混合胶质细胞的制备培养皿中细胞分别培养2、4、7 d。75 cm2培养瓶中的细胞,培养9 d和14 d,用0.05%胰酶消化8 min,收集细胞,离心获得混合胶质细胞沉淀。
2.4 小胶质细胞的制备利用美天旎CD11b磁珠分选混合胶质细胞,获得CD11b阳性的小胶质细胞。
2.5 实时荧光定量PCR检测培养9 d的混合胶质细胞及小胶质细胞,分别接种至PDL包被和未包被的24孔板中培养过夜,无血清培养基培养24 h后,加入不同浓度的LPS(10、100、1 000 μg·L-1)处理48 h。提取培养0、2、4、6、7 d的混合细胞的总RNA及上述样品的总RNA。反转录获得cDNA。采用染料法进行qPCR检测,以管家基因RPL27为内参,检测混合胶质细胞的Tuj1、NeuN、TREM2的mRNA转录水平和LPS刺激组样品检测IL-1α、IL-1β的mRNA水平。引物序列见Tab 1。

Tab 1 Real-time PCR primer sequence
2.6 免疫荧光实验小胶质细胞接种至12孔板中培养过夜,加入4%多聚甲醛固定20 min;用PBS清洗2次,加入5%山羊血清封闭30 min;用PBS清洗2次,加入1 μL抗Iba1和0.5 μL抗GFAP抗体4 ℃孵育过夜;PBS清洗3次,加入0.5 μL Alexa Fluor®488、1 μL Alexa Fluor®647标记的二抗,室温孵育1 h;PBS清洗3次,加入DAPI室温孵育10~15 min,倒置显微镜观察。
2.7 流式细胞术检测混合胶质细胞和小胶质细胞利用80%甲醇固定5 min,0.1% Triton X-100处理20 min。分别加入GFAP、Tuj1、Iba1抗体,具体方法参照抗体说明书。流式细胞仪检测混合细胞中星形胶质细胞、神经元及小胶质细胞所占的比例。
2.8 吞噬试验原代小胶质细胞接种至未包被的96孔板中培养,对照组加入细胞松弛素D孵育30 min,随后与实验组细胞同时加入pH荧光探针Protonex×600 Red-Latex Beads Conjugate孵育4 h。利用Incucyte每隔20 min拍照1次,记录荧光强度的变化,并将荧光强度均值与时间做归一化处理。
2.9 液相芯片多因子检测将混合胶质细胞和小胶质细胞对应接种至未包被、PDL包被、Matrigel包被以及I型胶原蛋白包被的24孔板中,无血清培养过夜后,加入100 μg·L-1LPS处理48 h,收集细胞上清,通过上海华盈生物医药科技有限公司进行多因子检测。
2.10 统计学分析数据使用GraphPad Prism 6软件分析,多样本均数比较采用单因素方差分析,满足方差齐性采用Fisher检验,方差不齐则采用T检验法。
3 结果
3.1 胶质细胞表征
3.1.1qPCR表征混合细胞中各类细胞特征性标记物mRNA相对转录水平随时间的变化 混合细胞在培养0、2、4、6、7 d后,检测各类细胞特征性标记物mRNA的相对转录水平。如Fig 1所示,在培养至d 2时,神经元特异性标记物Tuj1、NEUN mRNA转录水平迅速降低,说明神经元细胞数量迅速减少(Fig 1A)。而小胶质细胞特征性标记物TREM2和星形胶质细胞标记物GFAP的mRNA转录水平,随着培养时间的延长逐渐升高,且GFAP mRNA转录水平上升速度远高于TREM2。小胶质细胞培养至d 6时,TREM2的转录水平上调31倍,趋于稳定(Fig 1B)。

Fig 1 Relative transcription levels of GFAP, TREM2, Tuj1 and NEUN
Normalization by RPL27.
3.1.2免疫荧光表征小胶质细胞纯度 小胶质细胞用多聚甲醛固定后,加入抗GFAP、Iba1两种单克隆抗体、荧光染料DAPI进行免疫荧光实验。结果显示,全部细胞均标记上绿色荧光,镜下未见红色荧光标记的细胞(Fig 2)。说明磁珠分选获得了高纯度的小胶质细胞。
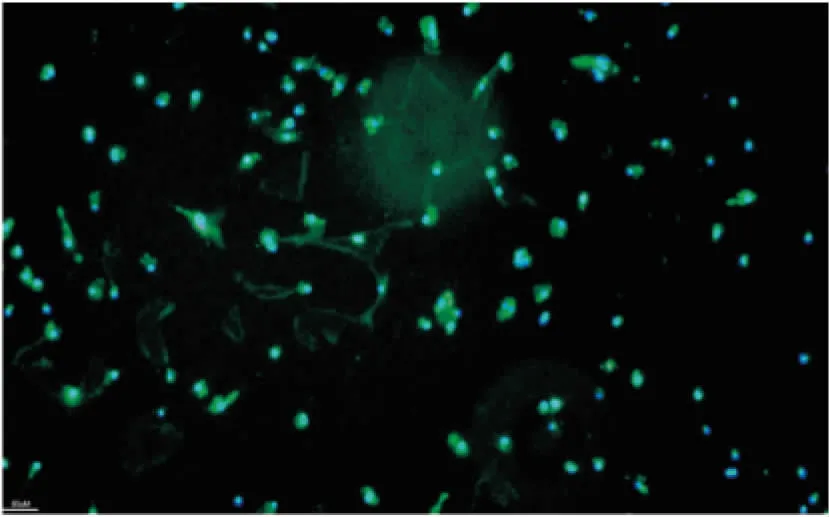
Fig 2 Immunofluorescence staining of microglia obtained by magnetic bead sorting(×10)
Blue is DAPI-stained nuclei, green is Iba1-FITC-stained microglia, and red is GFAP-stained astrocytes.
3.1.3流式细胞术检测混合胶质细胞中各细胞所占的比例 如Fig 3所示,星形胶质细胞(GFAP+)占混合细胞的91.4%,神经元细胞(Tuj1+)未检出,小胶质细胞(Iba1+)约占混合胶质细胞的8.5%。
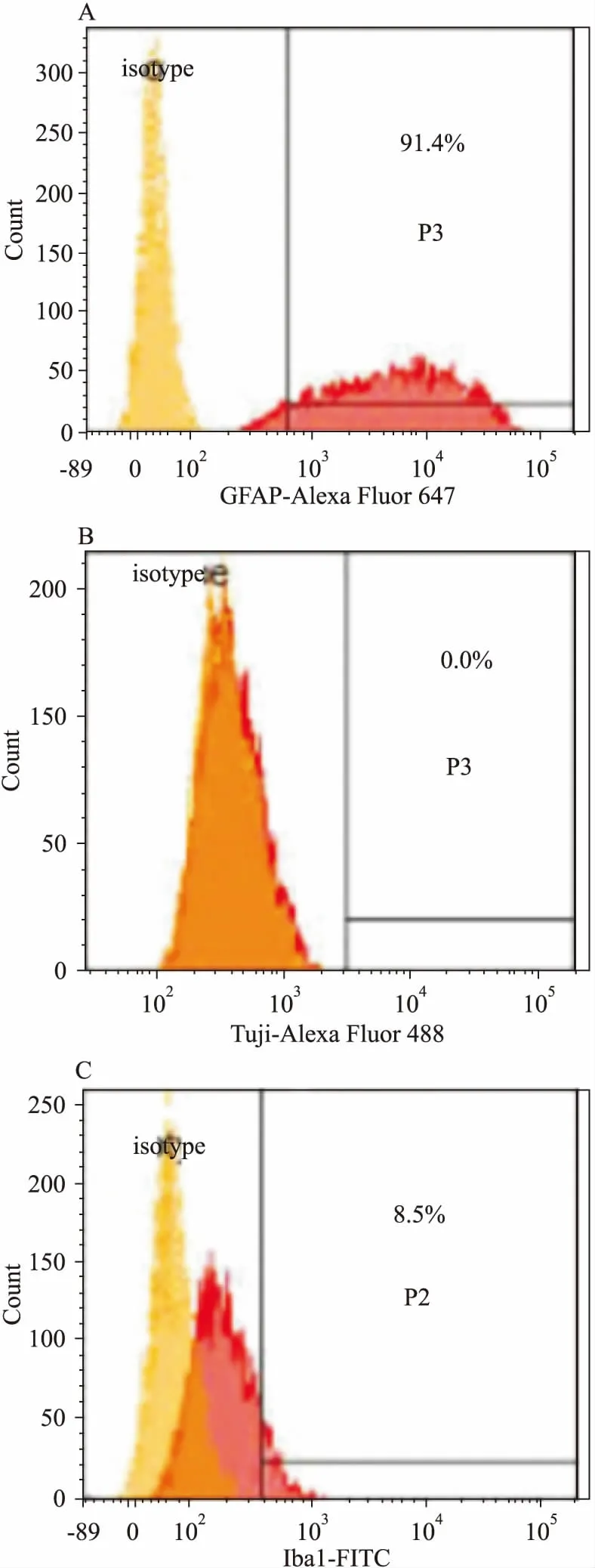
Fig 3 Flow cytometric analysis of GFAP(A), Tuj1(B), Iba1(C) expression and proportion on primary mix glial cells
The cells were stained with anti-GFAP, anti-Tuj1, anti-Iba1 and their isotype control.
3.1.4小胶质细胞吞噬功能检测 每组荧光强度随时间的变化如Fig 4所示,对照组荧光强度不随时间延长而增加;实验组荧光强度随时间的延长逐渐增强。说明获得的原代小胶质细胞保留了正常小胶质细胞的吞噬能力。

Fig 4 Relationship between fluorescence intensity and time
Primary microglia were incubated with ProtonexTM600Red Beads for 4 h, fluorescence was processed by incucyte.
3.2 包被条件对胶质细胞炎症模型评价的影响
3.2.1mRNA水平初步探究包被条件对胶质细胞炎症模型评价的影响 为探究培养材料表面处理以及细胞间协同作用对胶质细胞炎症反应的影响,将混合胶质细胞和小胶质细胞分别接种至未包被和PDL包被的培养材料中,加入含不同浓度LPS的培养液处理48 h,利用qPCR检测IL-1α、IL-1β的mRNA变化情况。
3.2.1.1包被条件对混合胶质细胞的影响 考察不同包被条件对混合胶质细胞炎症模型评价的影响。如Fig 5所示,加入LPS(100 μg·L-1)处理时,未包被条件下IL-1α的mRNA转录水平上调556倍,IL-1β的mRNA转录水平上调12倍,均明显低于PDL包被条件下这两种炎症因子的转录水平。根据不同浓度LPS处理的结果可看出,培养材料是否包被,对胶质细胞炎症反应影响较大,在包被条件下,混合胶质细胞对LPS更加敏感。
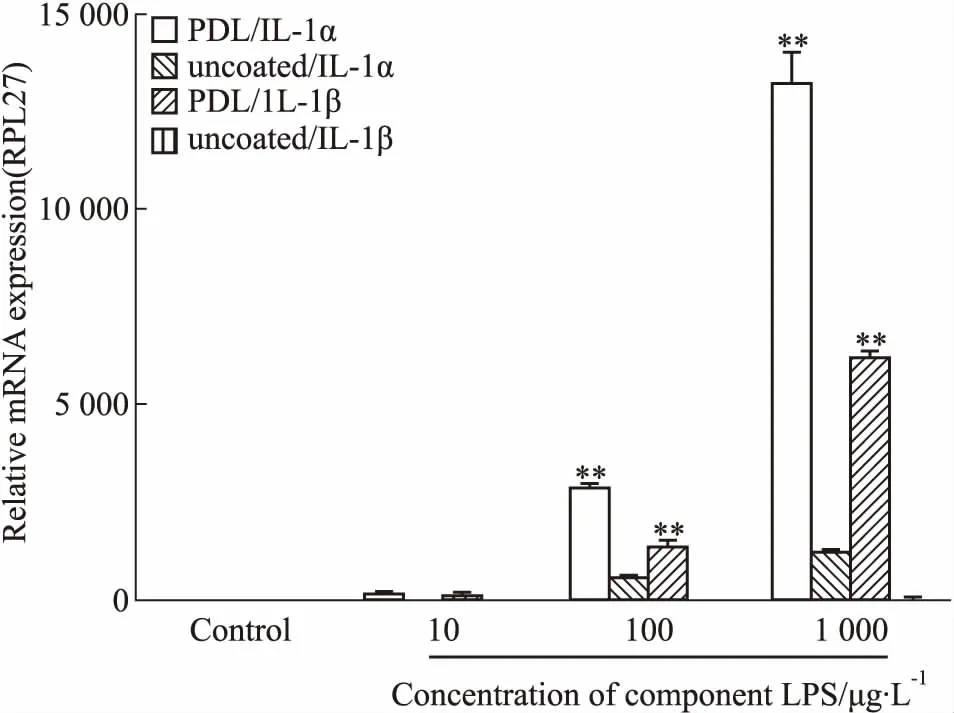
Fig 5 Transcription levels of inflammatory factor IL-1α and IL-1β mRNA after stimulation of mix glial by different concentrations of
**P<0.01vsuncoated condition
3.2.1.2包被条件对小胶质细胞炎症模型评价的影响 如Fig 6所示,LPS(100 μg·L-1) 处理小胶质细胞,未包被条件下,IL-1α上调58倍,IL-1β上调11倍;包被条件下IL-1α上调34倍,IL-1β上调5倍。1 000 μg·L-1处理时,亦是未包被条件下经LPS刺激后,IL-1α和IL-1β转录水平相对于包被条件下的转录水平更高。综上所述,未包被条件下,小胶质细胞对LPS更加敏感。

Fig 6 Transcription levels of inflammatory factor IL-1α and IL-1β mRNA after stimulation of microglial by different concentrations of
*P<0.05,**P<0.01vsuncoated condition
3.2.2深入探究包被条件对胶质细胞炎症模型评价的影响 根据qPCR结果,选用100 μg·L-1LPS处理在多种培养材料表面培养的混合胶质细胞和小胶质细胞48 h,并收集细胞上清,使用液相芯片检测样品中G-CSF、IL-1α,IL-1β等23种细胞因子的含量。混合胶质细胞结果见Tab 2,小胶质细胞结果见Tab 3。
3.2.2.1包被条件对混合胶质细胞形态与生长的影响 混合胶质细胞培养在未包被、Matrigel包被、PDL包被、Ⅰ型胶原蛋白包被条件下的24孔板中,正常培养48 h,PDL包被和I型胶原蛋白包被条件下培养的混合胶质细胞无显著形态差异,均与未包被条件下细胞形态类似(Fig 7A)。Matrigel包被条件下,小胶质细胞丰度明显高于其他环境培养的小胶质细胞(Fig 7B)。加入LPS处理后,未包被条件下,细胞形态如Fig 7C所示,Matrigel包被条件下细胞形态如Fig 7D所示,与正常培养条件下相比较,表层的小胶质细胞形态发生明显的变化。
3.2.2.2包被条件对混合胶质细胞炎症模型评价的影响 在各种培养条件下,多因子检测各炎症因子浓度如Tab 3所示。可看出细胞因子TNF-α、G-CSF、IL-1α、MIP-IL-1β、RANTES的表达量在Matrigel包被条件下明显高于其他条件下,约为其他条件下的1.5~4倍;KC的表达量在Matrigel包被条件下是其他条件的8.5~20倍。GM-CSF的表达量在PDL包被条件下相对较低,而在其他三种条件下的表达量则差异无显著性。其他细胞因子在各种条件下表达量差异均无显著性。

Tab 2 Detection of mixed glial protein expression under different
OO>:out of high limit of detection, OO<: below low limit of detection

Tab 3 Detection of microglia protein expression under different
3.2.2.3包被条件对小胶质细胞炎症模型评价的影响 用LPS处理未包被、Matrigel、PDL、I型胶原蛋白包被4种条件下的小胶质细胞,多因子检测数据结果如Tab 4所示。Matrigel包被条件下加入LPS刺激,各炎症因子表达量均无明显上升,而未包被条件下,加入LPS刺激后,各炎症因子浓度明显升高,且均高于PDL和I型胶原蛋白包被条件。说明小胶质细胞在未包被条件下,对LPS的刺激更为敏感,与qPCR结果一致;PDL包被和I型胶原蛋白包被条件下,小胶质细胞对LPS的敏感性差异无显著性,在Matrigel包被条件下,小胶质细胞对LPS基本不敏感。

Fig 7 Morphology of mixed glial cultured with different culture materials
A~B: Different materials cultured mixed glial without LPS treatment; C, D: Different materials culture mixed glial treated with 100 μg·L-1LPS for 48 h. A and C were cultured on uncoated material, B and D were cultured on Matrigel coated plate.
4 讨论
混合胶质细胞在炎症反应强度与广度上均优于提纯后的小胶质细胞。混合胶质细胞中,小胶质细胞的比例通常不会超过5%。因此,尽管多因子检测结果中,小胶质细胞的炎症因子浓度更高,但考虑到细胞比例后,实际上混合胶质细胞中的小胶质细胞分泌炎症因子的能力更强。例如,未包被条件下,经LPS(100 μg·L-1)处理后,105个混合胶质细胞中,含有5×103个小胶质细胞,IL-6的浓度为692.9±75.4 ng·L-1,而提纯的小胶质细胞在同等细胞数量时仅能产生465.6±130.4 ng·L-1的IL-6。说明星形胶质细胞不仅可贡献如IL-6等炎症因子,还通过细胞间协同作用向小胶质细胞提供正反馈。
对多因子检测实验的数据进行深入分析,可发现以下几个特点:① Ⅰ型胶原蛋白与PDL包被材料培养的胶质细胞,炎症因子浓度与构成基本一致,仅在小胶质细胞培养体系中RANTES(CCL5) 的表达量相差10倍,其余因子浓度均在相同数量级。② 培养材料用Matrigel包被培养的细胞炎症因子成分与比例较其它培养材料有较大不同,例如混合胶质细胞培养体系中,Matrigel包被条件下的KC(CXCL1)分泌量达到其他条件下的15~20倍,其他指标亦超过非Matrigel包被的数倍,但IL-12p40分泌量却与其他环境接近。③ 将相同培养环境中小胶质细胞与混合胶质细胞的炎症因子分泌情况进行比较。在有包被情况下,混合胶质细胞的KC与MCP1(CCL2)分泌量均明显高于小胶质细胞,有的差异甚至达到多个数量级。这说明星形胶质细胞亦参与了这两种趋化因子的分泌。在未包被条件下,小胶质细胞的炎症因子分泌量则普遍较高。④ 混合胶质细胞在PDL包被条件下,LPS刺激导致IL-1α与IL-1β的mRNA转录量出现大幅提升,而其蛋白浓度提高却不甚明显。这提示了炎症模型评价以蛋白浓度变化为准的重要性。
用Matrigel包被的培养材料培养混合胶质细胞,其表层可观察到小胶质细胞密度明显高于其他材料培养时的细胞密度,且细胞状态更佳。而且,LPS刺激Matrigel包被条件下培养的混合胶质细胞,表面的小胶质细胞形态与其在小鼠体内的形态高度接近[16],说明Matrigel包被培养的混合胶质细胞为小胶质细胞提供了接近体内的生长环境。相反,因为在Matrigel包被的培养材料中,小胶质细胞对LPS的敏感性显著下降,因此,当研究者需要使用提纯的小胶质细胞时,应避免使用Matrigel包被的培养材料。此时应用未包被的材料培养,虽会牺牲一部分贴壁能力较差的细胞,却能保证细胞对LPS等刺激因子具有高度的敏感性。
此外,根据本研究中qPCR与流式细胞检测数据,神经细胞在体外培养2 d后即凋亡消失[17],相反,星形胶质细胞与小胶质细胞的比例逐渐增加。不同于传统方法中混合培养21 d后再分离、收集细胞的策略。因此,在时间紧迫时,可提高起始动物只数,从而可将实验周期缩短至7 d。
本研究通过将多种新材料和新技术应用于小鼠胶质细胞的分离培养,比较传统培养方法和新材料新技术的区别。通过本研究,可以得出以下结论:① 对于建立神经胶质细胞炎症模型,应使用混合胶质细胞;② 使用Matrigel替代传统的PDL作为培养材料的首选包被液,以达到最大程度模拟体内环境、提高细胞活力的目的;③ 建立炎症模型应以蛋白水平炎症因子检测为主要指标。
(致谢:本实验在军事科学院军事医学研究院生命组学研究所特殊环境组学研究室进行,在此向所有帮助我的老师和同学表示由衷的感谢!)