青光安颗粒剂对TGF-β1诱导的HTFs增殖影响的实验研究
喻娟 彭清华
流行病学资料显示,青光眼是仅次于白内障,导致视力丧失的第二大原因,也是世界上第二个不可逆转的失明原因[1]。目前,常用的治疗方法是青光眼滤过手术(glaucoma filtering surgery,GFS),其效果主要受房水引流通畅程度的影响。术后纤维瘢痕形成往往是GFS失败的主要原因[2]。因此,调节异常结膜伤口修复以防止滤过疤痕已成为预防青光眼的热点之一。青光眼术后滤过隧道瘢痕形成的本质是人工过滤区伤口愈合机制的局部表现[3]。在此过程中,人类Tenon成纤维细胞(human Tenon's capsule fibroblasts,HTFs)的激活被认为是伤口修复和瘢痕形成的主要原因[4-5]。转化生长因子 β1(transforming growth factor-β1,TGF-β1)是伤口愈合的重要调节因子,在GFS后瘢痕形成中起重要作用,已被认为是HTFs转化为肌成纤维细胞(myofibroblast,MFs)的主要诱导因子[7]。三氧化二坤与兔Tenon's囊成纤维细胞的关系密切[8]。在本研究中,TGF-β1刺激的HTFs被用作细胞模型来研究HTFs活化和增殖的机制及溶液策略。青光安颗粒剂是复方中药,能让青光眼患者术后视力、视野及滤过泡形态均优于对照组,并能有效维持较低的眼压[9]。自噬是一种细胞过程,可以回收受损的细胞器和长寿命蛋白,以维持细胞能量的稳态[10]。自噬参与炎症,细胞应激,发育,衰老,癌症以及细胞成分的内源性和外源性清除。如果自噬不能从细胞中去除细胞内碎片,则细胞凋亡发生并且组织将被破坏[11]。本研究测试了青光安颗粒剂抑制TGF-β1诱导HTFs增殖和自噬的影响。
材料与方法
一、材料
1.实验样本:雄性C57BL/6J小鼠,10周龄,重约25 g,饲养于空调室内,光照周期为12 h、(20±2)℃和50% ~ 60%湿度,饮用水均经过灭菌处理。Tenon的活组织检查样本是在标准GFS中获得的。青光安颗粒按9.18 g/kg剂量灌胃给予青光安颗粒,连续7 d,1 次 / d。末次灌药后1 h,颈主动脉取血,分离血清,所取血清经56 ℃,30 min灭活处理后,用0.22 μm的微孔膜过滤除菌,置于20 ℃冰箱保存备用。
2.试剂:CCK细胞计数试剂盒、胎牛血清(上海碧云天公司);Eagle培养基(美国Invitrogen公司);青霉素、链霉素、TGF-β1(美国Sigma公司);青光安(厦门中药厂);流式细胞仪(美国BD公司);小鼠抗人Beclin-1单克隆抗体、小鼠抗人ATG-5单克隆抗体、小鼠抗人LC-3Ⅲ单克隆抗体(美国Sigma公司)。
二、方法
(一)细胞培养与鉴定
从接受GFS手术的个体获得人结膜下Tenon胶囊样品。获得HTFs作为1 cm×1 cm×1 cm的Tenon胶囊外植体的扩增培养物,并在补充有15%热灭活胎牛血清Dulbecco改良的Eagle培养基中繁殖,培养基中含100 U/ml青霉素和100 μg/ ml链霉素,在37 ℃5% CO2湿润气氛中。HTFs维持在对数生长期。第3 ~ 6代的HTFs用于该研究。所有实验重复至少3次,并计算平均值用于本研究中的分析。制备青光安10倍组血清,5倍组血清,2.5 倍组血清,在100 ng/ml TGF-β1刺激前1 h加入细胞培养基中。将DMSO(0.1%)加入载体对照孔的培养基中。
(二)研究分组与干预
从接受GFS手术的个体获得人结膜下Tenon胶囊样品。实验设计分为3组:对照组(HTFs未经处理,n= 10);TGF-β1诱导组(100 ng/ml TGF-β1诱导 HTFs,构建 GFS术后细胞模型,n= 10);TGF-β1+ 青光安治疗组(TGF-β1诱导 + 青光安颗粒剂血清处理 HTFs,n= 30)。TGF-β1+ 青光安治疗组按照青光安血清的剂量进一步分为3组:TGF-β1+ 青光安高剂量组(TGF-β1诱导 + 青光安颗粒剂血清5 ml处理HTFs);TGF-β1+青光安中剂量组(TGF-β1诱导+青光安颗粒剂血清2.5 ml处理HTFs);TGF-β1+青光安低剂量组(TGF-β1诱导+青光安颗粒剂血清处理1 ml HTFs);每组设10个培养皿。
(三)观察指标
1.CCK-8分析:通过CCK细胞计数试剂盒用CCK测定法测定检查细胞增殖。该测定基于活细胞中线粒体脱氢酶对四唑盐WST-8的切割。在各种处理后,收获处于指数生长期的HTFs,并以1×105个/ ml的密度接种在5个96孔板中,每孔总体积为100 μl。并用指定浓度青光安血清和TGF-β1处理24 h,如本研究中的先前实验。然后向每个孔中加入10 μl的2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺基)-2H-四唑鎓单钠盐WST-8。将板在37 ℃下再温育4 h。通过使用微孔板分光光度计在490 nm处测量吸光度,并通过与阴性对照比较来归一化结果,该实验重复3次。
在不含抗生素的完全培养基中将HTFs细胞接种在密度为4×105个/ml的平板中。24 h后,用含或不含100 ng/ml TGF-β1和含或不含青光安的小鼠的血清替换培养基(不含清光安的小鼠血清即为未经青光安颗粒剂处理的小鼠的血清)。处理24或48 h后收获细胞。对照HTFs未经处理或仅用Lipofectamine 2000处理。实验分为对照组、TGF-β1诱导组和TGF-β1+青光安治疗组。含药血清的制备:青光安颗粒剂(10 g·kg-1·d-1)灌胃小鼠给药,连续6 d,每日1次,末次给药后1 h,腹主动脉采血,2 000×g离心 10 min,取血清,56 ℃、30 min 水浴灭活,然后经0.22 μm滤膜抽滤除菌,-80℃保存备用。本研究已经在湖南中医药大学第一附属医院医学伦理委员会报备并获得批准,动物实验批准文号2018-0525。
2.定量实时PCR:定量实时PCR用于确定各种处理后HTFs的自噬相关蛋白Beclin-1、自噬相关基因 5(autophagy related gene 5,ATG-5)、微管相关蛋白1-轻链3(microtubule associated protein 1 light chain 3,LC-3)基因mRNA水平。使用RISO试剂从HTFs分离总RNA并用DNA酶Ⅰ处理。通过使用oligo-d(T)引物从总RNA逆转录酶合成cDNA。使用SYBR Master混合物,用Bio-Rad IQ5实时PCR检测系统进行定量实时PCR分析。在每个cDNA模板上一式3份进行PCR反应以及管家基因GAPDH的一式3份反应。通过解链曲线分析验证特异性扩增。数据针对GAPDH进行标准化。使用ΔΔCT方法(IQ5软件版本2.0)测定表达水平,并表示为倍数变化。实验一式3份进行,每次处理3个生物样品。(表1)
3.蛋白质印迹:用冰冷的PBS冲洗后,使用含有磷酸酶抑制剂(1 mmol/L钒酸钠,50 mmol/ L NaF)和蛋白酶的裂解缓冲液(20 mmol/L Tris,150 mmol/L NaCl,1 mmol/L EDTA,1%Triton X-100)制备HTFs裂解物。抑制剂(0.1%苯甲基磺酰氟;完全蛋白酶抑制剂,上海罗氏公司)。二辛可宁酸测定用于测定蛋白质浓度。然后,在Laemmli样品缓冲液中煮沸后,将10 μg蛋白质提取物进行SDS聚丙烯酰胺凝胶电泳。使用Bio-Rad凝胶印迹装置将蛋白质转移到聚偏二氟乙烯膜上。将膜在TBST[10 mmol/L Tris HCl(pH 7.5),150 mmol/ L NaCl,0.1%Tween20]中 的 10%无脂乳中封闭1 h,然后在4 ℃下与一抗(小鼠抗人Beclin-1单克隆抗体、小鼠抗人ATG-5单克隆抗体和小鼠抗人LC-3Ⅲ单克隆抗体;1:1 000)一起温育过夜。用过氧化物酶偶联的二抗(1:5 000)在室温下保持45 min。在每个温育步骤后,将膜在TBST中洗涤3 次(每次 10 min)。使用以下抗体:抗 Beclin-1,ATG-5,抗LC-3Ⅲ,抗GADPH。通过化学发光揭示过氧化物酶,并通过暴露于X射线胶片显现过氧化物酶。

表1 RT-PCR引物序列
4.流式细胞仪:青光安血清培养并用TGF-β2处理48 h后,通过流式细胞术检查细胞周期。通过胰蛋白酶消化收集HTFs并用PBS洗涤2次,然后以1×106个/ml重悬于PBS中,并在4℃下在70%冰冷的乙醇(v/v)中固定过夜。固定的细胞用0.5 ml碘化丙锭/RNase染色缓冲液在黑暗中于4℃染色30 min。使用流式细胞仪分析G0/G1,S和G2/M级分的细胞数。根据PI =(G2/M+S)/(G0/G1+S+G2/M)计算增殖指数。
5.Cyto-ID免疫细胞化学染色:通过Cyto-ID免疫细胞化学染色测定青光安颗粒剂对HTFs细胞自噬的影响。(1)载玻片防脱片剂处理:可选择APES或 Poly-Lysine。捞片后置烤箱58 ~ 60 ℃,30 ~60 min以使切片紧密黏附;(2)切片脱蜡,水洗;(3)必要时根据抗原情况对切片进行微波修复抗原或酶消化处理。蒸馏水洗2 min×3 次;(4)滴加正常血清封闭液,室温10 min;(5)滴加适当稀释的一抗(小鼠抗人Beclin-1单克隆抗体、小鼠抗人ATG-5单克隆抗体和小鼠抗人LC-3Ⅲ单克隆抗体),20 ~ 37℃1 ~ 2 h 或 4℃过夜。PBS 洗 2 min×3 次;(6)滴加的和一抗相对应的生物素化二抗,20 ~ 37℃ 30 min。PBS洗2 min×3 次;(7)滴加荧光素标记的ABC,20 ~ 37℃ 30 min。PBS 洗 5 min×4 次;(8)水溶性封片剂封片。荧光显微镜观察。
三、统计学分析方法
采用SPSS 20.0统计分析软件。HTFs的活力、细胞周期、自噬阳性细胞数目、自噬相关基因mRNA的表达、自噬相关蛋白的水平用表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料采用百分率(%)表示,组间比较采用c2分析,以P< 0.05为差异具有统计学意义。
结 果
一、青光安对TGF-β1诱导的HTFs激活和增殖的影响
CCK-8检测结果显示,细胞生长显示外源TGF-β1可为HTFs提供生长优势,与对照组相比,TGF-β1诱导组导致HTFs细胞的增殖能力增加(P<0.05),培养基中加入不同剂量的青光安含药血清后,HTFs细胞的增殖能力降低(P< 0.05),TGF-β1+青光安高剂量组细胞增殖水平降低最为明显(表2)。
表2 青光安颗粒剂抑制HTFs的活力(±s)

表2 青光安颗粒剂抑制HTFs的活力(±s)
注:与对照组比较,aP < 0.05;与 TGF-β1 诱导组比较,bP < 0.05
分组 细胞培养皿数量 增殖能力对照组 10 12.85±1.13 TGF-β1 诱导组 10 23.42±1.25a TGF-β1+青光安低剂量组 10 19.47±1.14b TGF-β1+青光安中剂量组 10 16.38±1.07b TGF-β1+青光安高剂量组 10 13.52±1.24b F值 12.347 P值 < 0.01
二、TGF-β1和青光安治疗对HTFs细胞周期的影响
通过流式细胞术评估青光安对细胞周期的影响。TGF-β1诱导组G0/G1期HTFs百分比低于对照组(P< 0.05),TGF-β1+ 青光安治疗组高于TGF-β1 诱导组(P< 0.05)。 相反,TGF-β1 诱导组中S期HTFs百分比较对照组增加(P< 0.05),TGF-β1+ 青光安治疗组低于 TGF-β1 诱导组(P<0.05)。TGF-β1诱导组与对照组和TGF-β1+ 青光安治疗组在G2/M期差异无统计学意义(P>0.05)。(表3)
三、青光安颗粒剂对HTFs细胞自噬的影响
通过Cyto-ID免疫细胞化学染色测定青光安颗粒剂对HTFs细胞自噬的影响。对照HTFs在细胞质中表现出弱的绿色点状染色。在用TGF-β1处理后,在细胞中显示出增强的HTFs细胞自噬(P<0.05)。与 TGF-β1 诱导组相比,用 TGF-β1+ 青光安治疗组导致荧光染色强度降低,HTFs阳性细胞数目减少(P<0.05)。(图1,表4)
表3 TGF-β1和青光安治疗对HTFs细胞周期的影响(%,±s)

表3 TGF-β1和青光安治疗对HTFs细胞周期的影响(%,±s)
注:与对照组比较,aP < 0.05;与 TGF-β1 诱导组比较,bP < 0.05
分组 细胞培养皿数量 G0/G1期 S 期 G2/M期对照组 10 94.92 ±1.63 1.61 ±0.72 3.47 ±1.11 TGF-β1 诱导组 10 88.29 ±0.35a 9.04 ±0.25a 2.67 ±0.15 TGF-β1+ 青光安治疗组 30 91.18 ±1.04b 5.41 ±0.59b 3.41 ±0.53 F 值 15.374 13.857 18.263 P 值 0.012 0.007 0.432
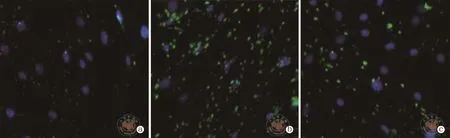
图1 荧光显微镜下观察Cyto-ID免疫细胞化学SP染色结果(×400)
表4 青光安颗粒剂对HTFs细胞自噬的影响(±s)
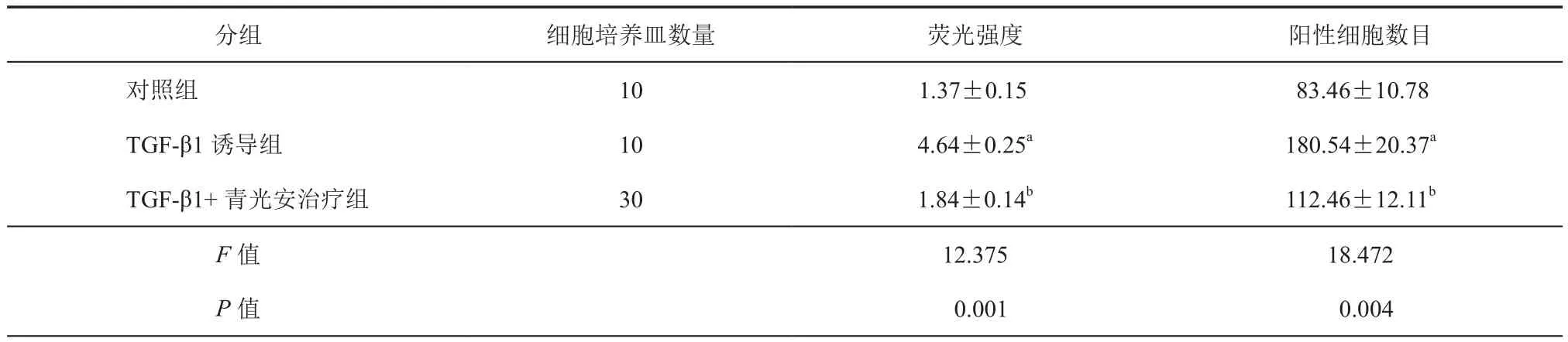
表4 青光安颗粒剂对HTFs细胞自噬的影响(±s)
注:与对照组比较,aP < 0.05;与 TGF-β1 诱导组比较,bP < 0.05
分组 细胞培养皿数量 荧光强度 阳性细胞数目对照组 10 1.37±0.15 83.46±10.78 TGF-β1 诱导组 10 4.64±0.25a 180.54±20.37a TGF-β1+ 青光安治疗组 30 1.84±0.14b 112.46±12.11b F值 12.375 18.472 P值 0.001 0.004
四、青光安颗粒剂增加自噬相关基因mRNA的表达水平
使用qRT-PCR分析测定HTFs中Beclin-1、ATG-5和LC-3Ⅲ的基因表达水平。结果显示,TGF-β1处理后,自噬相关基因表达均降低。而TGF-β1+青光安治疗组逆转TGF-β1处理对自噬基因表达水平的影响,与TGF-β1组相比,自噬相关基因均升高(P< 0.05)。(图2,表5)
五、青光安颗粒剂增加自噬相关蛋白的水平
使用Western印迹分析测定HTFs中Beclin-1、ATG-5和LC-3Ⅲ的蛋白质水平。结果显示,TGF-β1处理后,自噬相关蛋白均降低。而与TGF-β1组相比,TGF-β1+ 青光安治疗组 Beclin-1、ATG-5和LC-3Ⅲ的蛋白质水平分别降低48.73%、30.3%和30.93%(P< 0.05)。(表6,图3)

图2 自噬相关基因mRNA的表达水平
表5 自噬相关基因mRNA的表达水平(±s)

表5 自噬相关基因mRNA的表达水平(±s)
注:与对照组比较,aP < 0.05;与 TGF-β1 诱导组比较,bP < 0.05
分组 细胞培养皿数量 Beclin-1 ATG-5 LC-3Ⅲ对照组 10 5.43±0.97 8.24±1.03 6.43±0.85 TGF-β1 诱导组 10 2.25±0.54a 4.32±0.69a 3.54±0.96a TGF-β1+ 青光安治疗组 30 4.97±0.68b 7.36±0.85b 5.83±0.25b F值 9.654 16.866 17.675 P 值 < 0.01 < 0.01 < 0.01
表6 HTFs中自噬相关基因表达量(±s)
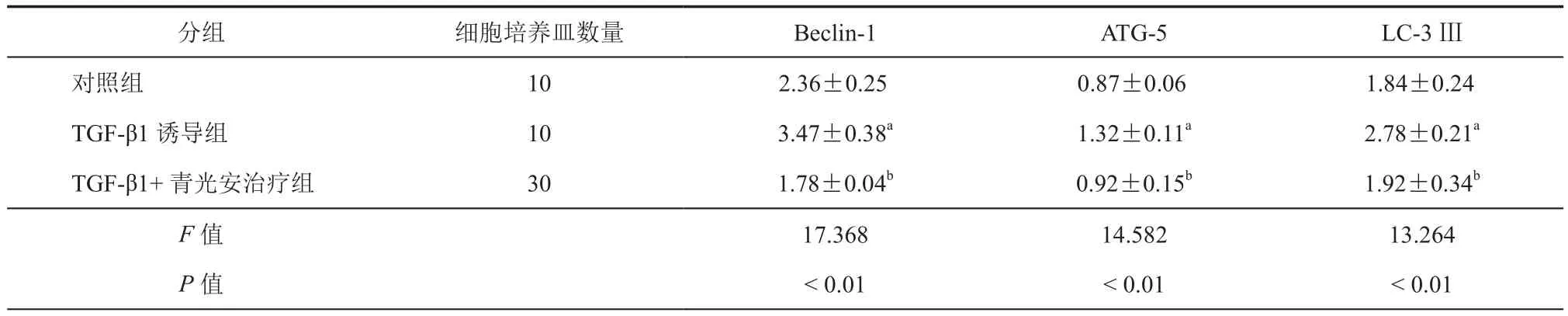
表6 HTFs中自噬相关基因表达量(±s)
注:与对照组比较,aP < 0.05;与 TGF-β1 诱导组比较,bP < 0.05
分组 细胞培养皿数量 Beclin-1 ATG-5 LC-3Ⅲ对照组 10 2.36±0.25 0.87±0.06 1.84±0.24 TGF-β1 诱导组 10 3.47±0.38a 1.32±0.11a 2.78±0.21a TGF-β1+ 青光安治疗组 30 1.78±0.04b 0.92±0.15b 1.92±0.34b F值 17.368 14.582 13.264 P值 < 0.01 < 0.01 < 0.01

图3 免疫印迹分析Beclin-1、ATG-5和LC-3Ⅲ蛋白的表达量
讨 论
青光眼是一种进行性视神经病变,已经假定几种因素在青光眼中起作用,包括缺血性兴奋性毒性,神经营养不足和眼内压升高[3]。HTFs向肌成纤维细胞的转分化在伤口愈合过程中起主要作用。在这个过程中,细胞被激活并表达丰富的ECM蛋白和生长因子,这些在伤口愈合中是必不可少的[12]。肌成纤维细胞的持续发生可能与术后瘢痕形成和GFS失败有关。减少HTFs向肌成纤维细胞的转分化可以改善GFS的长期效果。本研究获得了HTFs作为人类Tenon外植体的扩增培养物,然后评估青光安对HTFs细胞增殖和自噬的影响。
GFS后的瘢痕形成与伤口修复期间结缔组织的产生一致。TGF-β1是伤口愈合的重要调节因子,也是血管纤维化过程中的关键调节剂[14]。在GFS后瘢痕形成中起重要作用,已被认为是HTFs转化为MFs的主要诱导因子[8-9]。本研究TGF-β1刺激HTFs被用作细胞模型来研究HTFs活化和增殖的机制和溶液策略。细胞周期分析显示青光安治疗处理导致G0/G1期的比例增加,而S期的比例降低。通过CCK-8测定也检测到HTFs活力的降低。这些结果表明,青光安治疗可诱导HTFs细胞周期停滞于G0/G1期,可能阻止其DNA合成,这可能是HTFs中青光安治疗后抑制细胞增殖的机制。
近年来,青光安的抗炎,免疫调节和抗纤维化作用也有报道[16-18]。研究表明,青光安颗粒剂在视网膜色素上皮和角膜纤维化的调节中起重要作用[19-20]。在之前的研究中,证明了青光安能够减弱TGF-β1诱导的 α-SMA,CTGF和COL I转录的上调,以及影响HTFs的蛋白质表达,增殖和迁移而没有毒性;自噬在生理衰老以及HTFs的病理学中起重要作用。自噬的生理水平对于维持细胞稳态是必需的,并且在各种应激条件期间迅速上调。自噬途径的功能障碍,尤其是衰老,通常会促进人类疾病和一些神经退行性疾病[7,12]。矛盾的是,尽管主要具有促存活作用,但神经组织自噬在神经保护以及神经元损伤和死亡中起着重要作用,这取决于生理和病理环境[7]。自噬体是双膜结构,其中细胞质材料在自噬期间被包围。这些自噬体与溶酶体融合形成自溶酶体,细胞质物质被降解。Beclin-1、ATG-5和LC3-Ⅲ是自噬过程中参与自噬体形成的必需蛋白质。笔者认为,自噬强弱和Beclin-1、ATG-5和LC-3Ⅲ表达量的关系成正相关。青光安颗粒在HTFs自噬中的作用尚未阐明,需要进一步实验证实。
本研究发现,青光安颗粒剂增加了Beclin-1、ATG-5、LC3-Ⅲ mRNA和蛋白质的表达,青光安颗粒剂抑制TGF-β1诱导的HTFs增殖,且可能机制为青光安诱导HTFs细胞周期停滞于G0/G1期,而且青光安可减少TGF-β1诱导的HTFs自噬。

