GMPS,PR,CD40和p21对卵巢癌预后的预测价值(Prognostic values of GMPS,PR CD40,and p21 in ovarian cancer全译)
王萍 张增利 马予洁 路君 赵虎 王水良 谭建明 李冰燕
卵巢癌致死率在女性疾病中处于领先地位。上皮性卵巢癌约占所有类型卵巢癌的90%[1]并且在癌细胞已经转移到其他器官的晚期阶段才被诊断出来[2]。比如,卵巢癌只占所有女性癌症的2.5%,但是在女性癌症死亡率中却占了5%,其表明卵巢癌5年生存率很低[2]。然而,如果早期确诊,5年生存率将会达到93%[3]。因此,早期肿瘤诊断和有效预后预测是提高卵巢癌患者生存的关键。为此,之前有研究已经评估了生物标记物以便及早诊断这种致命的疾病并预测生存或治疗效果,或针对生物标记基因开发新的卵巢癌治疗靶点[2]。有一些研究也分析粘液性和透明卵巢细胞癌之间,低级别与低恶性潜能和高级别转移性卵巢癌之间的差异基因表达模式[2-4]。有报道发现基因或基因表达的改变与卵巢癌的早期诊断或风险评估的生物标志物相关联[5-6]。然而,迄今为止,没有可用于此目的有用(可靠)的分子及临床标记物[7]。目前使用基因表达谱寻找差异基因的方法多是比较卵巢癌与正常组织差异,这会导致获取数据有限。早期前驱病变和卵巢癌之间的差异基因表达谱可用于卵巢癌的早期诊断、预测预后,并为治疗靶标的生物标志物提供新的见解。
本文根据Gamwell等[8]描述的方法建立并鉴定了小鼠上皮卵巢癌进展的体外细胞模型。该细胞模型是从小鼠卵巢中分离卵巢表面上皮细胞(mouse ovarian surface epithelial cells,MOSECs)并在体外连续培养。这些MOSECs在体外可以发生自发的恶性转化形成上皮卵巢癌细胞。在体外细胞培养和传代期间,MOSECs显示出形态变化和基因表达改变[8-11],这可能是模拟人卵巢癌发生的良好体外细胞模型。先前的研究表明,自发转化的MOSECs具有HGSC肿瘤细胞所有特征。同时MOSE-I细胞具备癌前良性肿瘤所有特质,而MOSE-II细胞是恶性转化细胞[10]。
材料与方法
一、试剂与仪器
本研究的动物方案经福州总医院动物伦理委员会批准,并遵循美国国立卫生研究院的监管动物护理指南。实验动物(上海斯莱克实验动物有限公司),所述DMEM F12培养基(美国Thermo-Fisher Scientific 公司),4%热灭活的胎牛血清(美国Gibco公司)。庆大霉素,青霉素和链霉素溶液(美国Invitrogen公司),EVOS XL成像系统(美国Thermo-Fisher Scientific 公司)。
二、方法
(一)分离与培养MOSECs
根据Gamwell等[8]和McCloskey等[10]描述的方案,分离MOSECs并在“MOSE培养基”中培养它们,所述培养基来自Thermo-Fisher Scientific Company的DMEM F12培养基,补充有4%热灭活的胎牛血清,5 U/ml青霉素和5 μg/ml链霉素溶液,0.1 μg/ml庆大霉素,在 37 ℃,5%CO2下培养。根据先前的研究[9],具有自发恶性转化表型的MOSECs维持在MOSE培养基中,其会经历2个阶段,即早期阶段(MOSE-Ⅰ;正常上皮细胞)和晚期阶段(MOSE-Ⅱ;卵巢癌细胞的各种表型)。
(二)MOSE-I和MOSE-II细胞的培养和特征鉴定
为了诱导MOSECs的自发恶性转化,本研究在MOSECs培养基中连续培养和传代原代MOSECs。小于35代的MOSECs细胞命名为MOSE-Ⅰ细胞,MOSE-Ⅰ继续培养超过35代命名为MOSE-Ⅱ细胞。使用0.05%胰蛋白酶消化并传代细胞,用磷酸盐缓冲盐水(PBS)洗涤,制备单细胞悬液,然后将100个细胞接种到35 mm细胞培养皿中,培养14 d。然后使用结晶紫染色,拍照,计数。在软琼脂测定中,在60 mm细胞培养皿中1 : 1混合2×Ham's F-12:MOSE培养基与琼脂糖制备基层琼脂。然后将细胞悬浮液(2.5×104)与超纯LMP琼脂糖在37 ℃下混合,然后将其倒入琼脂基层顶部,并在37 ℃下孵育14 d。使用EVOS XL成像系统拍摄细胞克隆,并使用Image J软件定量。
(三)新一代测序技术检测MOSE-Ⅰ和MOSE-Ⅱ细胞之间差异表达基因
为了分析MOSE-Ⅰ和MOSE-Ⅱ细胞之间差异表达的基因,对MOSE-Ⅰ和MOSE-Ⅱ细胞进行了新一代测序。根据测序商的方案,使用Trizol Reagent从MOSE-Ⅰ和MOSE-Ⅱ细胞中分离提取总细胞RNA。在RNA定量和逆转录成cDNA后,本研究使用Illumina TruSeq文库制备每种细胞类型的cDNA文库,然后使用Illumina HiSeq 2000 NGS平台对MOSE-Ⅰ和MOSE-Ⅱ细胞之间的差异表达基因进行新一代测序。GEPIA是一个网络工具(http://gepia.cancer-pku.cn/),用于分析肿瘤和非肿瘤组织之间的基因表达,并提供交互式数据分析。本研究利用这个在线工具分析卵巢癌标本和正常对照之间四种选定显著差异表达基因(different expression genes,DEGs)(即 GMPS,PR,CD40和p21)的水平。
(四)进行生物信息学分析,构建成蛋白质-蛋白质相互作用(PPI)网络
使用GO分析对这些DEGs进行生物信息学分析,以注释这些DEGs的独特生物学功能。然后再使用KEGG数据库进一步分析了它们参与的信号通路。使用Fisher检验生成GO术语和信号转导途径,并使用P值与错误发现率(FDR)进行统计学校正。在使用GO术语和KEGG数据库对这些DEGs进行生物信息学分析后,根据先前的报告使用STRING将这些DEGs构建到PPI网络中[12]。该网络资源包含用于全面预测已知蛋白质与蛋白质相互作用的生物学数据库。将DEGs上传到STRING数据库,然后网站为这些DEGs生成PPI。本研究使用P< 0.05的组合分数作为截止标准,以识别任何给定的蛋白质与另一个蛋白质相互作用,然后根据Saito等[13]之前的研究将这个PPI导入Cytoscape软件,从而进一步构建PPI网络,其中通过计算连接到其他蛋白质与非连接蛋白质的程度来揭示中枢节点(具有重要生物学功能的关键蛋白质)。
(五)TCGA数据库和cBioPortal
TCGA数据库用于存储30种不同人类癌症的差异表达基因和临床病理学数据[14]。本研究检索了浸润卵巢癌数据集,其中包括606例卵巢癌与311例正常组织的DEGs数据。然后,将DEGs数据放入 cBioPortal(www.cbioportal.org),这是一个帮助探索,可视化和分析DEG数据的Web资源。根据cBioPortal的在线说明计算这些DEGs对总生存期(OS)和无病生存期(DFS)的贡献。此外,根据之前的研究,使用Kaplan-Meier Plotter在线工具(www.kmplot.com)生成了 GMPS,PR,Cd40和p21 mRNA水平表达并分析其卵巢癌患者的Kaplan-Meier曲线[15]。该网站包括4 142例卵巢癌患者的基因表达和存活数据。使用Kaplan-Meier曲线和对数秩检验以及风险比的95%置信区间,分析了GMPS,PR,CD40和p21的高表达与低表达对卵巢癌患者的无复发生存期(RFS)影响。
三、统计学分析方法
使用SAS9.0软件进行统计学分析。细胞克隆形成率均使用表示。两样本之间的差异性分析使用独立样本t检验。以P< 0.05为差异有统计学意义。
结 果
一、 MOSE-Ⅰ和MOSE-Ⅱ细胞的表型
MOSE-Ⅰ和MOSE-Ⅱ细胞的表型不同。MOSE-Ⅰ细胞的早期细胞增长缓慢,而MOSE-Ⅱ的生长速率增加。形态学上,MOSE-Ⅰ细胞在倒置显微镜下开始失去上皮“鹅卵石”样外观(图1a、b)。MOSE-Ⅱ失去上皮“鹅卵石”样形态并转变为间充质长梭形(图1a、b)。在琼脂实验中,MOSE-Ⅱ细胞能够在软琼脂中形成克隆,而MOSE-Ⅰ则不能(图1c、b、d)。本研究还使用平板克隆形成实验测定评估了MOSECs的增殖能力,并发现MOSE-Ⅱ形成的克隆比MOSE-Ⅰ细胞形成的更大(图1f、g、h、i)。
二、对MOSE-Ⅰ和MOSE-Ⅱ细胞之间差异表达基因的分析
使用MOSE-Ⅰ和Ⅱ的细胞模型,并用Illumina HiSeq 2000 NGS平台对DEGs进行了分析。在第5代(P5),P15和P25分别随机选择MOSE-Ⅰ细胞,而在P50,P70和P90分别选择MOSE-Ⅱ细胞。其中,检测和分析了14 218个基因。发现总共263个DEGs,其中包括的182个上调的和81个下调(图2)。上调 DEGs的截点值是 log2 FC>2和P< 0.05,而下调的 DEGs是 log2 FC < -2,P< 0.05(表1)。
三、关于DEGs的GO,KEGG和PPI网络的生物信息分析
GO分析表明这些DEGs在细胞生物学中形成了几个重要分子功能,生物过程与细胞组分,如这些基因参与细胞增殖的正调节,RNA聚合酶Ⅱ启动子的转录正调节和信号转导(图3b)。KEGG信号通路富集显示这些DEGs形成的中枢基因富集在与卵巢癌相关的PI3K-Akt信号通路中(图3a),上述特征都与卵巢癌发展正相关[16-18]。此外,这些DEGs形成的PPI网络,如图4所示。此网络中有35个中枢节点基因其中包括27个上调基因和8个下调基因(表2)。

图1 MOSE-I和MOSE-II细胞的特征
四、DEGs形成的核心基因的表达与卵巢癌患者的总体存活率的关联性
本研究使用TCGA数据库中数据将这些DEGs形成的中枢基因的表达与卵巢癌患者的OS和DFS相关联。首先评估了来自263例浸润性卵巢癌患者的182个组织样本中,发现35个核心基因中有 4个(GMPS,PR,CD40和p21)基因在卵巢癌组织中的改变率超过10%(图5a)。然后,绘制了Kaplan-Meier曲线,并进行了对数秩检验,将它们与患者的OS和DFS相关联。本研究结果显示GMPS,PR,CD40和p21 mRNA的异常表达与患者中较差的OS相关(图5b),但与患者中的DFS无关(图5c)。
实际上,这4个基因在卵巢癌与正常组织中均差异表达。GMPS在卵巢癌组织中高表达(图6a),其与患者中RFS相关(图6e)。相反,在卵巢癌组织中PR,CD40和p21 mRNA的表达降低(图6b、c、d),这与不良的 RFS 相关(图6f、g、h)。
讨 论
本研究分析了恶变前的MOSE-Ⅰ和高度恶化的MOSE-Ⅱ细胞之间的DEGs,发现了182个上调的和81个下调的DEGs。生物信息学分析表明,这些DEGs能正调节细胞增殖,RNA聚合酶Ⅱ启动子的基因转录和信号转导,而KEGG通路数据显示这些DEGs可能与癌症中PI3K-Akt信号通路有关。此外,这些DEGs的PPI网络分析确定了35个中枢基因(27个上调基因和8个下调基因),其中4个与卵巢癌患者的总体存活率相关。此外这4个基因在卵巢癌组织与正常组织中均差异表达。具体而言,GMPS在卵巢癌组织中高表达,其与RFS相关,而PR、CD40和p21 mRNA的在卵巢癌组织中的表达降低,这与RFS不良相关。总之,本研究分析并鉴定了4个DEGs,其可以预测卵巢癌患者的总体存活率和无复发存活率。然而本研究结果在临床使用之前还需要进一步的前瞻性临床研究验证。
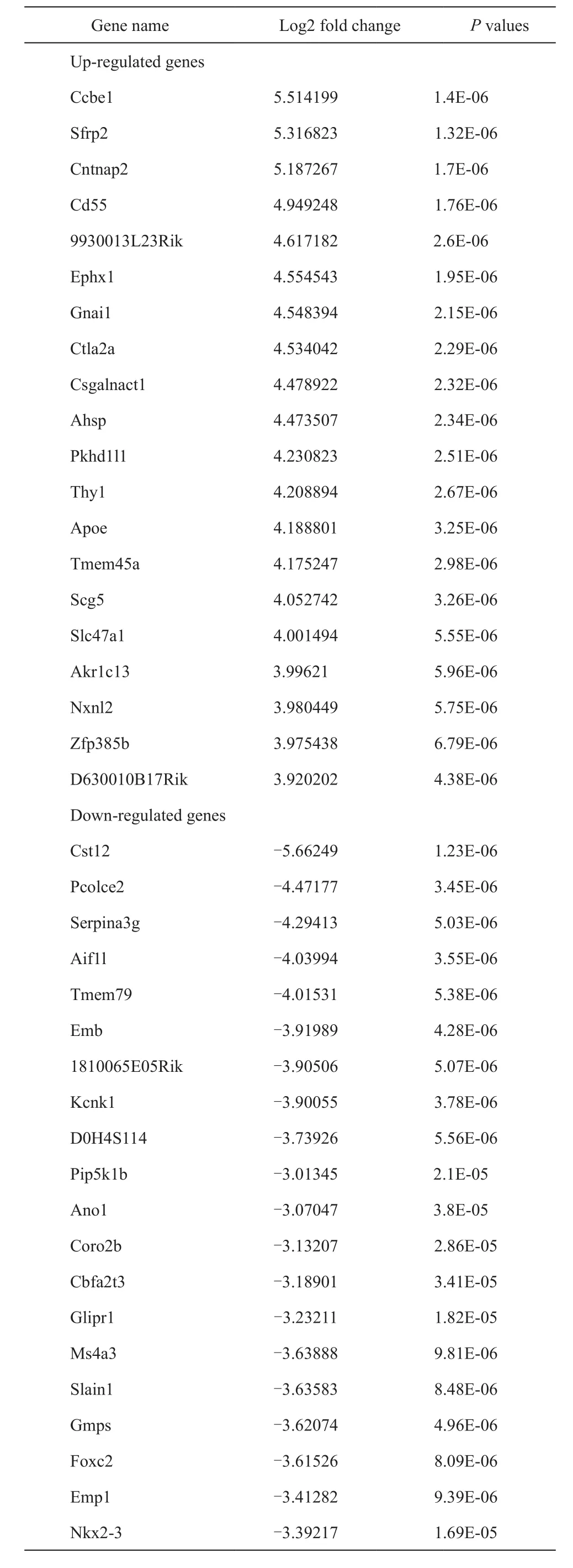
表1 MOSE-I和MOSE-II细胞之间的差异表达基因
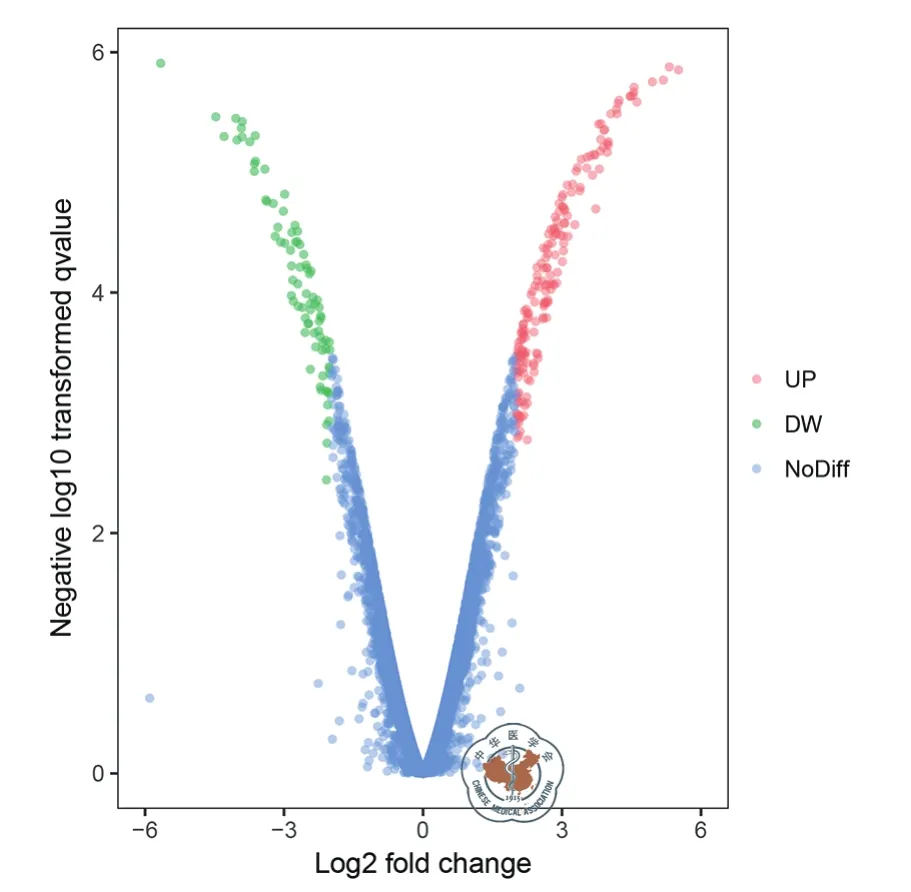
图2 使用火山图表示所有差异表达基因(DEGs)
这种卵巢癌体外恶性转化的细胞模型是用于鉴定基因改变和药物效应测试的有用工具。在该系统中,体外培养的MOSECs可以自发地恶性转化为卵巢癌细胞[10]。形态学上,MOSE-Ⅱ细胞失去了正常的上皮细胞“鹅卵石”特征,能够形成软琼脂集落以及基因改变。当将MOSE-Ⅱ细胞注射到免疫缺陷动物的腹膜腔中时,在小鼠腹膜腔中形成肿瘤转移和血性腹水[19-20],这是典型的人晚期卵巢癌患者的表现[21]。2014年McCloskey等[10]发现,MOSE-Ⅱ的差异表达基因与人类高级别浆液性卵巢癌(human high-grade serous ovarian cancer,HGSC)肿瘤样本及其卵巢癌细胞系的差异基因一致。免疫组化分析后的HGSC肿瘤组织证实MOSE-Ⅱ可作为HGSC的同源模型。MOSE-Ⅱ似乎比卵巢癌细胞系更具攻击性,体外克隆形成效率增加,体内肿瘤发作更快[10]。因此,这种细胞模型可用于未来的卵巢癌预防和治疗研究[22]。本研究使用该模型系统分析了MOSE-Ⅰ和MOSE-Ⅱ细胞之间的DEGs,构建PPI网络分析确定35个中枢节点的其中9个基因参与PI3K-Akt信号通路。这证实了先前研究结论,表明PI3K-Akt为卵巢癌的潜在治疗靶点[17]。PIK3CA突变或在高达30%的卵巢癌患者中扩增,而PTEN在40%的患者中表达丧失[16,23]。此外,这35个中枢基因中的6个是Rap1信号通路的一部分,之前的一项研究报道它们与浆液性卵巢癌转移相关[24]。
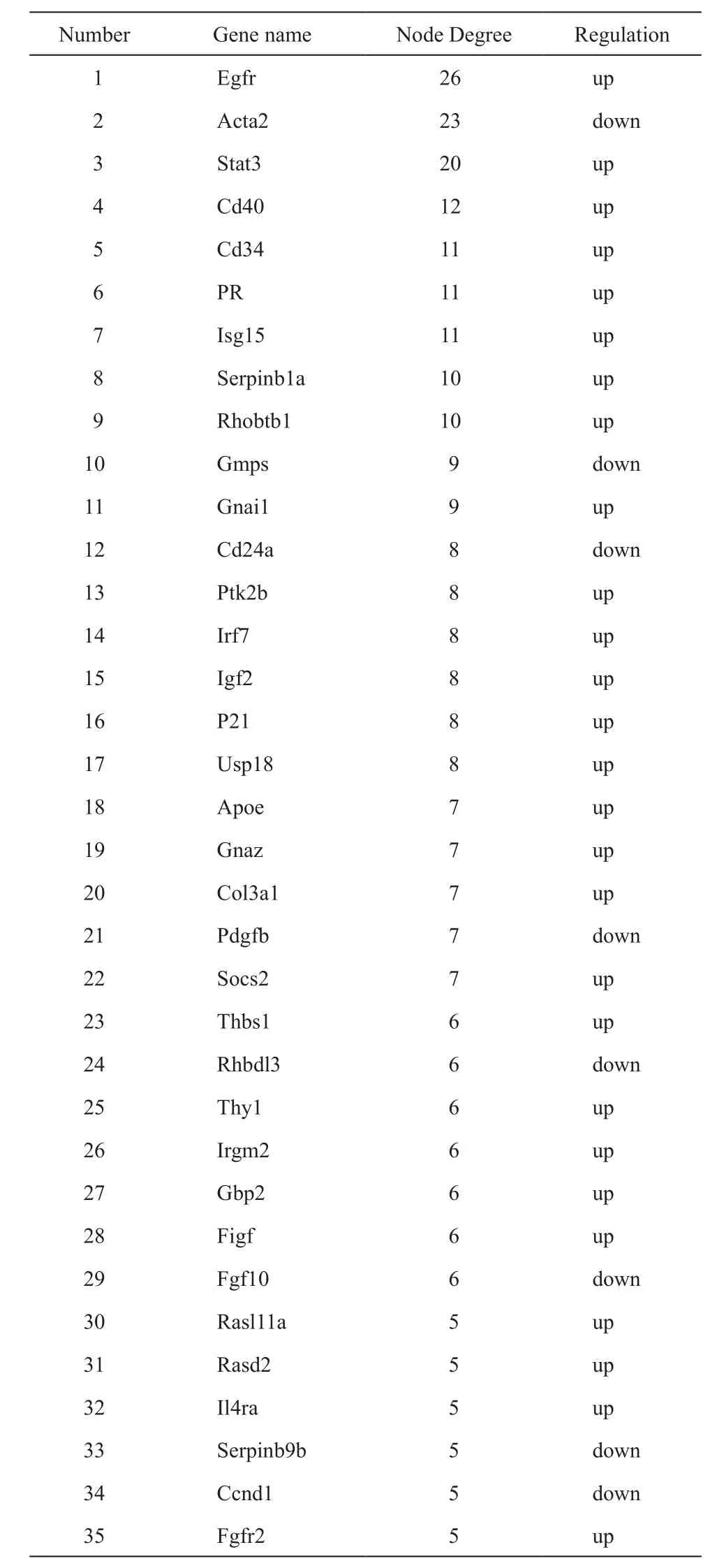
表2 在所有差异基因中,点度中心值大于5的核心基因
此外,GO分析显示这些DEGs参与正向调控细胞增殖,这是癌症六个基本标志之一:生长信号的自给自足[25]。实际上,细胞增殖的正向调节是癌症发生和发展的基础。在当前研究中鉴定出的每一种生物学途径都可以促进或将正常细胞转化为癌细胞[26]。本研究确定了4个基因特征来预测卵巢癌患者的总体存活率。GMPS是鸟苷5'-单磷酸合酶,是将黄嘌呤核苷一磷酸转化为鸟苷一磷酸的酶。因此,GMPS在正常细胞增殖和肿瘤发生中重要的核苷酸生物合成酶。Reddy的数据显示,TRIM21与USP7会联合GMPS形成了一种分子级联反应,可控制DNA损伤或核苷酸缺失时p53的稳定性。因此,GMPS是一种促进细胞生长和DNA复制的经典生物合成酶,也是p53限制细胞增殖的关键[27]。我们发现与非肿瘤组织相比,GMPS在卵巢癌组织中高表达,并且GMPS表达与患者的RFS相关尚未有相关文献报道。GMPS是肝癌细胞中重要的p53抑制靶点[28],这进一步表明了GMPS在肿瘤发生中的重要性。PR作为核受体,其功能是调节激素响应组织的发育和循环,例如乳腺和生殖道。之前的研究表明PR表达作为预测子宫内膜样和高级别浆液性卵巢癌预后较好的生物标志物[29-32],它会在卵巢癌的晚期缺失表达[33]。实际上,本研究也证实了以前的数据:孕酮和孕激素对卵巢癌的发生具有保护作用,PR的表达是卵巢癌患者无进展生存期延长有利的预后标志物[34-36]。CD40是跨膜糖蛋白和肿瘤坏死因子受体超家族的成员,其可介导多种免疫和炎症反应[37]。CD40经常在不同的免疫细胞、内皮细胞和上皮细胞中表达。CD40与CD40配体的结合会出现在人体的各种生理和病理过程[37-38]。CD40配体增强了上皮卵巢癌细胞对顺铂治疗的敏感性[39]。CD40在卵巢癌细胞系和肿瘤样品中高表达,但在正常卵巢组织中不表达[40]。本研究中,与MOSE-Ⅰ细胞相比,MOSE-Ⅱ细胞中CD40表达升高;然而,卵巢癌组织中CD40表达降低,这与先前研究的结果相反[40]。因此,需要进一步研究以确定这种差异的原因。p21也称为CDKN1A是细胞周期蛋白依赖性激酶抑制剂1A,其功能是通过抑制Cdks调节的细胞生长停滞,这是细胞周期从G1期转变为S期的关键[41]。通过与增殖细胞核抗原(PCNA)的相互作用,p21能够抑制DNA复制[18]。p21在正常组织中高表达,但在卵巢癌组织中减少,这与患者的更好的存活率相关,与先前的研究一致[42]。实际上,之前的研究表明吡啶衍生物诱导的卵巢癌细胞衰老是通过p21激活而发生的[43]。然而,其他研究报道CDKN1A/p21表达促进乳腺癌并介导其耐药性[44-45]。临床研究表明。p21高表达与胃癌和食管癌预后不良有关[46-47]。因此,需要进一步研究以澄清这种差异。
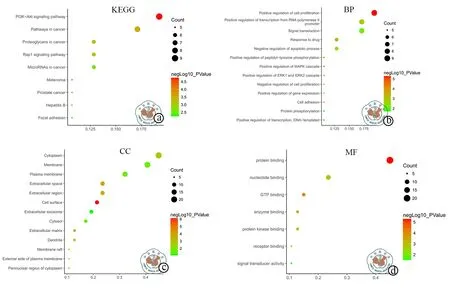
图3 DEGs形成的中枢基因的功能和通路富集分析

图4 差异表达基因形成的蛋白质-蛋白质相互作用网络
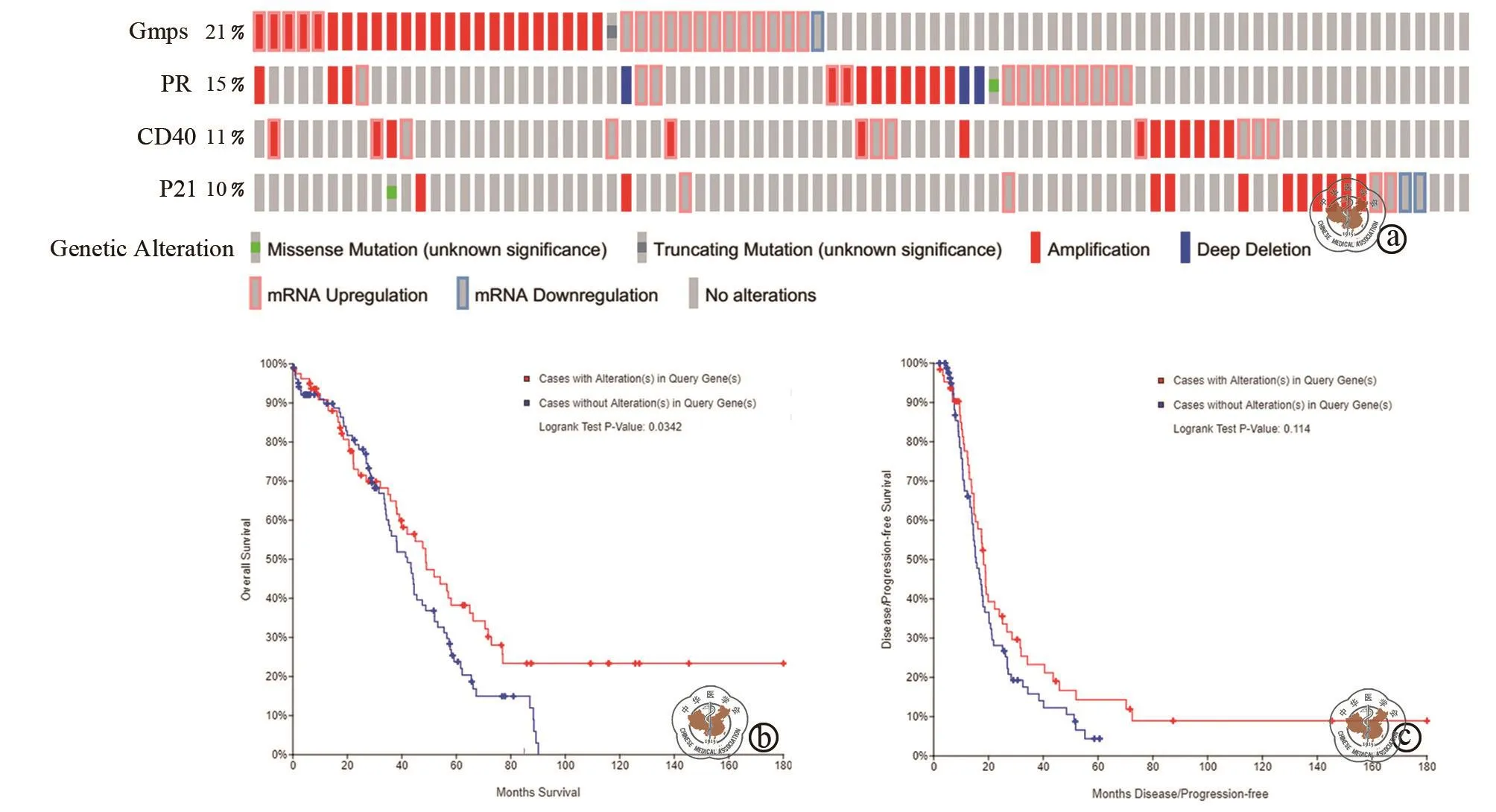
图5 前四个核心基因的鉴定与卵巢癌患者的存活率的关联性

图6 GMPS,PR,CD40和p21在卵巢癌和正常组织之间的差异表达以及与卵巢癌患者的无复发存活率的关系
当然,本研究确实存在一些局限性。例如,只是描述了卵巢癌中差异表达的基因,并将它们与卵巢癌的预后相关联,进行了生物信息学分析,将其中四种基因与卵巢癌进展联系起来;在对卵巢癌发生和进展中的生物学功能和作用还没有更多的研究。此外,在临床应用之前,还需要对卵巢癌中的这些DEGs进行进一步的验证。

