猪瘟病毒RT-LAMP检测方法的建立及初步应用
王韦华,刘桂梅,吴奇强,郭抗抗
(1.渭南职业技术学院,陕西渭南 714000;2. 渭南市动物疫病预防控制中心,陕西渭南 714000;3. 西北农林科技大学动物医学院,陕西杨凌 712100)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的重大传染病,严重危害养猪业的健康发展,是世界动物卫生组织(OIE)须通报动物疫病[1]。该病以感染猪发病急、持续高热、全身出血和白细胞减少为特征,发病率和死亡率都很高。国内在以免疫为主的防控措施下,典型CSF的发生大大减少,往往以非典型出现,临床症状出现多样性,与其他疾病难以区分,仅靠传统的临床检查、病理剖检难以做出准确诊断,需依靠实验室检测才能确诊[2]。常用的实验室检测方法有病毒分离鉴定、免疫荧光检测、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)等。分子生物学检测方法也有多种,包括逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)、荧光定量RT-PCR、环介导恒温扩增 技 术(loop-mediated isothermal amplification,LAMP)等。分子生物学方法具有快速、敏感、特异的明显优势,其中LAMP技术由于检测条件要求较低,在病原快速检测方面得到广泛应用。LAMP技术是Notomi等2010年发明的一种新型核酸扩增技术。该方法针对目的基因设计6条特异性引物,依赖一种具有链置换特性的DNA聚合酶,在等温条件下特异、快速、高效、灵敏扩增靶基因序列[3]。LMAP检测技术在动物疫病病原体检测领域研究众多:郑书轩等[4]、许宗丽等[5]分别基于伪狂犬病病毒(pseudo rabies virus,PRV)的保守基因片段设计特异性引物建立了快速检测PRV方法;陈希文等[6]针对猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的ORF5基因片段设计了4条引物,建立检测PRRSV的RT-LAMP方法;汤小真等[7]设计了一套基于猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)NP基因的特异性引物,在反应体系中加入了钙黄绿素指示剂代替SYBR GreenⅠ染料,建立了基于钙黄绿素检测PEDV的可视化LAMP方法;周玉鹏等[8]基于日本脑炎病毒(Japanese encephalitis virus,JEV)的Ⅰ型和Ⅲ型基因序列设计了RT-LAMP特异性引物,建立了用于快速检测JEV的方法。朱俊灵等[9]将LAMP与横向流动试纸条技术(lateral flow dipstick,LFD)相结合,设计了一套针对CSFV NS5B基因的特异性引物及生物素标记探针,其能结合异硫氰酸荧光素标记的扩增产物,从而建立了RT-LAMP-LFD检测方法;邓显文等[10]建立的可视化检测CSFV及特异性鉴别CSFV兔化弱毒疫苗株(HCLV)的逆转录环介导等温扩增技术,为临床检测CSFV野毒株及特异性鉴别HCLV毒株提供了技术支持。这些方法的应用为CSFV检测提供了可靠的依据,但由于一般实验室不具备相关实验条件,使得这些方法难以推广应用[11]。
为此,本研究利用RT-LAMP技术,针对CSFVNS5B基因设计了1组特异性检测CSFV的引物,并对反应条件进行优化,建立了适用于一般实验室快速准确检测CSFV的方法。
1 材料与方法
1.1 病毒株和临床样品
灭活的CSFV Shimen株、猪繁殖与呼吸综合征病毒(PRRSV)、猪传染性胃肠炎病毒(TGEV)等:西北农林科技大学兽医公共卫生与畜禽产品安全实验室保存;CSFV兔化弱毒疫苗(HCLV):中牧实业股份公司产品;猪细小病病毒(porcine parvovirus,PPV)疫苗:山东华宏生物工程有限公司产品;PRV疫苗:青岛易邦生物工程有限公司产品;JEV疫苗:武汉科前生物股份有限公司产品。
临床样品:采自陕西及周边省份(甘肃、宁夏)8个地区的100份临床样品,包括扁桃体、淋巴结、肺脏、肾脏组织各10份,血清60份(表1)。组织样品为出现临床症状,但未确诊疾病的猪组织;血清样品包括临床发病和健康猪的血清。所有样品均在-80 ℃保存。
1.2 主要试剂
Trizol试剂:宝生物(大连)工程有限公司产品;DNA提取试剂盒:北京全式金生物技术(TransGen Biotech)有限公司产品;RT-LAMP试剂:康为世纪有限公司产品;SYBR GreenⅠ核酸染料:购自格里斯医药化学技术公司;RTPCR试剂:北京天跟生化技术有限公司产品。
1.3 病毒核酸提取和cDNA合成
按照Trizol试剂说明书,分别提取CSFV、TGEV、JEV、PRRSV等RNA病毒核酸,提取总RNA进行浓度测定,按照反转录试剂盒说明书制备cDNA。按照DNA提取试剂盒说明书,分别提取PPV和PRV等的总DNA。

表1 临床样品检测来源 单位:份
1.4 引物设计与合成
参照GenBank中6株CSFV全基因序列( 登 录 号 JX898524、KY860532、KX586773、KX431227、KU375262、KU375259), 用 在 线软件MegAlign筛选各毒株共同保守的基因区段(NS5B基因区段),然后用Primer Explorer V5(http://primer explorer.jp/e/),针对NS5B基因保守区设计LAMP引物,包括2个外部引物(F3/B3)和2个内部引物(FIP/BIP)。引物序列如表2所示,由西安擎科泽西生物技术有限公司合成。

表2 CSFV RT-LAMP引物
1.5 反应体系构建
RT-LAMP的基本反应体系(25 μL):包括BstDNA 聚 合 酶 10 U,Betaine(5 μmoL/μL)1 μL,dNTPs(10 mmol/L)3.5 μL,MgSO4(100 mmol/L)1.5 μL,10×Themopol Reaction Buffer 2.5 μL, 外 引 物(F3/B3,10 pmol/μL) 各0.5 μL, 内 引物(FIP/BIP,10 pmol/μL)各4.0 μL,AMV反转录酶5 U,2 μL RNA模板。反应条件:63.5 ℃恒温作用1 h。
在LAMP基本的反应体系基础上,设置不同AMV酶使用浓度(2.5、5.0、7.5、10 U)、不同dNTPs使用浓度(0.8、1.0、1.2、1.4 mmol/L)及不同的反应温度(59、61、63、65 ℃),分别进行单因素试验。探究各个因素对RT-LAMP试验结果的影响,获得最佳反应参数,建立最佳CSFV RT-LAMP检测体系。
1.6 扩增特异性及产物检测
酶切产物经琼脂糖凝胶电泳检测,用凝胶成像系统检测扩增条带。白色沉淀检测:RT-LAMP反应后,根据反应液中是否出现白色沉淀判定扩增与否。SYBR GreenⅠ核酸染料检测:RT-LAMP反应后,加入1 μL SYBR GreenⅠ核酸染料,若反应液立即变绿,说明反应为阳性;若未变绿,则为阴性。在紫外灯下观察,发出白色荧光的为阳性,无荧光为阴性。
1.7 特异性检测
以 PRRSV、PPV、PRV、TGEV和 JEV核酸为模板,以CSFV LAMP引物,分别进行RTLAMP检测,以各病毒引物进行RT-PCR检测,分析其特异性。其中,CSFV引物由西北农林科技大学兽医公共卫生与畜禽产品安全实验室建立[11],其他病毒的引物见表3。

表3 各病毒引物信息
1.8 敏感性检测
以10-1、10-2、......、10-12稀释度的CSFV核酸为模板,分别进行RT-LAMP、RT-PCR检测,分析RT-LAMP的灵敏性。
1.9 临床样品检测
对从猪场收集的100个样品,分别进行CSFV RT-PCR和RT-LAMP检测,其中扁桃体、淋巴结、肺脏、肾脏组织各10份,血清样品60份。采用Trizol法提取病料的总RNA,同步进行RTLAMP、RT-PCR检测,评价RT-LAMP在临床样品中的应用效果。
2 结果
2.1 RT-LAMP检测方法的建立
通过分别设置不同的AMV反转录酶浓度、dNTPs浓度和反应温度,获得了最佳反应参数:低AMV反转录酶浓度时可得到清晰图谱,但泳带较浅,扩增效率低,10 U时扩增效率为最佳(图1-A);dNTPs浓度为1.4 mmol/L时,电泳条带最清晰,扩增效率最高(图1-B);BstDNA聚合酶最佳活性温度为63 ℃(图1-C),故选63 ℃作为LAMP的扩增温度。
综上所述,最佳CSFV RT-LAMP检测体系为25 μL:BstDNA 聚合酶 10 U,Betaine(5 μmoL/μL)1 μL,dNTPs(10 mmol/L)3.5 μL,MgSO4(100 mmol/L)1.5 μL,10×Themopol Reaction Buffer 2.5 μL,外引物(F3/B3,10 pmol/μL)0.5 μL, 内 引 物(FIP/BIP,10 pmol/μL)4.0 μL,AMV反转录酶10 U,2 μL RNA模板。反应条件:63 ℃恒温 1 h。
2.2 扩增产物检测
琼脂糖凝胶电泳法、SYBR GreenⅠ荧光法和白色沉淀法分别检测RT-LAMP扩增产物。RTLAMP扩增产物在凝胶电泳图谱上呈梯状(图2-A),说明是特异性扩增。白色沉淀法检测中,其中一管出现白色沉淀(图2-B),为阳性;而另一管为透明色,为阴性。通过SYBR GreenⅠ荧光检测,一管呈现绿色(图2-C),为阳性;另一管为橘黄色,为阴性。在紫外灯下观察,发出白色荧光的为阳性(图2-D),无荧光为阴性。另外,多次试验结果表明,白色沉淀法在目标核酸量较低时,结果判定容易发生误判,3种方法中最方便可靠的是SYBR GreenⅠ核酸染料检测法。

图1 CSFV RT-LAMP检测方法的优化结果
2.3 特异性检测
用所建立的RT-LAMP方法分别检测CSFV Shimen株、CSFV检测血清阳性样品、HCLV、PRRSV、TEGV、JEV的RNA,以及PRV、PPV的DNA,结果仅在CSFV检测管中出现扩增产物,其他管中均未见扩增产物出现(图3-A)。向反应管中加入1 μL SYBR GreenⅠ核酸染料,观察到CSFV管清晰的橙黄色,其余为浅绿色(图3-B)。在紫外灯下观察观察到CSFV管中能发出荧光,而其余的不能(图3-C)。
同时,设立这5种病毒的特异性引物并进行RT-PCR检测,结果如图3-D。可以看到CSFV Shimen株、CSFV检测血清阳性样品、HCLV样品在441 bp的位置出现条带,而JEV、TGEV、PRRSV、PRV、PPV 分 别 在 375、276、400、700、445 bp的位置出现条带,证明这5种病毒均为阳性。
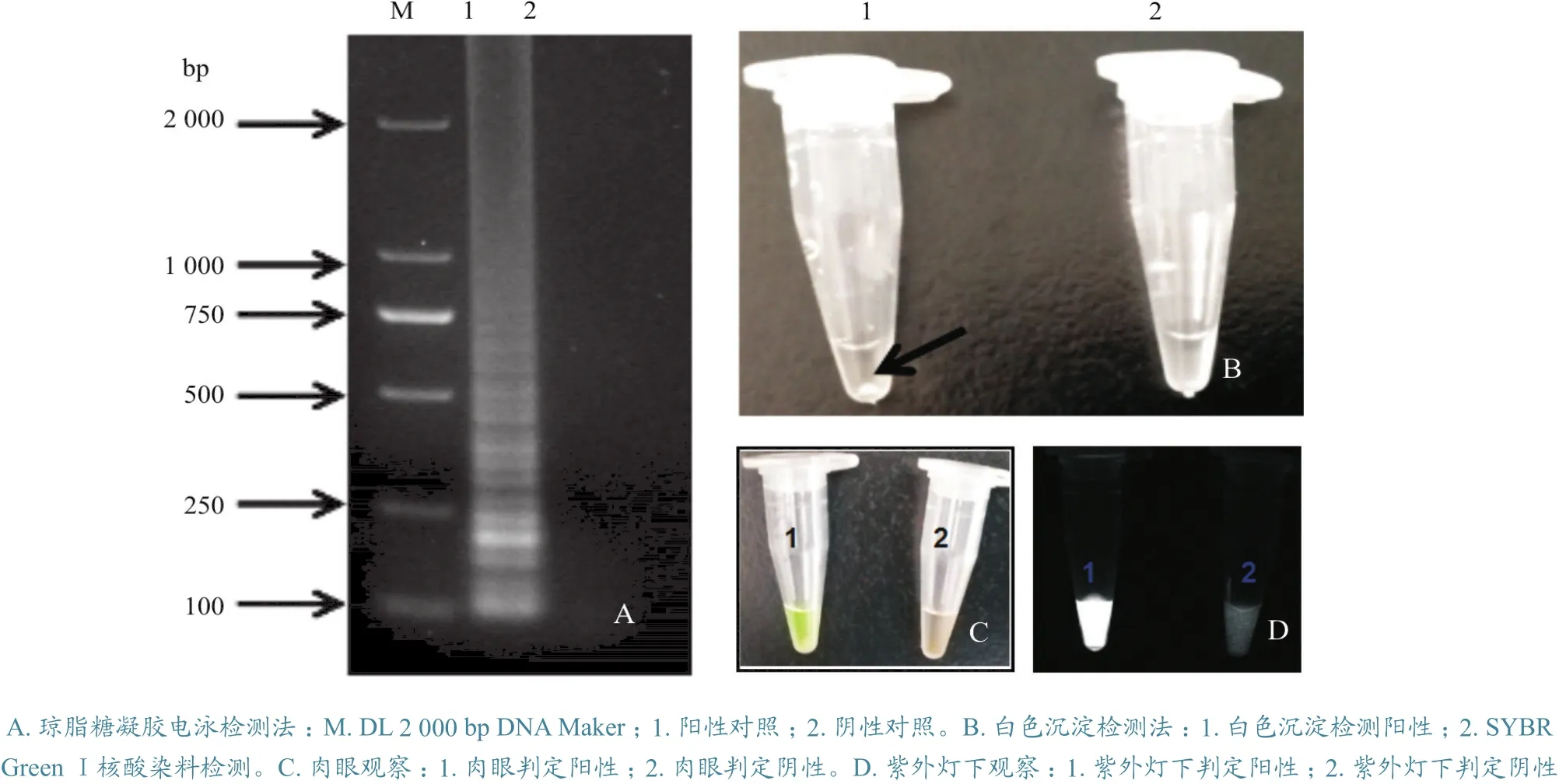
图2 不同RT-LAMP扩增产物检测方法的选择检测结果
2.4 灵敏性检测
由图4-A可以看出,RT-LAMP反应产物随着RNA浓度的降低,条带亮度先变亮,然后亮度逐渐减弱,RNA检测的最低浓度为1.58×10-7ng/μL。由图4-B可以看出,随着RNA浓度的降低,RT-PCR反应产物逐渐减弱。检测的最低模板RNA浓度为1.58×10-5ng/μL。RT-LAMP反应产物和 RT-PCR反应产物的剩余部分加入核酸荧光染料用于肉眼观察,可见1~9管的RT-LAMP反应产物呈现明显的黄绿色,10管为浅绿色,11、12、13管为淡橙色(图4-C);与电泳检测结果相符。在紫外灯下观察,可见1~9管的RT-LAMP反应产物发出明显的荧光,10、11、12和13管没有荧光(图4-D)。

图3 CSFV RT-LAMP特异性检测结果
特异性反应中加入SYBR GreenⅠ核酸染料可视化观察和紫外灯照射观测的最低检测浓度与琼脂糖凝胶电泳结果一致,用于RT-LAMP测定和RT-PCR测定的模板RNA最小可检测浓度分别为1.58×10-7和 1.58×10-5ng/μL,表明 RT-LAMP 测定方法比RT-PCR测定方法更灵感。

图4 CSFV RT-LAMP灵敏性检测结果
2.5 临床样品检测
采用本研究建立的RT-LAMP检测方法和已建立的CSFV RT-PCR检测方法[12-13],对从猪场收集的100个样品分别进行CSFV的RT-PCR和RTLAMP检测,其中扁桃体、淋巴结、肺脏、肾脏组织各10份,血清样品60份。RT-PCR检测结果显示,100份样品中,有10份样品扩增后和预期片段大小相匹配。RT-LAMP检测结果显示,100份样品中,有13份样品RT-LAMP检测为阳性,其中10份检测结果与RT-PCR一致,另外3份检测结果与RTPCR不同。样品RT-PCR检测阳性率为10.0%,RT-LAMP检测阳性率为13.0%,表明RT-LAMP方法比RT-PCR方法具有更高的检出率。RT-PCR和RT-LAMP临床部分样品检测结果见图5。
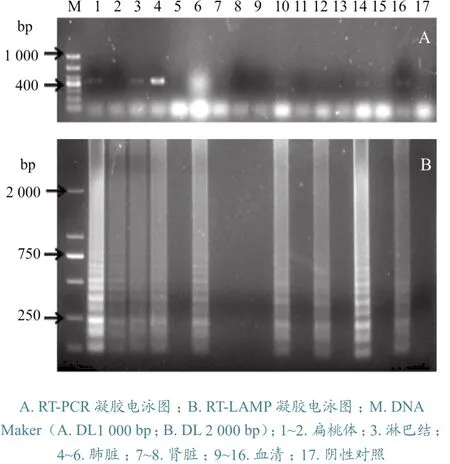
图5 RT-PCR和RT-LAMP临床部分样品检测结果
3 讨论
根据反应条件不同,核酸扩增技术可以分为两大类:非等温扩增技术和等温扩增技术,分别以PCR和LAMP为代表。LAMP操作简单、快速、灵敏度高,不仅适用于实验室检测,也适用于基层、场区现场检测。该技术自发明以来引起各国科学家的关注,正在进行更深入的研究和条件探索,已广泛用于病原微生物检测、动物胚胎性别分化、转基因食品检测等,具有很好的前景。
LAMP技术具有特异、敏感、扩增条件要求低等优点,在动物病原检测方面有着广阔的应用前景。闫兴华等[14]运用LAMP建立了对转基因玉米(Zea maysL.)LY038外源基因的快速检测技术。该方法依据cordap A基因序列设计了4条特异性引物,结果表明引物特异性良好。该检测体系在63 ℃恒定温度下,反应50 min,可检测到0.01%的样本,是常规PCR方法的5倍。潘宏等[15]分别设计了水牛SRY基因和12SrRNA基因雄性特异性引物用于LAMP法胚胎性别鉴定,同时用PCR对LAMP法鉴定结果进行验证,结果表明优化的LAMP法对水牛早期胚胎性别鉴定的准确率与检出率均为100%,检测灵敏度为2×10-5ng。Poon等[16]将提取的禽流感病毒稀释成不同的浓度,分别用PCR和LAMP方法进行检测,在1 h内LAMP方法检测最低下限为10-3PFU,而PCR为10-2PFU,说明LAMP方法敏感性比PCR高,而且反应过程中所生成的白色沉淀物可以通过肉眼观察;Ono等[17]根据新城疫病毒融合蛋白基因设计了RT-LAMP特异性引物,建立了新城疫病毒检测方法,同时直接对分离培养物和临床样品进行检测,发现其灵敏度和特异性与套式PCR一致;高志强等[18]针对PEDVM基因设计了一套引物,建立了可特异性扩增PEDV的RT-LAMP可视化检测方法。范晴等[19]根据口蹄疫病毒(FMDV)3D基因和水泡性口炎病毒(VSV)N基因保守序列,设计了2套特异性引物,在每套引物的内引物中插入酶切位置EcoRⅠ,对反应条件进行了优化,建立了恒温快速的检测方法。李健等[20]根据CSFV多聚蛋白基因保守区段设计了RT-LAMP特异性引物,发现建立的方法能够以10-5的稀释度检测靶标病毒核酸,比普通RT-PCR灵敏100倍,比real-time RT-PCR高10倍。孙兴娟等[21]建立了CSFV野毒株RT-LAMP可视化检测方法,发现该方法具有LAMP扩增反应的高效率性和LFD方法的简单性,可以在几分钟内读取结果。上述建立的两种检测方法灵敏,可与RT-PCR相媲美。熊炜等[22]建立了猪肺炎支原体LAMP检测方法,通过在LAMP反应产物中加入显色液,提高了检测结果肉眼判定的准确性,实现了结果判定可视化的目标,有助于出入境口岸货物查验现场及猪场中猪肺炎支原体的检测。兰德松等[23]根据CSFV基因组的NS5B基因片段,针对NS5B基因6个位点设计了4条RT-LAMP扩增引物,发现建立的方法能特异性检出CSFV,而PRV、PPV、PRRSV、PCV、FMDV等病毒扩增结果均为阴性。该方法与CSF荧光RT-PCR方法相比,其特异性无明显差异,而敏感性却高10倍。
本试验建立的最优RT-LAMP体系的分析检测限为1×10-7拷贝的CSFV,比基于凝胶的一步反转录聚合酶链式反应(RT-PCR)灵敏度高约100倍。优化后的RT-LAMP体系可特异性扩增CSFV Shimen株、CSFV检测血清阳性样品、HCLV,并可与TGEV、PPV、PRV、JEV和PRRSV相互鉴别。通过筛选一组临床标本(N= 100),发现该方法特异性与RT-PCR保持一致,而灵敏度却比RTPCR高100倍。本试验中使用了SYBR GreenⅠ核酸染料,肉眼便可观察到颜色变化,并可通过肉眼观察到颜色变化来判定结果;在紫外灯下观察,阳性样品出现强烈荧光,阴性则无。此外,对RTLMP扩增产物进行检测的方法有3种,包括凝胶电泳检测法、白色沉淀检测法和荧光检测法。多次试验表明,白色沉淀法在目标核酸量较低时,容易出现误判,凝胶电泳检测法有一定的实验条件限制,而在RT-LAMP反应液中加入SYBR GreenⅠ核酸染料,可在几分钟内观察到结果,且与凝胶电泳结果一致,故最方便可靠的是荧光检测法。
在RT-LAMP体系中,通过对dNTPs浓度、AMV反转录酶浓度以及扩增温度3个因素进行优化,即可获得理想的试验结果。本试验是基于RTLAMP技术操作方便、快速、灵敏的优点,设计建立了CSFV可视化单管一步RT-LAMP检测方法,用以诊断和监测CSFV感染,从而为CSF的现场快速诊断提供了一种更加简便的方法。

