传染性造血器官坏死病毒RT-LAMP检测方法的建立
韩姝伊,何亚鹏,时 晓,杜迎春
(1. 河北师范大学,河北石家庄 050024;2. 北京市水生野生动植物救护中心,北京 102100)
传染性造血器官坏死病(infectious haematopoietic necrosis,IHN)是极易对冷水鱼养殖造成严重危害的鱼类急性全身性传染病,是世界动物卫生组织(OIE)规定的须通报动物疫病,是我国的二类动物疫病、一类鱼类口岸检疫疫病[1-2]。目前,该病呈全球分布,在我国以及法国、意大利、德国、英国、日本、韩国、俄罗斯等国家均有暴发。在我国,IHN 1985年在东北地区首次报道发现,目前在北京、河北、辽宁、吉林、山东、甘肃、青海、四川、新疆、云南等地均有分布,并呈蔓延趋势[1,3]。IHN病原为弹状病毒科诺拉弹状病毒属的传染性造血器官坏死病 毒(infectious haematopoietic necrosis virus,IHNV),其形态为子弹状,有囊膜包被[2,4]。根据基因差异,IHNV可分为U、M、L、E和JRt 5个基因型,其中JRt基因型主要分布于我国以及日本和韩国等亚洲国家[5-7]。IHNV主要危害鲑鳟鱼类的鱼苗及幼鱼,导致鱼苗死亡率极高,可达100%[5-6]。我国近几年冷水鱼养殖业发展迅速,因而需警惕IHNV威胁,及时做好防控,防止其对冷水鱼养殖产业造成严重危害。
IHN可通过临床和病理诊断进行初步判断,对其确诊则需进一步的实验室检测。目前检测IHNV的方法主要有病毒分离培养、抗体中和试验、免疫组化法、ELISA以及RT-PCR等[7-9]。这些方法一般费时费力,且对试验平台要求很高,需要一些专业设备。逆转录环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification,RT-LAMP)具有操作简便、快速、特异性强等优点,不需很专业的仪器设备,仅在水浴锅中即可完成扩增,特别适用于基层及现场快速诊断[10]。本研究针对IHNV糖蛋白基因的特定区域设计3对特异性引物,并在反转录酶和BstDNA聚合酶作用下,对靶序列进行等温核酸扩增反应,建立了简单、快速、灵敏度高、特异性好的IHNV检测方法,从而丰富了实验室和现场检测IHNV的手段。
1 材料与方法
1.1 毒株
IHNV BJSY株(GenBank登 录 号MH374162):由本实验室分离保存;鲤春病毒血症病毒(spring viraemia of carpvirus,SVCV)、牙鲆弹状病毒(hirame rhabdovirus virus,HRV)灭活病毒:购自美国菌种保藏中心;病毒性出血性败血症病毒(viral haemorrhagic septicaemia virus,VHSV)灭活病毒:购自中国典型培养物保藏中心。
1.2 RT-LAMP 引物设计与合成
对GenBank 收录的多条IHNVG基因序列进行比对,选取IHNV特异性保守区段,利用在线软件 Primer Explorer V5(http://primerexplorer.jp/e/),针对G基因保守区设计3对RT-LAMP专用引物,序列见表1,引物由华大基因公司合成。将引物均稀释为20 pmol/μL,-20 ℃保存备用。

表1 G基因RT-LAMP 引物序列
1.3 病毒RNA 提取
取200 μL 病毒液于无RNA 酶的离心管中,用Star Spin病毒RNA提取试剂盒(北京康润诚业生物科技有限公司)提取病毒RNA,分装,使用A one 超微量全光谱分光光度计(北京同立创辉仪器有限公司),测定提取到的病毒样品RNA 浓度,用DEPC 处理水稀释RNA样品为50 μg/mL,置
-80 ℃保存备用。
1.4 RT-LAMP 检测方法建立及优化
建立25 μL的RT-LAMP 扩增反应体系,体系包含对应于G基因的6 条引物:F3-G与B3-G各0.5 μL,FIP-G与BIP-G各2 μL,LF-G与LB-G各1 μL,dNTP(10 nmol/L)2.5 μL,10×ThermoPol反 应 缓 冲 液 [20 mmol/L Tris-HCl、10 mmol/L KCl、10 mmol/L (NH4)2SO4、2 mmol/L MgSO4、0.1% Triton X-100]2.5 μL,以及 8 UBst2.0 DNA聚合酶(NEB公司),10 U AMV 反转录酶(诺唯赞生物科技有限公司),1 μL IHNV的RNA样品(50 μg/mL),用无RNA 酶水补齐至 25 μL,混匀。同样的体系设立5个样品,分别编号1~5。将5个样品分别在61、62、63、64、65 ℃恒温水浴锅内反应40 min,随后都转移至80 ℃水浴2 min用以灭活BstDNA 聚合酶。反应结束后,将扩增产物各加入1 μL 50 倍稀释的SYBR Green I,轻轻震荡,直接观察反应液颜色变化,判断结果。取4 μL产物用1.5%琼脂糖进行凝胶电泳,观察结果,确定最佳反应温度。
1.5 RT-LAMP 特异性试验
分别取IHNV、SVCV、HRV 和VHSV基因组RNA(50 μg/mL)各1 μL为模板,构建RT-LAMP体系,利用建立的RT-LAMP 检测方法进行特异性对比试验,同时以去离子水为模板,相同体系和条件反应作为阴性对照。将扩增结束后产物加入1 μL 50倍稀释的SYBR Green I,轻轻震荡,直接观察反应液颜色变化,并利用1.5%琼脂糖凝胶电泳,对比检测结果。
1.6 RT-LAMP 灵敏性试验
将提取的IHNV RNA(50 μg/mL)作10 倍梯度稀释(5.0×100~5.0×10-5μg/mL),每个稀释度各取1 μL构建RT-LAMP体系,采用优化过的条件进行灵敏性试验。将扩增产物加入1 μL 50 倍稀释的SYBR Green I,轻轻震荡,直接观察反应液颜色变化,并利用1.5%琼脂糖凝胶电泳,对比检测结果,得出该方法能检测IHNV核酸的最低浓度。
1.7 重复性试验
利用建立的RT-LAMP 检测方法,在不同时间,对同一阳性IHNV的RNA样品进行检测,同时设立阴性对照,以验证本方法的稳定性。
1.8 RT-LAMP临床检测
从河北省多个养殖场采集疑似患IHN的虹鳟鱼幼鱼(体质量15 g左右),挑选10条,采集肝组织,分别用Star Spin病毒RNA提取试剂盒提取RNA,编号分别为1~10。各取1~10号RNA样品1 μL,利用本试验建立的IHNV RTLAMP 进行检测,并利用1.5%琼脂糖凝胶电泳验证检测结果;同时对1~10号RNA样品,利用之前已经建立的IHNV RT-PCR方法进行检测[11]。先用反转录试剂盒将提取的RNA进行反转录,然后以反转录产物为模板,上游引物为5'-CACCGTACTTTGCTGCTAC-3',下游引物为5'-TCAAGGGGGGAGTCCTCGA-3',目的片段为786 bp,进行PCR扩增。PCR 程序为:94 ℃ 预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 25 s,25 个循环;72 ℃再延伸5 min,然后将扩增产物用1%琼脂糖凝胶进行电泳。观察结果,对比分析该方法在临床检测上的适用性。
2 结果与分析
2.1 RT-LAMP 反应温度优化
将5组 25 μL 反应体系分别在 61、63、65、67、69 ℃恒温水浴锅内反应40 min,随后转移至80 ℃水浴2 min;各加入1 μL 50 倍稀释的SYBR Green I,混匀,观察颜色变化。结果显示:当扩增温度为61、63、69 ℃时,扩增产物加入SYBR Green I 后仍为SYBR Green I的原始颜色红棕色(图1-A),电泳没有出现阶梯状电泳条带(图1-B);在65、67 ℃时,扩增产物加入SYBR Green I后变为荧光绿色(图1-A),电泳出现阶梯状电泳条带(图1-B)。该显色结果与凝胶电泳结果相符,3次重复试验的结果也一致,表明该方法在温度为65、67 ℃时可以有效扩增,67 ℃时颜色变化更显著,条带更亮,所以本试验将67 ℃作为该方法的最佳扩增温度。

图1 RT-LAMP反应条件优化结果
2.2 RT-LAMP 特异性试验
IHNV、SVCV、HRV和VHSV基因组结构相似,同属水生动物弹状病毒,感染鱼类后的临床症状也基本相似不易区分;采用RT-LAMP方法进行检测,也容易受相似核酸模板和一些污染物干扰,导致出现假阳性扩增。因此,本试验利用SVCV、HRV、VHSV和ddH2O作对照,检测该RT-LAMP方法的特异性。结果显示:以IHNV RNA为模板进行RT-LAMP 扩增后,产物加入SYBR Green I,混匀后变为荧光绿色(图2-A),凝胶结果呈特异性阶梯状条带(图2-B);以SVCV、HRV、VHSV和ddH2O为模板,按相同体系和条件进行RT-LAMP 检测,发现产物呈红棕色(图2-A),凝胶电泳无特异性阶梯状条带出现,结果为阴性(图2-B);进行3次重复试验,发现结果一致。上述结果说明,本试验建立的RT-LAMP 检测方法具有良好的特异性。
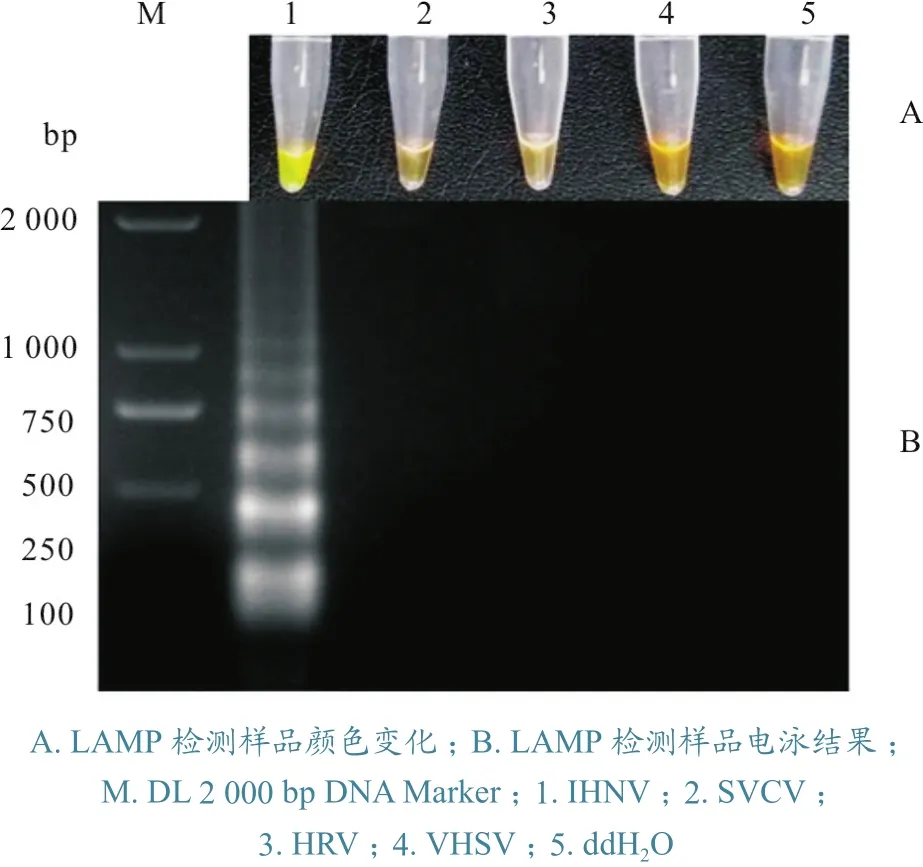
图2 RT-LAMP 特异性检测结果
2.3 RT-LAMP灵敏性试验
分 别 以 5.0×10-3、5.0×10-4、5.0×10-5、5.0×10-6、5.0×10-7、5.0×10-8μg 的 IHNV RNA 为模板,利用建立的RT-LAMP 检测方法,分析该检测方法的灵敏性。观察扩增产物加入SYBR Green I后的颜色变化,取4 μL经1.5%琼脂糖凝胶电泳,观察验证可视化检测结果。结果显示:当病毒RNA为 5.0×10-3~5.0×10-7μg 时进行 RT-LAMP 反应,产物在加入SYBR Green I 后变成荧光绿色(图3-A),电泳特异性阶梯状条带(图3-B);当病毒RNA为5.0 ×10-8μg时,产物加入SYBR Green I后颜色不变,仍为红棕色(图3-A),电泳也无特异性阶梯状条带(图3-B);进行3次重复试验,结果一致。上述结果说明,本试验建立的RTLAMP 检测方法具有较高的灵敏度,最低可检测5.0×10-7μg 的 IHNV RNA。

图3 RT-LAMP 灵敏性检测结果
2.4 重复性试验
经过3次重复性试验,IHNV的RNA样品均能检出阳性,而阴性对照无扩增,结果一致,证明本试验所建立的RT-LAMP检测方法具有良好的重复性和稳定性。
2.5 RT-LAMP 临床应用检测
将提取的10个临床样品RNA,利用本试验建立的IHNV RT-LAMP 方法进行检测,同时利用之前已建立的RT-PCR方法进行对比检测,结果发现1号、4号和5号样品呈现荧光绿色,样品中检出IHNV,其余7个样品呈红棕色,未检出IHNV(图4-A);琼脂糖凝胶电泳结果显示,1号、4号和5样品出现电泳特异性阶梯状条带,为IHNV阳性,其余7个样品为阴性(图4-B)。该试验结果与之前建立的RT-PCR方法检测结果一致,1号、4号和5样品出现786 bp的目的条带,为阳性(图4-C),证明RT-LAMP可应用临床检测。
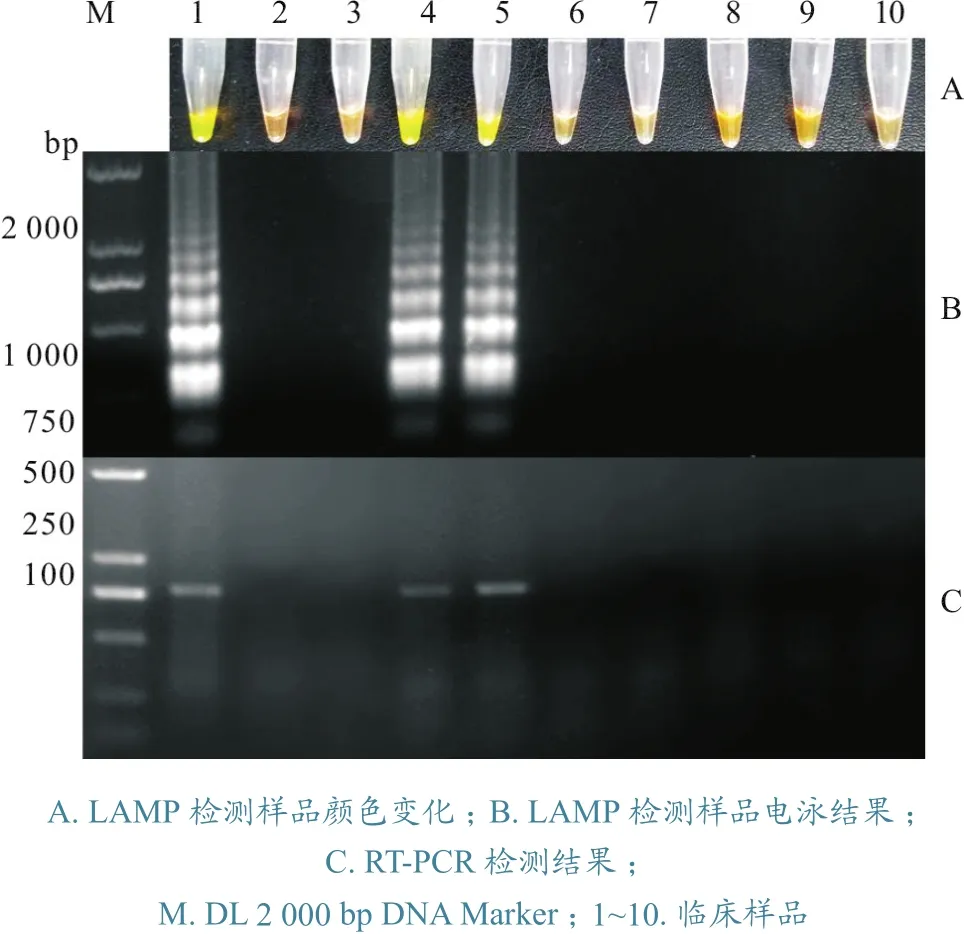
图4 临床样品检测结果
3 讨论
IHNV是水产养殖业中最严重的病毒性病原之一,感染的鱼类主要为冷水鱼,如虹鳟、河鳟、太平洋鲱、大西洋鲑、各类大麻哈鱼和管吻刺鱼等[12-13]。最早报道的IHNV基因型为U、M、L,主要分布在北美;欧洲流行的毒株主要为基因E型,亚洲的日本、韩国、中国(包括台湾)流行的毒株主要为JRt型[14-15]。IHNV对鱼苗致死率极高,一旦引发疫情,难以控制。如果IHNV在我国冷水鱼养殖地区长期流行,势必会蔓延发展,造成严重危害。为保障相关经济鱼类养殖和珍稀鱼类保护工作,需要警惕IHN暴发,采用先进方法快速确定病原,及时做好防控。
近年来,环介导等温扩增技术(LAMP)操作简单、结果相对可靠,逐步被广泛应用于病原体检测。国内外已建立了多种病毒的LAMP检测方法[11,15]。本试验建立的IHNV RT-LAMP检测方法,可以一步完成反转录和环介导等温扩增,降低了中间过程造成的污染风险。该方法针对该病毒G基因保守片段设计了3对引物,特异性好,避免了相似弹状病毒的干扰,又能准确检出病毒。该方法利用荧光染料直接染色,通过染料颜色的变化或者凝胶电泳方法就可直接观察结果,易于判断。
浊度分析仪也可以通过检测LAMP的焦磷酸盐沉淀来判定LAMP检测结果,但在实际中发现,该方法的检测灵敏度较差,不如荧光染料法和电泳法。LAMP方法简单快捷,具有很多优点,适用于基层及现场快速诊断,但由于LAMP方法扩增非常高效,容易在空气中形成核酸片段的气溶胶污染,在封闭环境下,长期检测同类样品时容易出现假阳性,因此需要特别注意,防止管内的核酸片段扩散到封闭环境的空气中。如果需要封闭环境,长期检测同类样品,可以在反应前将稀释的SYBR Green I小心加到装有样品的PCR管盖上,待反应结束后,不开盖,直接离心,使SYBR Green I落入管底,漩涡震荡混匀后即可观察颜色变化,这样可防止开盖引起的气溶胶污染,避免假阳性出现。
4 结论
本研究建立的IHNV RT-LAMP检测方法,具有操作简便、快速、灵敏度高等优点,不需很专业的仪器设备,仅在水浴锅中即可完成扩增,适用于基层及现场快速诊断。该方法的建立丰富了实验室和现场检测IHNV的手段,对IHN的快速诊断及防控具有重要意义。

